苦参碱不同给药途径对小鼠肠道菌群的影响
曹志刚 王 弘 张 华 孙盼盼 孙耀贵 范阔海 尹 伟 李宏全 孙 娜*
(1.山西农业大学 动物医学学院,山西 太谷 030801;2.山西农业大学 体育部,山西 太谷 030801;3.山西农业大学 实验动物管理中心,山西 太谷 030801)
猪病毒性疾病给我国乃至世界养猪业造成了巨大的经济损失,尤其是2006年爆发的高致病性猪繁殖与呼吸综合症和2018年爆发的非洲猪瘟。目前针对病毒性疾病的主要防控方法是疫苗免疫,但面对新型病毒性疾病的突发以及病毒感染后造成的损伤,仍无高效防控方法。中药在控制“非典”[1]、甲型H1N1流感[2]以及新冠肺炎[3]中发挥了巨大作用,同时在控制动物病毒性疾病的临床应用中也显示了良好的功效。现已有大量文献证明苦参碱具有抗氧化[4-6]和抗肿瘤[7-8]等多种药理作用。
大量研究表明肠道微生物与多种疾病密切相关,深刻影响着疾病的治疗与临床研究,包括糖尿病[9]和炎症等[10]。肠道菌群的研究对疾病的预防和治疗有着至关重要的意义。一些药物也会对肠道菌群的结构和功能造成一定的影响,陈琛等[11]研究发现,灌服党参、茯苓、白术、白芍和陈皮五味中药制成的复方合剂后小鼠肠道菌群与灌服前比较,乳杆菌、双歧杆菌数量明显增加,肠球菌数量明显减少,说明该复合剂对肠道菌群具有一定的调节作用。梁小瑞等[12]研究发现,金银花、紫花地丁和连翘均可使肠道OTU数目增多,在不同程度上促进有益菌群繁殖,抑制致病菌群生长,具有调节肠道菌群结构的作用。实验室前期探究发现,苦参碱可以显著增加昆明小鼠粪便中嗜酸乳杆菌(益生菌)的丰度,影响肠道菌群的物种组成。有研究表明,同一药物给药途径的差别对机体造成的影响存在差异,吕圭源等[13]研究发现,黄芪生脉多糖采用腹腔注射的给药方式能增强小鼠的免疫功能,而灌胃给药对免疫功能基本无影响;Urszula等[14]研究发现,与灌胃相比,通过腹腔注射给予大鼠同等剂量的乙醇会导致其体重减轻;孙洁等[15]发现金银花注射液具有增强非特异性免疫功能的作用,且腹腔注射给药组优于灌胃给药组。
本课题组前期筛选获得了十几种具有抗病毒作用的天然化合物,其中从苦参中提取的苦参碱具有水溶性好、安全范围广等优点。本实验室前期已分别从体外细胞模型和小鼠模型证实了苦参碱对猪繁殖与呼吸综合症病毒和猪圆环病毒有直接抑制作用[16-17],但其作用机理尚需进一步研究。苦参碱一般选择腹腔注射或灌胃这2种给药途径,但苦参碱的不同给药途径是否存在差异依然未知。本研究从小鼠肠道菌群的角度,通过腹腔注射或灌胃给予小鼠苦参碱,探究苦参碱腹腔注射及灌胃2种给药途径对肠道菌群的影响,以期为临床上确定苦参碱的给药途径提供理论依据。
1 材料与方法
1.1 试验材料
清洁级昆明小鼠,雌性,18~22 g,购自北京维通利华实验动物技术有限公司;苦参碱,纯度为98%,购买于南京泽朗生物科技有限公司。
1.2 试验分组及设计
将30只昆明小鼠随机分为4组,分别为苦参碱腹腔注射组(MTip)、苦参碱灌胃组(MTig)、生理盐水腹腔注射组(NCip)和生理盐水灌胃组(NCig),苦参碱组每组各10只,生理盐水组每组各5只。适应性饲养1周后,苦参碱剂量参考实验室前期试验结果[18],按照0.2 mL/10 g容积,分别腹腔注射或灌胃苦参碱(40 mg/kg),一日2次(早8:00,晚20:00各一次)连续给药5 d,对照组等体积腹腔注射或灌胃生理盐水。
1.3 小鼠粪便收集
末次给药后24 h,对小鼠腹部按摩,促使其排便,迅速将粪便收集至无菌管中,液氮速冻,-80 ℃保存。
1.4 粪便样品16S rDNA肠道菌群结构谱测序分析
对合格的粪便进行DNA提取,并通过PCR技术对指定区域扩增,扩增用引物为细菌16S rDNA (V3+V4)区域引物:338F:5′-ACTCCTACGGG-AGGCAGCA-3′,806R:5′-GGACTACHVGGG-TWTCTAAT-3′。随后通过文库制备、文库质检筛选合格的文库,通过Illumina HiSeq测序平台测序分析。DNA提取、PCR扩增及测序均由百迈客生物技术公司协作完成。
使用Mothur软件进行α多样性指数分析,对各个样品的α多样性指数进行评估。
使用QIIME软件进行β多样性分析。ANOSIM分析是β多样性分析中的一种分析方法,ANOSIM分析常通过加权和非加权2种算法计算样品间的距离,从而进行组间相似性的统计分析。
LEfSe(Line discriminant analysis (LDA) effect size)能够在不同组间寻找具有统计学差异的标记性质物种(Biomarker)。
通过Metastats软件对组间的物种丰度数据进行t检验,从而筛选出导致2组样品组成差异的物种。
1.5 统计分析
试验数据以平均数±标准差(Mean±SD)表示,所有数据均基于Illumina HiSeq测序平台分析所得,试验数据通过Excel预处理后,通过Graphpad Prism 5.0软件处理。试验结果以P<0.05 时表示为差异显著,P>0.05表示差异不显著。
2 结果与分析
2.1 苦参碱不同给药方式对小鼠肠道微生物α多样性指数的影响
表1显示了各组的α多样性指数,反映了组间物种丰度及物种多样性的差异,Chao和Ace指数衡量物种丰度,Simpson和Shannon指数用于衡量物种多样性。NCig与NCip两组之间及MTig与MTip两组之间,Chao指数、Ace指数、Simpson指数和Shannon指数均不存在显著差异(P>0.05),表明苦参碱不同给药方式对肠道微生物的物种丰度及物种多样性没有影响。

表1 苦参碱不同给药方式对小鼠肠道微生物α多样性指数的影响Table 1 Effects of different administration methods of matrine on theα diversity index of intestinal microbes in mice
2.2 苦参碱不同给药方式对小鼠肠道微生物β多样性的影响
表2分别为腹腔注射和灌胃2种给药方式通过加权算法及非加权算法的ANOSIM分析,该分析主要用于比较组间样品在物种组成方面存在的相似程度,利用非加权的计算方法主要比较的是物种的有无,而加权方法则需要同时考虑物种有无和物种丰度2个问题。2种算法的P均大于0.05,表明不同给药方式之间物种组成较相似,差异不显著,即给药方式的差异对肠道菌群的物种组成没有显著影响。

表2 苦参碱不同给药方式对小鼠肠道微生物β多样性的影响Table 2 Effects of different administration methods of matrine on the β diversity of mice intestinal microbes
2.3 苦参碱不同给药方式对小鼠肠道微生物物种的影响
通过LEfSe(Line discriminant analysis (LDA) effect size)分析寻找不同组间具有统计学差异的标记性质物种(Biomarker),根据设定的物种筛选标准(|LDA score|>4)寻找符合筛选标准的物种,差异物种按该物种所在丰度最高的分组进行着色。结果显示,由于NCip组中没有相对增加的菌种,因此不能在图中显示出。与NCip组相比,NCig组中疣微菌目(Verrucomicrobiales)、瘤胃菌科(Ruminococcaceae)、阿克曼科(Akkermansiaceae)、阿克曼属(Akkermansia)和阿克曼属中某一个无法命名的种(uncultured_bacterium_g_Akkermansia)丰度显著增加(图1(a));MTip组中拟杆菌目(Bacteroidales)、另枝菌属(Alistipes)、另枝菌属中某一个无法命名的种(uncultured_bacterium_g_Alistipes)、乳杆菌属中某一个无法命名的种(uncultured_bacterium_g_Lactobacillus)丰度显著增加,MTig组中瘤胃菌科(Ruminococcaceae)、Ruminococcaceae_UGG_014、Ruminococcaceae_UGG_014中某一个无法命名的种(uncultured_bacterium_g_Ruminococcaceae_UGG_014)丰度显著增加(图1(b));结合NCig和NCip组菌群变化情况,经LEfSe分析发现MTig对肠道菌群没有明显影响,MTip组可引起肠道菌群差异。

f_Ruminococcaceae,瘤胃菌科;o_Verrucomicrobiales,疣微菌目;s_uncultured_bacterium_g_Akkermansia,阿克曼属中某一个无法命名的种;f_Akkermansiaceae,阿克曼科;g_Akkermansia,阿克曼属;s_uncultured_bacterium_g_Lactobacillus,乳杆菌属中某一个无法命名的种;o_Bacteroidales,拟杆菌目;s_uncultured_bacterium_g_Alistipes,另枝菌属中某一个无法命名的种;g_Alistipes,另枝菌属;s_uncultured_bacterium_g_Ruminococcaceae_UGG_014,Ruminococcaceae_UGG_014中某一个无法命名的种;g_Ruminococcaceae_UGG_014,Ruminococcaceae_UGG_014属。图1 LEfSe分析苦参碱不同给药方式对小鼠肠道菌群影响Fig.1 Analysis of the effects of different administration methods of matrine on the intestinal flora of mice by LEfSe
2.4 苦参碱不同给药方式对小鼠肠道菌群属水平的影响
为进一步分析不同给药途径对肠道菌群的影响,从属水平对各组进行Metastats分析,如表3显示,MTig与MTip两组之间,另枝菌属(Alistipes)(P<0.01)、Odoribacter(P<0.01)、脱硫弧菌属(Desulfovibrio)(P<0.05)、Candidatus_Saccharimonas(P<0.01)、Ruminococcaceae_UCG_014(P<0.05)、GCA_900066575(P<0.01)、[Eubacterium]_fissicatena_group(P<0.01)、Coriobacteriaceae_UCG_002(P<0.05)、Romboutsia(P<0.01)之间丰度存在显著差异,其中MTip组另枝菌属(Alistipes)(P<0.05)和Odoribacter(P<0.05)2个属丰度高,其余属在MTig组中丰度高,结合NCip组中丰度显著升高的菌属,分析可得,通过腹腔注射给予苦参碱,可以升高另枝菌属(Alistipes)和Odoribacter丰度,可以降低脱硫弧菌属(Desulfovibrio)和[Eubacterium]_fissicatena_group丰度。NCig与NCip两组之间,幽门螺杆菌属(Helicobacter),Lachnospiraceae_UCG_001丰度存在显著差异,且在NCip组中丰度更高,提示腹腔注射给药可导致小鼠肠道菌群致病菌幽门螺杆菌属(Helicobacter)和Lachnospiraceae_UCG_001丰度升高(P<0.05);而MTip组这2种菌属并没有显著变化,推测腹腔注射苦参碱可能会降低致病菌的产生。以上结果均表明,苦参碱通过腹腔注射及灌胃2种不同的给予方式可以导致肠道菌群部分菌属的丰度产生差异。
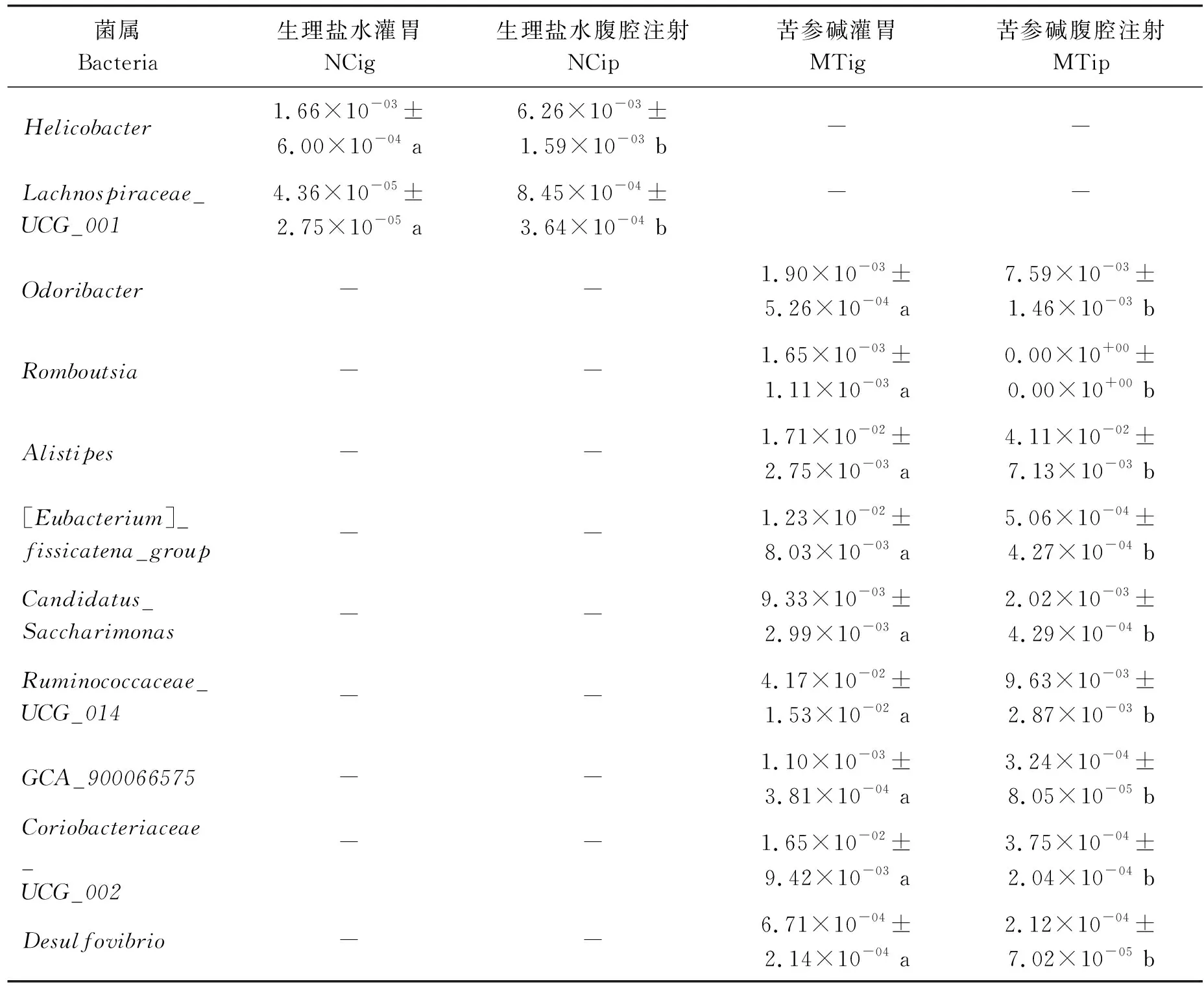
表3 Metastats分析苦参碱不同给药方式对小鼠肠道菌群属水平的影响Table 3 Analysis of the effects of different administration methods of matrine on theintestinal flora of mice at the genus level by Metastats
3 讨 论
3.1 给药途径的差异对药物吸收、代谢及机体的影响
腹腔注射和灌胃是常见的给药方式,苦参碱通过这2种途径给药,机体是否存在差异依然未知。肠道菌群种类很多,被称为动物的“第二基因库”。大量研究表明肠道菌群与多种疾病密切相关,深刻影响着疾病的治疗与临床研究[11-12];朱琳琳等[19]研究发现圆环病毒感染可以导致肠道菌群的变化,实验室前期研究发现苦参碱具有抗PCV2[20]和PRRSV[21]等病毒及影响肠道菌群的作用。
大量研究表明药物的不同给药方式,药物的吸收、代谢及作用均存在显著差异。腹腔注射有吸收快、局部作用强等优点,尤其是在胃肠道肿瘤的治疗及胃肠道化疗等方面。张敬伟等[22]研究发现,复方苦参注射液联合顺铂腹腔灌注治疗对提高胃癌恶性腹水患者临床疗效,改善生活质量,增强免疫能力,减少不良反应等方面均具有极其重要的现实意义。而灌胃给药需要经过消化道吸收进入血液,相比于腹腔注射,灌胃给药吸收较慢,生物利用度较低,这种差异可能是由于苦参碱灌胃后在肝脏中有残留,也可能是由于苦参碱在体内经历了首过代谢导致[23]。冯晓杰等[24]通过LC-MS/MS测定大鼠血浆样品中苦参碱的血药质量浓度,结果发现苦参碱腹腔注射给药的达峰时间(Tmax)、血浆清除率(CL)和生物利用度分别为0.32 h、1 531 mL/(h·kg)和83.21%;Yang等[23]研究发现,苦参碱灌胃给药的达峰时间及生物利用度分别为1.75 h和(17.1±5.4)%,Gao等[25]研究发现,苦参碱口服给药的血浆清除率为1 200 mL/(h·kg)。由此可见,不同给药途径影响了苦参碱的Tmax、CL以及生物利用度。
康淑媛等[26]通过高效液相色谱-紫外检测法检测发现,通过口灌和腹腔注射伊维菌素后,在虹鳟体内的药动力学特征存在明显差异,且通过腹腔注射给药的吸收和消除的速率更快。黄明星等[27]研究发现,二甘醇(DEG)腹腔注射比等剂量灌胃能引起大鼠更严重的中毒反应。何群等[28]研究发现,秦皮甲素2种给药途径的主要药动学参数有显著性差异,腹腔注射给药代谢速度较高,可以更加有效地降低血尿酸。司少艳等[29]研究发现,腹腔注射胶原蛋白肽对免疫抑制小鼠免疫功能的改善作用优于灌胃。有研究表明,灌胃酒精对体重增加或骨骼测量没有显著影响,与之相反,腹腔注射相同剂量的酒精可导致体重减轻,胫骨骨干端骨膜成骨受到完全抑制,胫骨近端干骺端松质骨形成减少,股骨远端骨基质蛋白mRNA表达水平降低[30]。上述研究表明,药物给药方式的不同会导致机体对药物的吸收、代谢及药效产生影响。为优化苦参碱的抗病毒效果,本研究从肠道菌群的角度来探究苦参碱腹腔注射与灌胃2种给药途径的差异。
3.2 通过不同给药途径给予苦参碱对小鼠肠道菌群的影响
在本研究中,通过LEfSe及Metastats 2种分析均发现无论是给予生理盐水还是苦参碱,均会对肠道菌群部分菌的丰度产生不同的影响,且不同给予途径之间存在差异显著的物种,提示不同给药途径给予同一药物可以对机体产生不同影响。究其原因,可能是不同的途径给予动物的应激不同,亦或是不同的给药途径,对药物的吸收和代谢等过程均存在差异。
通过综合分析LEfSe及Metastats得到的不同菌属,发现苦参碱腹腔注射组另枝菌属(Alistipes)丰度显著升高。Everard等[31]研究发现与肥胖患者相比,正常人体肠道菌群中有较高丰度的Alistipes;Yin等[32]发现Alistipes可以介导乙酸的产生。上述文献均提示Alistipes在调控机体能量代谢、改善机体脂代谢等方面有非常重要的作用。另外,研究还发现拟杆菌目和乳杆菌属中某一个无法命名的种(uncultured_bacterium_g_Lactobacillus)、Odoribacter丰度显著高于苦参碱灌胃组。Kuhn等[33]发现拟杆菌目中的某些细菌可招募上皮内淋巴细胞(IEL)至结肠中,而IEL产生的IL-6对维持肠道屏障的完整性十分关键。肠道屏障是机体防御病原入侵最重要的屏障之一,肠道屏障的完整性是其发挥作用的基础。乳杆菌属(Lactobacillus)作为益生菌的其中一种,在抗击病原微生物及提高机体免疫力等方面有重要意义[34]。Odoribacter与机体代谢功能的改善、粘蛋白的降解以及在抗肥胖等方面均有积极作用[35]。
苦参碱腹腔注射组脱硫弧菌属(Desulfovibrio)、[Eubacterium]_fissicatena_group等菌的丰度显著低于苦参碱灌胃组。丁俊荣等[36]研究发现脱硫弧菌属(Desulfovibrio)丰度增加是息肉和溃疡性结肠炎疾病的一个重要特征,吴思琪等[37]研究发现DSS诱导大鼠溃疡性结肠炎模型中,[Eubacterium]_fissicatena_group丰度显著增加。苦参碱灌胃组中Ruminococcaceae丰度显著高于苦参碱腹腔注射组,Ruminococcaceae的丰度改变可以影响体内短链脂肪酸浓度,进而影响机体炎症症状,Ruminococcaceae丰度降低,进而降低炎症反应[38]。由于在LEfSe分析NCig和NCip组时,也发现NCig组Ruminococcaceae丰度显著升高,因此,推测Ruminococcaceae丰度增加可能是灌胃刺激造成的。
苦参碱腹腔注射及灌胃两组之间,Coriobacteriaceae_UCG_002、Candidatus_Saccharimonas和Romboutsia等菌属也存在显著差异,但是,对于这些菌属的文献报道较少,其功能尚未探究清楚。综上可推测,相比于灌胃给予苦参碱,通过腹腔注射给予苦参碱更有利于优化小鼠肠道菌群的结构与功能。

