玻璃体切除术联合玻璃体腔注射曲安奈德治疗特发性黄斑前膜疗效观察
林 翎 卢毓敏 马胜生
暨南大学附属广州红十字会医院(广州 510220)
黄斑前膜(macular epiretinal membrane, MEM)是临床中常见的眼部疾病,多发生在50岁以上人群中,是一种无血管纤维细胞增生性膜沿黄斑内界膜表面生长,其结构包含视网膜胶质细胞、纤维性星形胶质细胞、Müller细胞、巨噬细胞和视网膜色素上皮(RPE)细胞等[1],特发性黄斑前膜的确切发病原因和形成机制当前仍不明确,通常与黄斑界面异常和玻璃体后界膜脱离密切相关[2],早期症状不明显,随着前膜的进展,会使黄斑部的结构发生异常改变,最终导致不同程度的视力损害和视物变形,并且MEM患者的视力随着疾病严重程度的加重而降低[3]。临床上一般将黄斑前膜分为两类:特发性黄斑前膜和继发性黄斑前膜。其中特发性黄斑前膜约占80%[4],近些年其发病率逐渐增加,并有年轻化趋势。光学相干断层扫描技术(OCT)具有无创、快速、操作简便和可重复性强等优点,在黄斑前膜的诊断、评估预后和术后随访中应用越来越广泛,越来越成为黄斑前膜诊断的重要指标。目前特发性黄斑前膜的治疗尚无同一标准,其中玻璃体切除联合黄斑前膜剥除及内界膜剥除术是治疗特发性黄斑前膜的有效手段,并在近年临床中广泛应用,多数黄斑前膜患者常伴有黄斑水肿,影响术后视力恢复[5]。炎性化合物可以增加黄斑部的通透性及影响血-视网膜屏障被认为是导致黄斑水肿的原因,因此,抗炎治疗是解决黄斑水肿的有效途径。IL- 6是一种表现炎症反应的敏感性及特异性较高的细胞因子,在调节免疫反应和诱导急性炎症反应中起重要作用,与血清相比,眼内液中IL- 6值能更可靠的反映眼内炎症免疫情况[6],因此房水中IL- 6水平可作为炎症反应及抗炎疗效的观察指标。目前已有研究证明[7],TA具有较强的抗炎及抑制细胞增生等效果,在眼内注射后分布更均匀,吸收更高效。为了进一步研究玻璃体切除联合前膜剥离及内界膜剥离以及玻璃体腔内注射TA对治疗黄斑前膜患者的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
本研究选取2018年1月—2020年1月我院收治的特发性黄斑前膜患者38例(38眼)作为研究对象,随机将患者分为治疗组(18例,18眼)与对照组(20例, 20眼)。其中男17例(17眼),女21例(21眼);年龄38~69岁,平均(61.3±3.5)岁;病程4~47个月,平均(21.2±6.1)个月;术前黄斑中心凹厚度307.8~495.3 μm,平均(392.7±71.7)μm。两组一般资料差异无统计学意义(P>0.05),具有可对比性。所有选入对象签署知情同意书,患者与家人均知情并配合本次研究。本研究经医院伦理委员会审查通过。
1.2 选入标准
纳入标准:①经光学相干断层扫描(optical coherence tomography,OCT)、眼底荧光血管造影(fundus fluorescein angiography,FFA)及眼底照相确诊为IMEM的患者。②非接触眼压计(NCT)测量眼压≤21 mmHg。③术前完善最佳矫正视力(BCVA)。④具有手术指征,并由同一医生完成手术。④依从性好、坚持随访者。
排除标准:①继发性黄斑前膜。②青光眼、合并视神经病变。③黄斑裂孔、黄斑性病变。④屈光间质浑浊影响观察。⑤既往眼部手术史、视网膜激光光凝史、巩膜外冷凝史的患者。⑥全身合并严重慢性病、年老体弱不适合检查及手术患者。⑦对荧光素钠造影剂过敏患者。⑧依从性差、不能定期复诊的患者。
1.3 观察指标
(1)观察并记录:BCVA、NCT、OCT、CMT、房水IL- 6。所有眼科检查均由同一名操作熟练的技师完成,并由同一名眼底病专家阅片。房水IL- 6检测由同一位经验丰富的检验师检验。(2)疗效观察:①视力提高程度:统计并计算两组患者治疗1、3、6月后BCVA提高程度,视力越好者BCVA值越大。②黄斑水肿程度:测量两组患者治疗前及治疗1、3、6月后的CMT值,黄斑水肿越严重者CMT值越大。③眼内炎症反应程度:测量两组患者治疗前及治疗1、3、6月后房水IL- 6浓度,炎症反应越重者房水IL- 6浓度水平越高。(3)不良反应观察:关注患者两组患者治疗期间有无视网膜脱离、眼内炎、玻璃体积血、黄斑裂孔、青光眼等并发症。
1.4 手术方法
两组患者术前均对术眼滴用广谱抗生素(4/日),所有手术均由同一名医生在球后神经阻滞麻醉下完成,用25G穿刺刀做常规PPV三切口,用无菌30G针头连接1 mL注射器,抽取前房液0.1 mL,作为术前房水标本立即送检,再将25G灌注管插入套管中,固定并确保其在玻璃体腔内,首先切除玻璃体,然后用吲哚菁绿(ICG)染色,再剥除上下血管弓内的黄斑前膜及内界膜。治疗组在手术结束时玻璃体腔内注入0.02 mL(0.8 mg)醋酸曲安奈德注射液(生产厂家:浙江仙琚制药股份有限公司;批准文号:国药准字H20033525;规格1 mL:40 mg),对照组在手术结束时玻璃体腔未注入醋酸曲安奈德注射液。
1.5 房水采集方法
术后1月、3月、6月患者随访时行房水标本采集:常规消毒,开睑,无菌生理盐水反复冲洗结膜囊,吸尽结膜囊积液,用无菌30G针头连接1 mL注射器,抽取前房液0.1 mL,避免触及虹膜、晶状体和角膜内皮,然后将房水立即送检。
1.6 术后随访
(1)随访指标:术后1月、3月、6月对所有患者进行随访,随访时记录所有患者的BCVA、眼压、眼底照相、OCT及CMT值、房水IL- 6水平。(2)复诊预约:与患者预约下一次复诊时间,确保患者按时复诊。
1.7 统计学方法
2 结 果
2.1 手术前后BCVA比较
手术前治疗组和对照组患者的平均BCVA分别为:0.08±0.03、0.08±0.02,比较差异无统计学意义(t=- 0.029;P=0.98)。术后1月、3月、6月,治疗组患者平均BCVA分别为0.15±0.03、0.26±0.15、 0.30±0.16,对照组患者平均BCVA分别为0.12±0.02、0.15±0.09、0.18±0.11。术后1月、3月、6月治疗组平均BCVA较对照组有明显提高,差异有统计学意义(t=2.702、2.559、2.796,P=0.012、0.016、0.008)。见表1。

表1 两组患者手术前后平均BCVA
2.2 手术前后CMT比较
手术前治疗组和对照组患者的平均CMT分别为:(399.44±85.51)、(386.65±54.57)μm,比较差异无统计学意义(t=0.543;P=0.591)。术后1月、3月、6月,治疗组患者平均CMT分别为(317.50±78.52)、(274.56±27.50)、 (262.56±21.48)μm,对照组患者平均CMT分别为(370.55±51.52)、(324.50±51.62)、(306.55±49.48)μm。术后1月、3月、6月治疗组平均CMT较对照组有明显降低,差异有统计学意义(t=- 2.433、- 3.773、- 3.616,P=0.021、0.001、0.001)。见表2。

表2 两组患者手术前后平均CMT
2.3 手术前后房水炎症因子水平比较
手术前治疗组和对照组患者的平均IL- 6水平分别为:(67.35±10.33)、(67.54±15.72)pg/mL,比较差异无统计学意义(t=- 0.041;P=0.967)。术后1月、3月、6月,治疗组患者平均IL- 6水平分别为(42.17±16.28)、(30.72±25.61)、(25.29±11.49)pg/mL,对照组患者平均IL- 6水平分别为(52.84±10.48)、(45.77±16.27)、(39.54±22.57)pg/mL。术后1月、3月、6月治疗组平均IL- 6水平较对照组有明显降低,差异有统计学意义(t=- 2.428、- 2.136、- 2.488,P=0.020、0.041、0.019)。见表3。
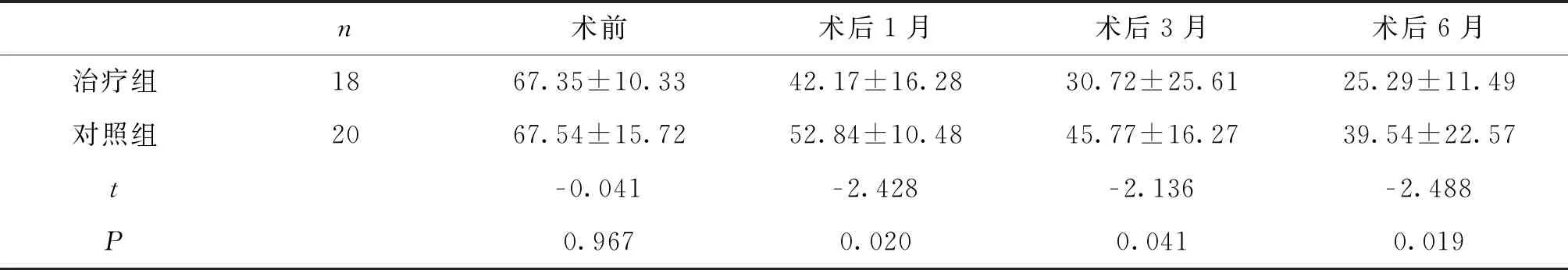
表3 两组患者手术前后平均IL- 6水平
2.4 两组患者术前眼压均正常,在术后1月内,治疗组术后眼压>21 mmHg(1 mmHg=0.133 kPa)有1例,对照组术后眼压>21 mmHg有2例,予以降眼压药物后,眼压在术后1周内均恢复正常,两组患者在术后1月、3月、6月时眼压均正常。两组患者手术前后眼压变化差异无统计学意义(P>0.05)。
2.5 手术后各组患者均未出现眼内炎、玻璃体积血、视网膜脱离、青光眼、黄斑裂孔等并发症。

图1 治疗组术前OCT

图2 治疗组术后6月OCT
图3 对照组术前OCT

图4 对照组术后6月OCT
3 讨 论
黄斑前膜(MEM)的发病原因目前尚未统一,其中被广泛接受的理论是因为玻璃体后脱离(PVD)使视网膜内界膜造成损伤,导致视网膜来自视网膜底层的胶质细胞、RPE细胞和成纤维细胞等发生迁移并在黄斑及其附近视网膜表面增生而形成的一种纤维膜。当黄斑前膜发展增厚并累及黄斑中心凹时,根据黄斑皱褶、水肿的情况,可有不同程度的视力下降与视物扭曲等视功能改变[8]。对于黄斑前膜的治疗,单纯药物治疗效果较差,目前临床治疗中多采取玻璃体切除联合内界膜剥除的治疗方式[9-10]。在手术方式选择上联合内界膜剥除术已成为一种趋势,在本研究中,两组患者均在术中行内界膜剥除,内界膜的剥除可更加彻底的解除黄斑部位的牵拉,改善黄斑代谢,从而加快黄斑水肿消退并提高视力;并且也可使黄斑部细胞的移行增殖失去支架,进而有效抑制黄斑前膜复发[11]。
相关研究指出[12],玻璃体视网膜手术后,由于炎症导致视网膜外丛状层和内核层之间的视网膜毛细血管的浆液性渗出等情况会导致黄斑水肿。TA于上世纪80年代开始用于眼科治疗,作为长效糖皮质激素类药物,其有眼内局部浓度高、作用时间长等优点,通过降低毛细血管的通透性,阻止炎性细胞向炎性部位扩散,从而实现减轻炎症反应的发生。相关研究表明[13-14],TA半衰期比较短,约为3.2天,TA在玻璃体切除后可在眼内均匀分布,可使TA在眼内的吸收更加高效。TA具有较强且持久的抗炎及抑制细胞增生的优点,可减少术后炎症反应,从而使得在黄斑前膜剥除后,玻璃体腔内注射TA可减少黄斑水肿的发生和减轻水肿的程度,达到促进视力恢复的效果。本研究结果显示,术后1月、3月、6月治疗组和对照组的平均BCVA均高于术前,且治疗组高于对照组,术后3月较术后1月相比,有明显提高,但术后6月较术后3月相比,提高不明显,趋于稳定状态。术后1月、3月、6月治疗组和对照组的平均CMT水平均较术前降低,但治疗组低于对照组。术后1月、3月、6月治疗组和对照组的平均IL- 6水平均较术前降低,术后1月及3月时,治疗组的平均IL- 6明显低于对照组,术后6月时差距缩小,并趋于稳定状态。表明IMEM患者采用玻璃体切除联合内界膜剥除术同时联合玻璃体腔注射TA治疗,可有效提升患者术后视力、减轻术后黄斑水肿、降低炎症反应等情况,与对照组相比,治疗组术后可取得更好的疗效。
在过去几年中,分析眼内液体中各类细胞因子水平在各种眼部疾病中大量研究[15-17],有研究显示,细胞因子IL- 6在玻璃体液和前房液中水平类似,具有一定程度的相似性[15],因此,某些眼后段的疾病(如:糖尿病性视网膜病变)可以通过检测房水细胞因子IL- 6水平代替检测玻璃体液中IL- 6细胞因子水平,此外房水比玻璃体获取更加安全、方便[18]。IL- 6蛋白的表达受位于染色体7p21上的IL- 6基因调控,可诱导肌动蛋白重新排列、使细胞间缝隙连接增大,从而增加血管壁的通透性[19];IL- 6还可以增强VEGF的表达[20],间接促使新生血管增生、血管通透性增加,从而增加血-脑屏障的通透性,并最终引起黄斑水肿的发生。本研究结果显示,术后1月、3月、6月治疗组比对照组的平均房水IL- 6水平低,表明房水IL- 6水平与黄斑水肿程度密切相关;治疗组术后1、3、6月房水IL- 6水平与CMT呈正相关,表明玻璃体腔内注射TA能明显减轻术后眼球内炎症反应水平。
综上所述,玻璃体切除术联合内界膜剥除是治疗IMEM的有效治疗方式,与此同时术中玻璃体腔内注射TA可稳定有效提升患者术后视力水平、快速减轻黄斑水肿及降低眼内炎症水平。关于本研究不足之处,近年来新型眼科检查-光学相干层析血管造影(OCTA)主要在眼底血管疾病诊断中应用,可检测视网膜浅层、深层血流密度及黄斑中心凹无血管区面积,我们可在下一步研究中将OCTA检查作为黄斑、视网膜疾病治疗的疗效观察指标,更精细地评估黄斑区功能,可将其作为接下来的研究方向。另外鉴于本研究样本量有限,后期应加大样本量,增加多个观察指标,延长随访时间,进一步分析玻璃体切除联合内界膜剥离与TA注射对特发性黄斑前膜患者的疗效。

