(+)-儿茶素与表没食子儿茶素没食子酸酯对乙醇诱导HepG2细胞脂代谢紊乱及氧化应激的影响
胡博然,丁建才,曹 杨,,田 颖,国凤华,袁 静
(1.扬州大学食品科学与工程学院,江苏 扬州 225127;2.首都儿科研究所,北京 100020;3.通化葡萄酒股份有限公司,吉林 通化 134002)
随着经济的发展,我国酒精饮料消费快速增长,人均饮酒量大幅增加。过量饮酒对人体具有一定程度的损害,进入人体的乙醇约有90%~95%在肝脏中代谢,乙醇对人体肝脏损害最为严重,这主要是乙醇及其衍生物在肝脏分解代谢过程中直接或间接诱导炎性介质产生炎症反应、氧化应激反应,进而通过氧化应激促使反应性氧化物增加,诱发肝脏脂肪聚集[1-2]。
儿茶素作为鞣质的前体,广泛分布于植物中,具有多种药物活性成分,具有降血脂[3]、抗氧化[4]等的作用。(+)-儿茶素((+)-catechin,(+)-Cat)是儿茶素的异构体之一,大多数研究集中在(+)-Cat的提取鉴定、提取方法改进以及加工过程中儿茶素的稳定性[5-7]方面,仅有少量文献研究(+)-Cat在降血脂[8]方面的作用。表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶中含量最为丰富、性质最为活泼的儿茶素类物质[9]。王艳等[10]研究发现EGCG能有效改善链脲佐菌素诱导的糖尿病SD大鼠的脂代谢紊乱。Santamarina等[11]研究发现EGCG通过调节肝脏线粒体呼吸链复合物,增加能量消耗,特别是脂质底物的氧化,从而有助于预防肝脂肪变性。大部分报道针对EGCG对于高脂膳食或糖尿病模型下的大鼠或小鼠血脂的影响,对乙醇诱导下细胞的脂代谢紊乱的研究鲜见报道。所以,本实验选择儿茶素单体中的基础构型(+)-Cat和儿茶素类物质中抗氧化活性最强的单体EGCG,探究它们对乙醇诱导的细胞氧化应激及脂代谢紊乱的作用,同时对比它们的差异,以期为儿茶素及儿茶素类物质在功能性食品开发方面提供一定的参考。
1 材料与方法
1.1 细胞、材料与试剂
HepG2肝癌细胞由中国人民解放军疾病预防控制中心提供。
(+)-Cat、EGCG 北京索莱宝科技有限公司;甘油三酯(triglycerides,TG)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、RNAprep Pure培养细胞总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒 北京天根生化科技有限公司。
1.2 仪器与设备
090-135.001倒置显微镜 德国Leica公司;Spectra Max i3x光谱扫描多功能酶标仪 美谷分子仪器(上海)有限公司;CFX96 Touch实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 乙醇作用浓度的确定
根据前人研究结果[12-13],本实验选择乙醇作用浓度为300 mmol/L。
1.3.2 (+)-Cat、EGCG作用浓度的确定
使用噻唑蓝(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)法检测细胞存活率[14]。96 孔板培养HepG2细胞,待细胞长满板底后,按照浓度梯度分别向培养液中加入不同作用浓度(0、50、100、150、200、250、300 μmol/L)的(+)-Cat或EGCG,以不添加(+)-Cat或EGCG的正常培养基为对照组,每组6 个平行,置于CO2培养箱中培养24 h后测细胞存活率以观察(+)-Cat、EGCG对细胞的毒性。
96 孔板培养HepG2细胞,待细胞长满板底后,向培养液中加入不同作用浓度(0、50、100、150、200、250、300、350 μmol/L)的(+)-Cat或EGCG和300 mmol/L的乙醇,每组6 个平行,置于CO2培养箱中培养24 h后测细胞存活率以观察(+)-Cat、EGCG对抗乙醇毒性的作用。
细胞存活率测定:向待测孔中加入50 μL 5mg/mL MTT,在CO2培养箱中孵育4 h,然后吸弃上清液,加入150 μL二甲基亚砜,置于摇床处理10 min后,在酶标仪490 nm波长处测定每孔的OD值并按下式计算细胞存活率。

结合以上两组实验确定后续实验所用的(+)-Cat、EGCG作用浓度。
1.3.3 实验分组
确定(+)-Cat、EGCG作用浓度后,将实验分为6 组:正常组(培养基不添加(+)-Cat、EGCG和乙醇)、(+)-Cat组、EGCG组、乙醇作用组(ETOH组)、乙醇和(+)-Cat作用组((+)-Cat+ETOH组)、乙醇和EGCG作用组(EGCG+ETOH组)。培养细胞至对数生长期后,(+)-Cat组、EGCG组、ETOH组分别在培养基中添加相应浓度的(+)-Cat、EGCG以及乙醇,培养24 h。(+)-Cat+ETOH、EGCG+ETOH组添加相应浓度乙醇培养24 h后,分别加入相应浓度的(+)-Cat、EGCG继续培养24 h。
1.3.4 HepG2细胞TG含量、SOD活力、MDA浓度的检测
HepG2细胞TG含量、SOD活力、MDA浓度分别参考其试剂盒说明书进行测定。
1.3.5 HepG2细胞脂代谢基因表达水平检测
使用TRIzol法抽提细胞内总RNA,通过反转录酶对RNA进行反转录后,使用SYBR Green染料法及CFX96 Touch实时定量荧光PCR仪对目标基因进行扩增,采用2-ΔΔCT法计算各组HepG2细胞固醇调节元件结合蛋白1(sterol regulatory element binding protein 1,SREBP-1)、二脂酰甘油转移酶2(diacylglyceryltransferase 2,DGAT2)、过氧化物酶体增殖物激活受体α(peroxisomal proliferators activate receptors α,PPARα)、肉毒碱棕榈酰基转移酶1(carnityltransferase 1,CPT1)mRNA相对表达水平,相关基因引物序列详见表1。
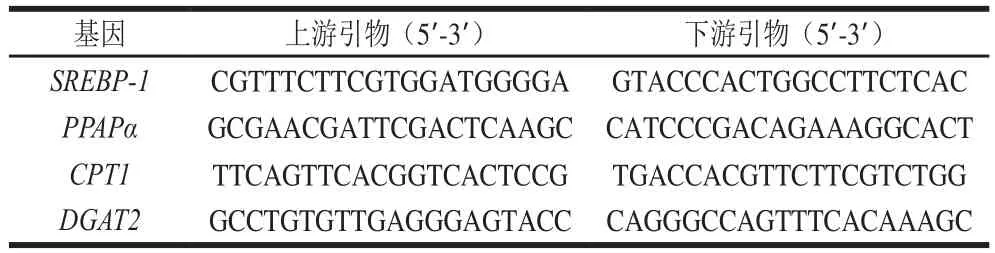
表1 扩增基因引物序列Table 1 Primer sequences used in this study
1.4 数据统计与分析
实验数据均以平均值±标准差形式表示。采用SPSS Statistics 17.0统计软件进行数据分析,各组间平均值的两两比较用独立样本t检验。
2 结果与分析
2.1 (+)-Cat、EGCG作用浓度的确定
不同浓度的(+)-Cat和EGCG作用于HepG2细胞24 h后的细胞毒性如图1A所示,200 μmol/L (+)-Cat和EGCG组细胞存活率较对照组显著下降(P<0.05);250、300 μmol/L (+)-Cat和EGCG组细胞存活率较对照组极显著下降(P<0.01),300 μmol/L EGCG已达到细胞的半数致死浓度;其余各组与对照组相比均无显著变化(P>0.05)。

图1 MTT法检测不同作用浓度(+)-Cat、EGCG对HepG2细胞存活率的影响Fig. 1 Effects of (+)-Cat and EGCG on HepG2 cell survival detected by 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide assay
(+)-Cat和EGCG对乙醇诱导HepG2细胞存活率的影响分别如图1B、C所示,不同浓度的(+)-Cat和EGCG能够减弱300 mmol/L乙醇诱导的细胞毒性作用。200、250 μmol/L (+)-Cat组细胞存活率极显著高于300 mmol/L乙醇组(P<0.01);200 μmol/L EGCG组细胞存活率极显著高于300 mmol/L乙醇组(P<0.01)。
综合(+)-Cat、EGCG对细胞的毒性作用以及二者抗乙醇毒性作用的结果,本研究选择200 µmol/L作用浓度的(+)-Cat和EGCG分析(+)-Cat和EGCG对脂代谢紊乱和氧化应激的调节效果并比较二者的差异。
2.2 (+)-Cat、EGCG对HepG2细胞TG含量的影响
如表2所示,与正常组相比,(+)-Cat组及EGCG组的TG含量无显著差异(P>0.05),ETOH组TG含量显著上升(P<0.05),说明在乙醇的作用下,HepG2细胞脂代谢异常,造成TG的堆积。与ETOH组相比,(+)-Cat+ETOH组、EGCG+ETOH组的TG平均含量显著降低(P<0.05),分别为ETOH组的63%和44%,说明(+)-Cat与EGCG有效缓解了脂质堆积,且EGCG的效果更好。
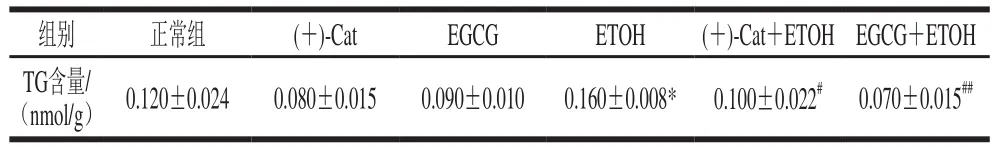
表2 (+)-Cat、EGCG对HepG2细胞TG含量的影响Table 2 Effects of (+)-Cat and EGCG on TG content in HepG2 cells
2.3 油红O染色观察(+)-Cat与EGCG对HepG2细胞脂滴的影响
通过油红O染色可以直接观察出细胞胞浆中脂滴的状态。由图2可知,ETOH组与正常组、(+)-Cat组和EGCG组相比,可见较多的斑点状红色脂滴,说明乙醇诱导后的HepG2细胞出现脂质积累;(+)-Cat+ETOH组和EGCG+ETOH组与ETOH组相比,脂滴明显减少,说明(+)-Cat和EGCG的干预均可减轻乙醇诱导的HepG2细胞脂质堆积。油红O染色结果与TG含量检测结果较为一致。Wu Qiong等[15]研究发现,EGCG在一定甘油的作用下能抑制细胞内的抑制3-羟基-3-甲基戊二酰基辅酶a还原酶活性,降低HepG2细胞内的总胆固醇。Laura等[16]测试了郝灵普洱茶提取物和茶的主要成分EGCG对大鼠原代培养肝细胞的降脂效果,发现EGCG具有体外降脂作用。Roghani等[17]观察慢性给药EGCG对链脲佐菌素糖尿病大鼠脂质和肝脂质过氧化的影响,得出慢性EGCG治疗糖尿病大鼠,可防止血糖和脂质异常变化,降低肝脂质过氧化。张聪等[3]以油酸孵育HepG2细胞24 h,建立体外高脂模型,在MTT实验的基础上,以脂质清除率为指标,评价儿茶素的体外降脂效果,发现儿茶素能有效清除肝细胞内堆积的脂肪,与本研究中的结果一致。

图2 油红O染色观察(+)-Cat、EGCG对HepG2细胞脂滴的影响(200×)Fig. 2 Oil red O staining observation of the effect of (+)-Cat and EGCG on lipid droplets in HepG2 cells (200 ×)
2.4 (+)-Cat与EGCG对HepG2细胞脂代谢基因表达水平的影响
由图3可知,与正常组相比,ETOH组SPEBP-1、DGAT2mRNA的相对表达量显著升高(P<0.01,P<0.05),分别为正常组的1.8 倍和1.4 倍;PPARα与CPT1mRNA相对表达量显著降低(P<0.05,P<0.01),分别为正常组的30%和20%,说明乙醇影响了HepG2细胞脂代谢基因的正常表达。与ETOH组相比,(+)-Cat+ETOH组SPEBP-1、DGAT2mRNA的相对表达量显著降低(P<0.05),均约为ETOH组的80%;PPARα与CPT1mRNA相对表达量显著升高(P<0.05、P<0.01),分别为ETOH组的2.4 倍和3.3 倍;EGCG+ETOH组SPEBP-1、DGAT2mRNA的相对表达量显著降低(P<0.05)分别为ETOH组的69%和75%;PPARα与CPT1mRNA相对表达量显著升高(P<0.05)分别为ETOH组的2.1 倍和2.8 倍。说明(+)-Cat和EGCG均能通过调节HepG2细胞脂代谢相关基因的表达,对乙醇诱导HepG2细胞脂代谢紊乱具有恢复作用,在相同浓度条件下EGCG的恢复效果更好。


图3 (+)-Cat、EGCG对 HepG2细胞脂代谢相关基因表达的影响Fig. 3 Effects of (+)-Cat and EGCG on the expression of lipid metabolism-related genes in HepG2 cells
2.5 (+)-Cat与EGCG对HepG2细胞抗氧化酶SOD活力和脂质过氧化物MDA浓度的影响
如表3所示,与正常组相比,EGCG组SOD活力显著增加(P<0.05),MDA浓度无显著变化(P>0.05)。ETOH组较正常组的SOD活力显著降低(P<0.05),为正常组的42%;MDA浓度显著增加(P<0.05),为正常组的1.7 倍。研究表明,过量饮酒导致机体发生氧化系统与抗氧化系统失衡,产生大量的活性氧,经过脂质过氧化作用产生MDA,当MDA在机体内上升时SOD清除自由基的能力相对下降[18]。ETOH组SOD活力降低、MDA浓度增加验证了这一结论。(+)-Cat+ETOH组与EGCG+ETOH组较ETOH组的MDA浓度显著降低(P<0.05),分别为ETOH组的37%和23%,SOD活力显著提高(P<0.05),分别为ETOH组的1.2 倍和1.4 倍。综上可知(+)-Cat、EGCG干预后可改善细胞内的氧化应激状态,增强抗氧化酶活性、减弱脂质过氧化,其中EGCG的效果更好。

表3 (+)-Cat、EGCG对HepG2细胞SOD活力和MDA浓度的影响Table 3 Effects of (+)-Cat and EGCG on SOD activity and MDA content in HepG2 cells
3 讨 论
DGAT有两个亚型(DGAT1与DGAT2),DGAT1主要负责组装TG,DGAT2通过促进二酰基甘油和长链脂肪酰基辅酶A的键合来催化TG合成最后一步[19]。相对于DGAT1,DGAT2的表达在TG的合成中占有更重要的地位。初欣欣等[20]研究发现经高脂饲料诱导后的金黄地鼠肝脏中,DGAT2基因表达量明显升高,使得肝脏组织利用脂肪酸合成TG,使肝脏中TG的含量升高。宋芳等[21]研究发现乙醇诱导的脂肪肝大鼠中DGATmRNA的表达量明显升高。本实验中ETOH组细胞TG含量明显高于正常组(P<0.05),与乙醇诱导后细胞DGAT2mRNA的表达量升高有一定关系。(+)-Cat、EGCG干预组TG含量较ETOH组低,说明(+)-Cat、EGCG干预后下调DGAT2mRNA的表达,对降低TG合成起到了一定作用。
酒精性脂肪肝在组织病理学上主要表现为以TG为代表的中性脂肪在胞质中大量蓄积。研究表明,酒精性脂肪肝的发生发展与腺苷酸蛋白活化激酶腺苷酸蛋白活化激酶介导的脂代谢通路受阻紧密相关。乙醇及其代谢产生的乙醛和活性氧等有害代谢物会不同程度地抑制肝脏腺苷酸蛋白活化激酶的活性,进而促进脂肪酸合成,抑制脂肪酸氧化,最终引起脂肪变性。SREBPs是肝脏中调节脂肪酸、TG和胆固醇的主要转录因子,包括3 种亚型(SREBP-1a、SREBP-1c和SREBP-2)[22]。SREBP-1的过量表达会促进脂肪酸、TG的合成[23]。近年研究发现,EGCG能够激活腺苷酸蛋白活化激酶[24],而腺苷酸蛋白活化激酶的激活可以抑制SPEBP-1信号的传导[25],从而降低SREBP-1mRNA的表达量,减少TG的合成。本实验中EGCG干预组的SREBP-1mRNA表达量、TG含量较ETOH组低,与EGCG能够激活腺苷酸蛋白活化激酶有关。(+)-Cat干预组对下调SREBP-1mRNA的表达,减少TG的合成也有一定作用,但效果没有EGCG干预组明显。
过氧化物酶体增殖物激活受体对机体的生长发育及代谢有着重要的作用。PPARα是过氧化物酶体增殖物激活受体的亚型之一,能够调节TG和脂肪酸氧化阶段,促进脂肪酸向线粒体和过氧化物酶方向流动,促进脂肪酸氧化[26]。CPT1是脂肪酸β氧化的关键酶。PPARα的表达可以促进脂肪酸β氧化关键酶CPT1的表达,使得肝细胞脂肪酸氧化速率加快[27-28]。本研究中(+)-Cat、EGCG干预组的PPARα和CPT1mRNA的表达量都较ETOH组高,同时干预组的TG含量较ETOH组低,说明(+)-Cat、EGCG能上调PPARα和CPT1mRNA的表达,加快脂质氧化。
研究表明细胞正常生理代谢过程中获取的氧,98%转化为能量,2%转化为氧自由基,正常情况下体内的天然抗氧化剂(SOD、谷胱甘肽等)会与氧自由基发生氧化还原反应,清除自由基,但长期大量饮酒会打破这一动态平衡,导致氧自由基大量增多,抗氧化物质耗竭[29]。茶多酚被证实是有效的自由基清除剂,其中EGCG的还原电势较低,抗氧化能力较强[30]。绿茶中的儿茶素尤其是EGCG能够抑制活性氧的产生,达到抗氧化目的[31-32]。本研究中(+)-Cat和EGCG均对乙醇诱导下细胞的氧化损伤有保护作用,且EGCG的干预效果更好,但具体机制还需进一步研究。
本实验中,对乙醇诱导下HepG2细胞损伤,(+)-Cat、EGCG均能降低TG和脂肪酸合成相关基因SREBP-1、DGAT2的表达,减少TG的合成;增加HepG2细胞中脂肪酸氧化基因PPARα和CPT1的表达,促进细胞脂肪酸氧化,减少脂质积累;提高SOD活性,降低MDA浓度,改善细胞氧化应激状态。EGCG对乙醇诱导下HepG2细胞的保护作用优于(+)-Cat。

