PD-1/PD-L1 在胃癌组织中的表达及其临床意义
邓 渊,马云涛
(1.甘肃省人民医院普外一科,甘肃 兰州 730000;2.甘肃中医药大学甘肃省中医药研究中心,甘肃 兰州 730000)
胃癌(gastric cancer)是一种起源于胃黏膜上皮的恶性肿瘤,在我国的发病率居各类肿瘤首位。大部分患者胃癌发现时已经到中晚期,严重影响患者的生命健康,因此急需寻找一种新的诊疗方案。随着对胃癌的深入研究,发现免疫逃逸在胃癌的发生、发展中扮演了非常重要的角色。PD-1 和其配体PD-L1 通路是抑制性免疫检查点,通过抑制T 细胞的免疫反应,在免疫耐受中发挥重要作用,从而造成肿瘤细胞免疫逃逸,这也为胃癌的诊疗提供了一种新的思路。本研究拟通过检测PD-1、PD-L1 蛋白在胃癌及癌旁标本中的表达,探讨PD-1、PD-L1 在临床中的诊疗意义,为胃癌的诊疗工作提供参考,现报道如下。
1 资料与方法
1.1 一般资料 选取2019 年1 月~12 月甘肃省人民医院收治的46 例实施胃癌根治术的胃癌患者作为研究对象,其中男性33 例,女性13 例;年龄35~81岁,平均年龄(58.70±9.05)岁;肿瘤直径:≤5 cm 39例,>5 cm 7 例;TNM 分期:Ⅰ~Ⅱ期19 例,Ⅲ~Ⅳ期27 例;分化程度:低分化26 例,中分化18 例,高分化2 例;浸润分布情况:粘膜及粘膜下层3 例,肌层21 例,浆层22 例;有淋巴结转移29 例,无淋巴结转移17 例。纳入标准:①经病理检查等确诊为胃癌者;②术前未行放化疗等抗肿瘤治疗者;③未合并其他恶性肿瘤者;④病历资料完整者。排除标准:①合并严重慢性病患者;②胃癌复发患者。本研究经医院伦理委员会审批通过,患者知情同意并签署知情同意书。
1.2 主要试剂 鼠抗PD-1 和兔抗PD-L1 购于福州迈新生物技术有限公司,小鼠抗β-actin 单抗、二抗、DAB 试剂盒、枸橼酸缓冲液购于北京中杉金桥生物技术有限公司。
1.3 方法
1.3.1 SP 免疫组化法检测胃癌及癌旁组织中PD-1、PD-L1 的表达情况 取胃癌患者的胃癌及其旁组织,经4%甲醛固定后制作蜡块待用。将组织以4 μm连续切片,常规脱蜡至水,经抗原修复、灭活内源性过氧化物酶、阻断非特异性反应后,加入PD-1、PDL1 一抗(稀释比例均为1∶100)后4 ℃孵育过夜,生物素标记二抗孵育后,滴加DAB 显色剂显色,苏木素复染,脱水透明封片。免疫组化结果判定[1]:每张切片中选取癌细胞数较多的5 个高倍视野(400×),每个视野计数100 个细胞。按染色强度计分:无阳性着色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分;按阳性细胞百分比计分:阳性细胞数<5%为0 分,6%~30%为1 分,31%~60%为2 分,>60%为3 分,将两项得分相加,≥2 分为阳性,<2 分为阴性。
1.3.2 免疫印迹法检测胃癌及癌旁组织中PD-1、PD-L1 的表达情况 取胃癌及癌旁组织,经RIPA裂解,4 ℃,15000 r/min 离心10 min,取上清,测蛋白浓度,计算上样量。经10% SDS-PAGE 电泳后,电转至0.22 mm 的PVDF 膜上,用5%脱脂奶粉室温封闭1 h。封闭后加入相应浓度的PD-1、PD-L1 抗体,37 ℃孵育2 h,4 ℃过夜;用TBST(TBS 加0.1%吐温)洗涤PVDF 膜3 次,10 min/次,后加入二抗,置于摇床37 ℃孵育1 h。用TBST 洗膜3 次,常规曝光显影。
1.4 统计学方法 采用SPSS 21.0 统计软件进行数据分析,计量资料以()表示,计数资料以(n)和(%)表示,采用χ2检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 PD-1、PD-L1 表达与患者临床病理特征的关系SP 免疫组化检测结果显示,46 例患者胃癌组织中PD-1 蛋白表达阳性率为78.26%(36/46),高于PDL1 的58.70%(27/46),差异有统计学意义(χ2=4.079,P<0.05),见图1。不同TNM 分期PD-1 表达比较,差异有统计学意义(P<0.05);不同年龄、性别、肿瘤直径大小、分化程度、浸润分布情况、淋巴结转移PD-1表达比较,差异无统计学意义(P>0.05)。不同肿瘤浸润情况PD-L1 表达比较,差异有统计学意义(P<0.05);不同年龄、性别、肿瘤大小、分化程度、TNM 分期、淋巴结转移间PD-L1 表达比较,差异无统计学意义(P>0.05),见表1。
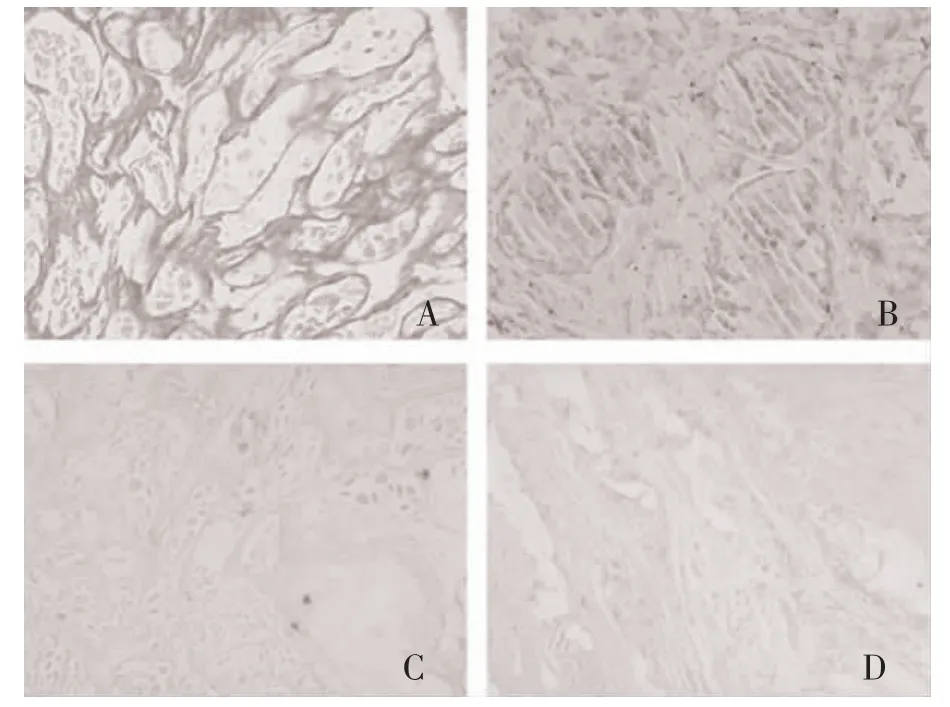
图1 PD-1 和PD-L1 在胃癌及癌旁组织中的表达(SP 免疫组化法×400)
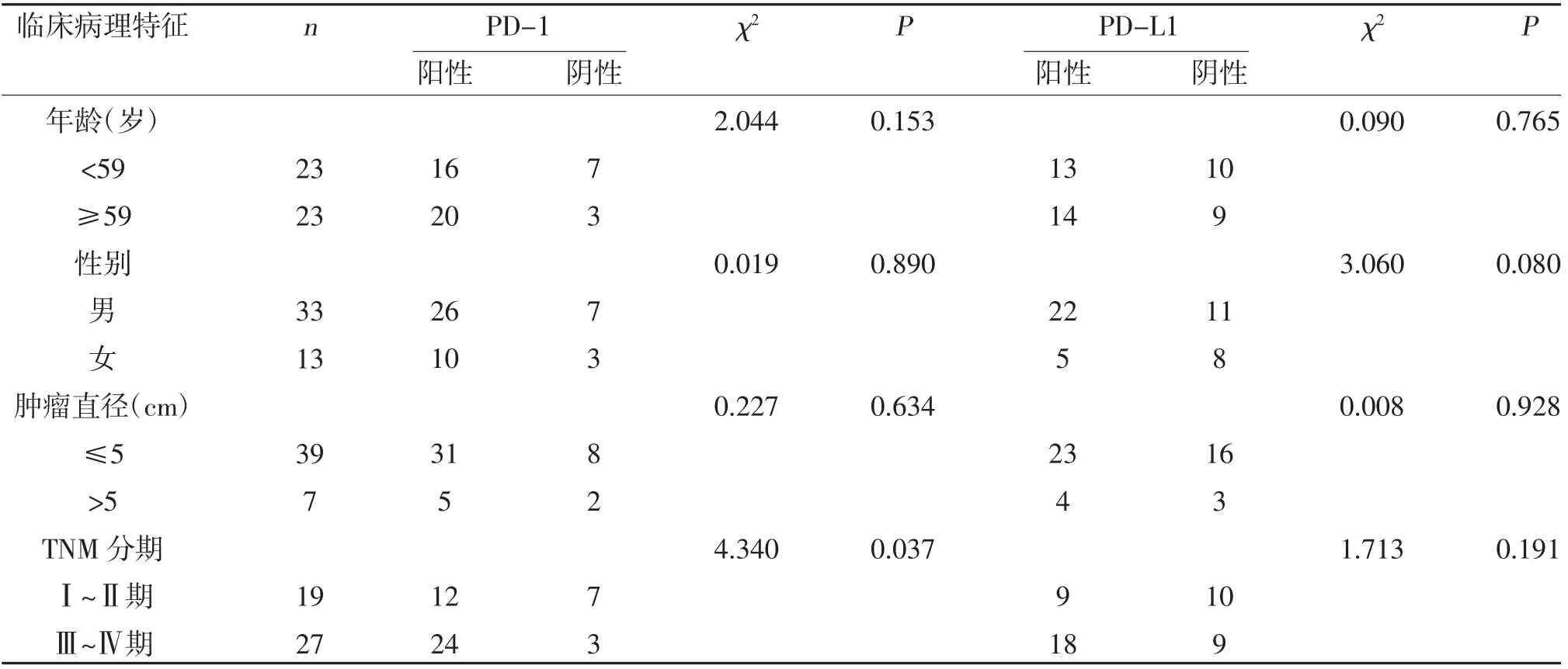
表1 胃癌组织中PD-1 和PD-L1 蛋白的表达与临床病理特征的关系(n)
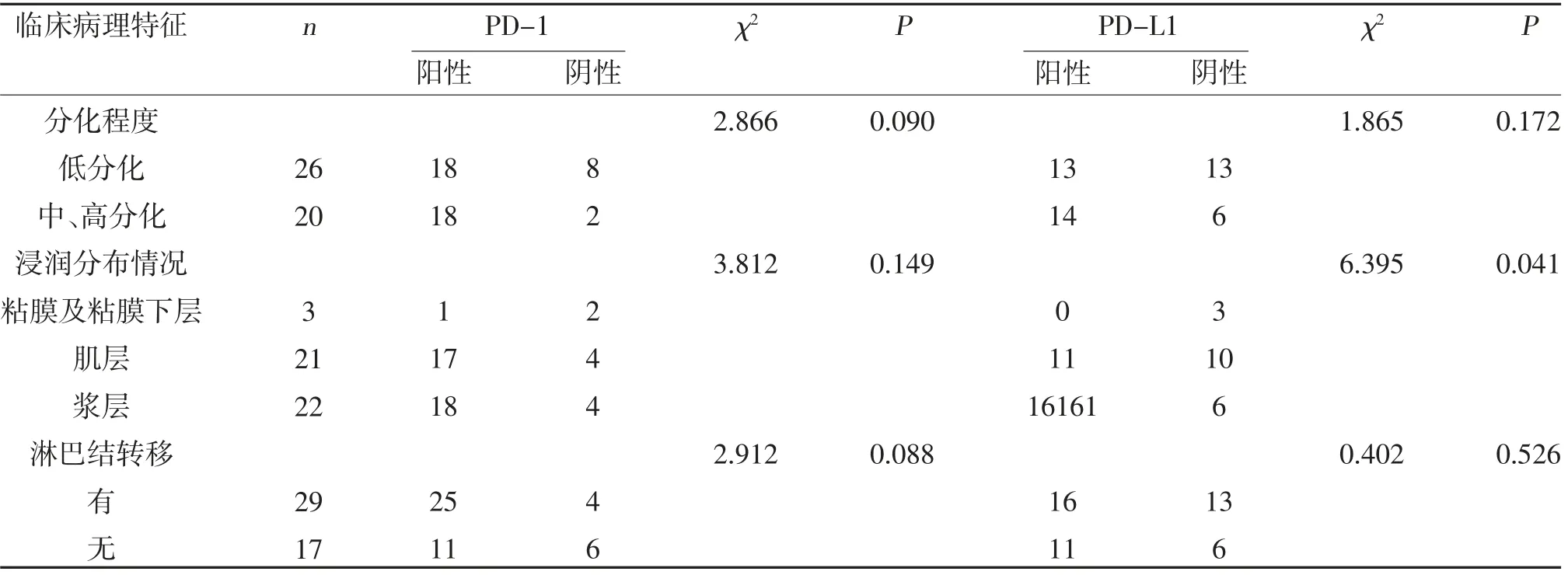
表1(续)
2.2 WB 法检测PD-1 和PD-L1 在胃癌组织中的表达 WB 法检测显示,在胃癌细胞中PD-1 和PD-L1均有表达,见图2。
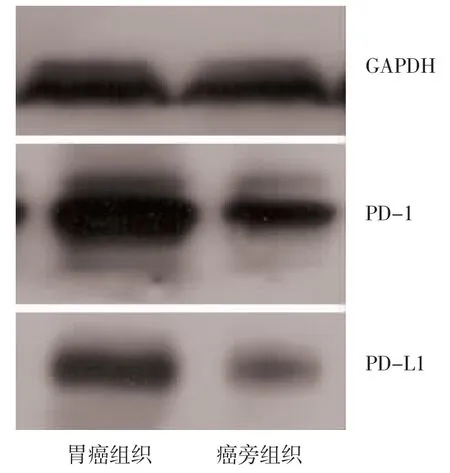
图2 PD-1 和PD-L1 在胃癌及癌旁组织中的表达
3 讨论
胃癌是全球最常见的恶性肿瘤之一,据报道[2,3],我国的胃癌发病率最高,胃癌患病人数约占到了全世界的1/3,其中西北地区边远农村的胃癌发病率及死亡率居全国之首。胃癌的发病死亡率较高,5 年生存率不足40%,这主要就是因为许多患者发现胃癌时多数已是晚期,早期胃癌的检出率不到10%;如果患者能在胃癌仅限于胃壁的黏膜层时检出并进行治疗,5 年的生存率可达95%,因此早期发现并及时治疗对改善胃癌患者预后具有重要意义[4,5],因此急需寻求高度特异性、高度灵敏的胃癌诊断标志物。
PD-1 是CD28 免疫球蛋白超家族中的一名成员,是一种重要的免疫抑制分子。PD-1 主要表达于T 细胞、B 细胞及NK 细胞的表面,在维持淋巴细胞稳态方面起关键作用[6]。PD-L1 是PD-1 的配体,是B7 家族中的成员之一,由IgC 型胞外结构域、跨膜区及一个短胞质区尾部组成,主要表达于成熟的巨噬细胞、T 细胞、树突细胞、单核细胞等[7]。正常情况下,PD-L1 与PD-1 结合后,通过调控T 细胞的增殖与活化,抑制淋巴细胞增殖并诱导其凋亡,从而在自身免疫疾病中发挥重要作用[8]。
肿瘤的发生发展与人体的免疫功能密切相关,正常情况下,免疫系统能够识别并通过免疫机制特异地清除这些“非己”细胞,抵御肿瘤的发生发展。但是在某些情况下,肿瘤细胞能通过多种机制逃避机体免疫系统的识别,在体内迅速增殖,即肿瘤免疫逃逸机制[9]。研究表明[10],PD-L1 与PD-1 结合可引起免疫细胞功能障碍,诱导免疫耐受,发挥负性免疫调节作用,主要表现为中性粒细胞的吞噬功能降低,DC 抗原提呈能力下降,NK 细胞增殖、分泌功能受损,T、B 细胞凋亡增加,Treg 数量增加。PD-L1 与PD-1 分子结合后会影响共刺激信号的传递,抑制抗原提呈细胞对T、B 细胞的活化,发挥免疫抑制作用,而T 细胞表面PD-1 与肿瘤表面表达的PD-L1结合后,可抑制T 细胞的增殖和活化,触发免疫系统对肿瘤细胞的免疫耐受,促进肿瘤生长[11-14]。目前很多研究表明PD-1 和PD-L1 在多种恶性肿瘤中均有高表达,但是对于不同的肿瘤,PD-1 和PD-L1的表达与其临床指征并不完全一致[15.16]。本研究通过对46 例胃癌患者的胃癌组织和癌旁组织进行检测发现,46 例患者胃癌组织中PD-1 蛋白表达阳性率为78.26%(36/46),高于PD-L1 的58.70%(27/46),差异有统计学意义(P<0.05),且不同TNM 分期PD-1 表达比较,差异有统计学意义(P<0.05);不同肿瘤浸润情况PD-L1 表达比较,差异有统计学意义(P<0.05),与李雪薇[17]研究结果相一致;同时,WB 法检测显示,在胃癌细胞中PD-1 和PD-L1 均有表达,提示PD-1 表达与TNM 分期有关,PD-L1 表达与肿瘤浸润情况有关,二者可能参与胃癌的发生发展,并可能作为胃癌的一个潜在治疗靶点。
综上所述,PD-1 和PD-L1 在胃癌的发生发展中起到了一定的作用,与肿瘤的发生、发展及转移密切相关,已成为胃癌肿瘤研究中的重要因子,有望成为胃癌筛查及诊疗的重要标志物,在肿瘤侵袭转移的评估、预后判断和治疗方面有着广阔的临床应用前景。

