不同土壤对仙鹤草愈伤组织增长及总黄酮含量的影响
梁继华,顾建中,乔迺妮
不同土壤对仙鹤草愈伤组织增长及总黄酮含量的影响
梁继华1,顾建中2,乔迺妮1
1. 常德职业技术学院农业与经济系, 湖南 常德 415000 2. 湖南文理学院木建筑工程学院, 湖南 常德 415000
为了获取仙鹤草愈伤组织增殖以及总黄酮含量高的最优土壤条件,为仙鹤草的培育提供有效依据,研究不同土壤条件对仙鹤草愈伤组织增长及总黄酮含量的影响。选择源于湖南涟源的仙鹤草作为植株样本,实验设3个处理步骤:1、在土壤中添加植物生长调节剂;2、在土壤中添加碳源;3、处理在土壤中添加蔗糖。35 d后对各仙鹤草植株愈伤组织增长情况及总黄酮含量进行测定。在土壤中添加1 mg·L-1和2 mg·L-1生长调节剂处理后仙鹤草愈伤组织生长情况相对较差,在土壤中加入较低质量浓度的生长调节剂后,仙鹤草愈伤组织生长情况相对较好,差异有统计学意义(<0.05);将30 mg·L-1的蔗糖添加至土壤中形成的仙鹤草愈伤组织增殖速度最快,和其余条件相比差异有统计学意义(<0.05);添加2 mg·L-1生长调节剂吸光度更低,添加30 mg·L-1蔗糖土壤吸光度更高,总黄酮量更高。总之,在土壤中加入较低质量浓度的生长调节剂,或在土壤中加入浓度是30 mg·L-1的蔗糖,最有助于仙鹤草愈伤组织增长,添加2 mg·L-1生长调节剂总黄酮量比添加30 mg·L-1蔗糖土壤更高。
土壤; 仙鹤草; 愈伤组织; 黄酮
仙鹤草(Ledeb.)又被称作龙牙草,最初被记载在1062年苏颂的《图经本草》,源于蔷薇科植物龙牙草的干燥地上部分[1,2]。仙鹤草能够收敛止血、解毒、补虚、止痢,临床主要被用作止血[3,4]。当前医学研究表明,仙鹤草含黄酮类化合物,不仅可止疼抗炎,抵御心律异常,而且能够降糖,是一种有效的天然抗氧化剂,能够清除机体中的超氧离子自由基,提高免疫力[5,6]。
本研究将愈伤组织产量与总黄酮含量当成评价指标,对仙鹤草愈伤组织诱导、土壤进行筛选,比较不同土壤条件对仙鹤草愈伤组织生长的影响,获取仙鹤草愈伤组织增殖以及总黄酮含量高的最优土壤条件,为仙鹤草的培育提供有效依据。
1 材料和方法
1.1 材料来源
仙鹤草植株样本源于湖南涟源,采集4个批次。对照品源于阿拉丁试剂有限公司。其余试剂都是分析纯。基本土壤为山地草甸土,土壤中有机质含量为4.4%,pH值是6.0左右[7]。
1.2 材料的处理
实验在常德职业技术学院栽培基地中进行,设3个处理步骤:1、在土壤中添加不同浓度植物生长调节剂;2、在土壤中添加不同类型碳源;3、在土壤中添加不同浓度蔗糖,土壤与添加物质的体积比为2:1。每个处理重复6次,每个重复选择6株仙鹤草[8]。把添加硫磺粉的原有土壤与物料混合搅拌均匀后添加至10 cm×10 cm的营养钵中,将仙鹤草植入营养钵中,每隔2 d浇1次水。田间处理设置和上述相同,在宽70 cm深35 cm的定植沟中,搅拌均匀,把仙鹤草苗植入沟中。35 d后,对各仙鹤草植株愈伤组织增长情况及总黄酮含量进行测定。
1.3 培养与检测
仙鹤草愈伤组织诱导茎段在土壤中诱导愈伤组织,同时在相同的土壤中继代培养,把培养后的愈伤组织当成供试材料,测定不同土壤条件对仙鹤草愈伤组织生长及总黄酮含量的影响。
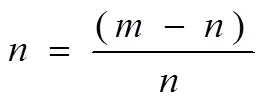
1.4 总黄酮量测定
1.4.1 对照品溶液配置称量120 ℃条件下干燥恒重的芦丁标准品6 mg添加至容量瓶内,加入一定的50%乙醇,通过超声令其溶解,在室内冷却,定容到30 mL,搅拌均匀,即可获取0.25 mg·mL-1的芦丁标准液[8,9]。
1.4.2 最大吸收波长确定通过移液管吸取1.0 mL芦丁标准品溶液放在10 mL比色管中,添加50%的乙醇令其达到6 mL,然后继续添加亚硝酸钠与硝酸铝溶液,搅拌均匀,室温静置5 min,再添加2 ml·L-1的NaOH溶液,加入浓度为50%的乙醇到刻度,搅拌均匀,在常温下静置20 min,在上述过程的基础上添加芦丁标准液混合液,将其当成空白参照,在200~900 nm波长区间内扫描,将吸收度最大情况下的波长510 nm当成芦丁标准品最高特征吸收波长(图1)。
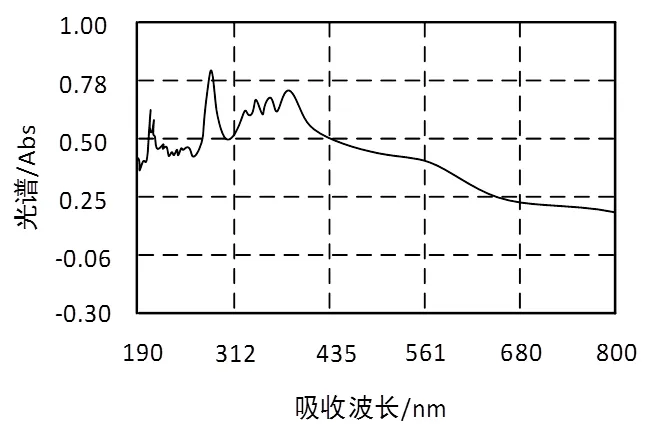
图1 芦丁吸收光谱图
对各增殖的愈伤组织进行继代培养2次,每次培养40 d,继代培养基与增殖培养基保持一致。然后,将增长量较大的几个实验号中的愈伤组织取出,用蒸馏水洗去培养基及坏死部分,烘干。
把仙鹤草样品利用粉碎机粉碎,过六号晒。把药材粉末放在60 ℃干燥箱中处理,称量1 g仙鹤草粉末置于三角瓶中,添加30 mL 50%乙醇溶液,搅拌均匀,放置24 h,通过超声提取器采集35 min,冷却到室温过滤[10,11]。
1.4.3 样本含量测量取上节得到的供试品溶液0.2 mL,放在比色管中,进行显色处理,搅拌均匀,静置20 min,在510 nm处对不同样本的吸收度进行测量[12],同时求出不同样本的总黄酮含量。总黄酮含量可通过下式求出:
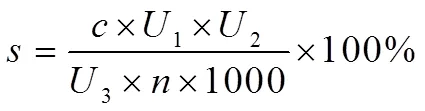
其中,用于描述依据吸光度代入标准曲线求出的浓度值,1用于描述测定样本过程中使用的比色管的溶剂,2用于描述制备供试品溶液过程中添加的50%乙醇溶液的体积数量,3用于描述测量样本过程中采集的供试品体积,用于描述制备供试品溶液过程中称量的样本质量。
2 结果与分析
2.1 不同土壤条件对仙鹤草愈伤组织增长情况的影响
2.1.1 生长调节剂对仙鹤草愈伤组织生长的影响在土壤中加入质量浓度不同的生长调节剂,研究添加生长调节剂后土壤对仙鹤草愈伤组织增殖的影响,结果用表1进行描述。
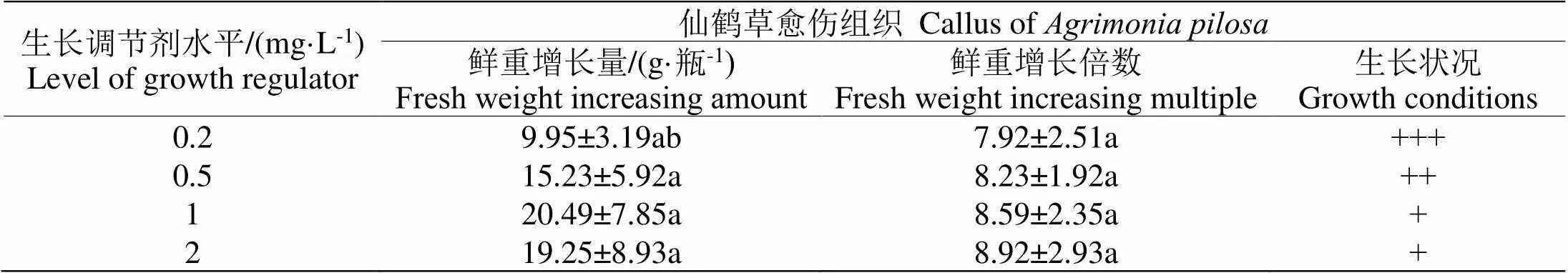
表1 添加生长调节剂后土壤对仙鹤草愈伤组织增殖的影响
注:相同列不同小写字母代表数值间有显著差异,<0.05,+代表生长差,++代表生长较好,+++代表生长很好。下同。
Note: There were significant differences between little letters on the same row at 0.05 level. +: bad in growth, ++: better in growth, +++: the best in growth. The same as follows.
分析表1可以看出,在土壤中加入不同浓度的生长调节剂,处理后仙鹤草愈伤组织增殖速度很快,无显著差异(>0.05)。在土壤中添加1 mg·L-1和2 mg·L-1生长调节剂,处理后仙鹤草愈伤组织生长情况相对较差,在进行培养时容易老化,叶片逐渐呈褐色,无法进行继代培养。在土壤中加入较低质量浓度的生长调节剂后,仙鹤草愈伤组织生长情况相对较好,差异有统计学意义(<0.05)。
2.1.2 加入碳源土壤对仙鹤草愈伤组织生长的影响在土壤中依次添加蔗糖与葡萄糖当成碳源,培养仙鹤草愈伤组织,碳源对愈伤组织生长的影响情况用表2进行描述。
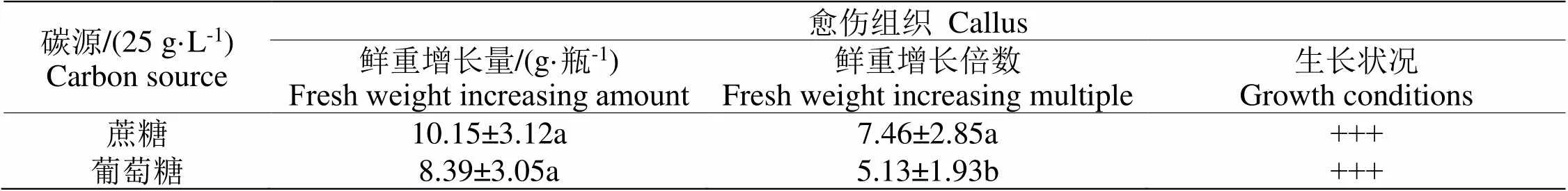
表2 碳源对愈伤组织生长的影响情况
分析表2可以看出,将两种碳源加入土壤中,仙鹤草愈伤组织生长情况都很好,但将蔗糖当成碳源加入土壤中,仙鹤草愈伤组织增殖率比加入葡萄糖的土壤更高,差异有统计学意义(<0.05)。
2.1.3 加入不同质量浓度蔗糖的土壤对仙鹤草愈伤组织生长的影响加入不同质量浓度蔗糖的土壤对仙鹤草愈伤组织生长的影响情况用表3进行描述。

表3 加入不同质量浓度蔗糖的土壤对仙鹤草愈伤组织生长的影响
分析表3可以看出,在土壤中添加不同质量浓度蔗糖,形成的仙鹤草愈伤组织生长情况都相对较好,其中,将30 mg·L-1的蔗糖添加至土壤中形成的仙鹤草愈伤组织增殖速度最快,将40 mg·L-1的蔗糖添加至土壤中形成的仙鹤草愈伤组织增殖速度最慢,差异有统计学意义(<0.05)。
2.2 不同土壤条件对仙鹤草愈伤组织增长情况及总黄酮含量的影响
依次对添加2 mg·L-1生长调节剂、30 mg·L-1的蔗糖土壤对仙鹤草愈伤组织增长情况及总黄酮含量的影响进行分析,在510 nm波长下,对其中一组的相对吸收情况作为参考,对另一组的相对吸收度进行测量,见表4。

表4 不同土壤条件对仙鹤草愈伤组织增长情况及总黄酮含量的影响
添加2 mg·L-1生长调节剂吸光度更低,添加30 mg·L-1蔗糖土壤吸光度更高,总黄酮量更高。
3 讨论
生长调节剂通常利用调节部分酶的合成与活性对仙鹤草愈伤组织生长产生影响,对生长调节剂质量浓度进行调整,一般会导致仙鹤草愈伤组织产生很大的改变,在本研究中,向土壤中添加较低质量浓度的生长调节剂能够帮助仙鹤草愈伤组织增长。
碳源为土壤中主要的能源物质,亦为主要的渗透调节物质,对愈伤增长有很大影响,然而不同植物对碳源的影响是存在差异的。本研究将蔗糖当成碳源能够帮助仙鹤草愈伤组织增长,这主要是由于蔗糖与葡萄糖相比能够有效保持土壤中低渗环境,不容易帮助仙鹤草细胞脱水造成愈伤组织增长,并且蔗糖和葡萄糖相比更有助于仙鹤草愈伤组织生物量积累。
4 结论
课题研究发现将蔗糖当成碳源添加至土壤中,在浓度是30 mg·L-1的情况下最合理,在浓度是45 mg·L-1与15 mg·L-1情况下愈合组织增长最好,可以看出蔗糖质量浓度对仙鹤草生长非常重要。
添加2 mg·L-1生长调节剂总黄酮量比添加30 mg·L-1蔗糖土壤更高和上述土壤条件对仙鹤草愈伤组织增长的结论一致。
综上可得出:(1)向土壤中添加较低质量浓度的生长调节剂能够帮助仙鹤草愈伤组织增长;
(2)将蔗糖碳源添加至土壤比将葡萄糖碳源添加至土壤更能帮助仙鹤草愈伤组织增长;
(3)在蔗糖浓度是30 mg·L-1的情况将其添加至土壤,最有助于仙鹤草愈伤组织增长;
(4)添加2 mg·L-1生长调节剂总黄酮量比添加30 mg·L-1蔗糖土壤更高。
[1] 高意,周光明,陈军华,等.高效液相色谱法同时测定仙鹤草中6种黄酮[J].食品科学,2015,36(18):93-96
[2] 丛慧源,王颖,邓雁如.2种近缘中药翻白草和仙鹤草的化学成分和降血糖活性比较[J].中草药,2015,46(16):2484-2491
[3] 王江英,吴斌,范正琪,等.木糖筛选系统对杜鹃红山茶愈伤组织诱导及生长的影响[J].热带作物学报,2015,36(2):321-328
[4] 刘晓丹,张克勤,刘连,等.乌腺金丝桃愈伤组织中总黄酮及金丝桃素含量测定[J].生物技术通报,2015,31(1):98-103
[5] 宋跃,甄成,张含国,等.长白落叶松胚性愈伤组织诱导及体细胞胚胎发生[J].林业科学,2016,52(10):45-54
[6] 程艳刚,谭金燕,叶文冲,等.基于Plackett-Burman设计和Box-Behnken响应面法优化仙鹤草总黄酮超声提取工艺及 其抗氧化抗肿瘤活性研究[J].中华中医药学刊,2018,36(10):2414-2419
[7] 房慧勇,朱虹,丁海麦,等.影响愈伤组织中次生代谢产物含量的因素研究进展[J].中国中药杂志,2014,39(15):2846
[8] 李千,孙丹,李宏博,等.北五味子愈伤组织增殖及胚性愈伤组织诱导的研究[J].种子,2014,33(6):5-9
[9] Stolarz M, Binkowski M, Ficek K,. Methodology for X-ray microtomography assessment of regeneration and growth of bone tissue within the area of integration of the anterior cruciate ligament graft in sheep [J]. Journal of Medical Imaging & Health Information, 2016,6(1):14-21
[10] 叶佳丽,李伟平,熊明星,等.不同激素对白及愈伤组织总酚含量的影响[J].中药材,2014,37(2):192-194
[11] Helaly MN, El-Hosieny HAR, El-Sarkassy NM,. Growth, lipid peroxidation, organic solutes, and anti-oxidative enzyme content in drought-stressed date palm embryogenic callus suspension induced by polyethylene glycol [J]. In Vitro Cellular & Developmental Biology - Plant, 2017,53(2):133-141
[12] 梁文惠,黄翔,林丽春,等.银杏愈伤组织黄酮提取条件的正交实验优化[J].食品工业科技,2015,36(9):209-213
Effects of Different Soils on Callus and Total Flavonoids Content inLedeb.
LIANG Ji-hua1, GU Jian-zhong2, QIAO Nai-ni1
1.415000,2.415000,
In order to obtain the optimal soil conditions for callus proliferation and high total flavonoids content fromLedeb. to provide effective basis for the cultivation of the calla and study the effect of different soil conditions on the callus growth and total flavonoid content of the calla. The celestial grass from Fuzhou, Jiangxi was selected as a plant sample. The experiment consists of three processing steps. Step one is to add a plant growth regulator to the soil. Step two is to add a carbon source to the soil. Step three is to add sucrose to the soil. After 35 days, the callus growth and total flavonoid content of each plant were measured. It was found that 1 mg·L-1and 2 mg·L-1growth regulators were added to the soil, and the callus growth of the crane was relatively poor after treatment. After adding a lower mass concentration of the growth regulator to the soil, the crane Callus growth was relatively good, and the difference was statistically significant (<0.05). The callus proliferation ofcallus formed by adding 30 mg·L-1of sucrose to the soil was the fastest, which was similar to the other conditions. The specific difference was statistically significant (<0.05); the absorbance of 2 mg·L-1growth regulator was lower, the soil absorbance of 30 mg·L-1sucrose was higher, and the total flavonoids were higher. The following conclusions are drawn: adding a low-mass growth regulator to the soil, or adding sucrose at a concentration of 30 mg·L-1to the soil, is most conducive to the growth ofcallus, adding 2 mg·L The total flavonoids of-1growth regulator were higher than those of soil supplemented with 30 mg·L-1sucrose.
Soil;Ledeb.; callus; flavonoid
S567.239
A
1000-2324(2021)03-0443-05
2019-01-05
2019-03-06
湖南省科技厅课题(2015NK2113)
梁继华(1979-),女,硕士,副教授,研究方向:植物与环境. E-mail:jihualiang521@126.com

