东北东部山区主要树种枝条及其组分水力特征
荆 烁,孙慧珍
(东北林业大学林学院生态研究中心,森林生态系统可持续经营教育部重点实验室,黑龙江 哈尔滨 150040)
近几十年来,在全球气候变暖的背景下,由于干旱强度、频率和持续时间均明显增加[1],导致半干旱区及湿润区主要生物群区树木个体或大片森林相继死亡[2]。水分是树木生长的主要限制因子[3],树木为了维持体内水分平衡形成了一套完备的水分吸收、运输和散失的连续系统。在这一系统中,叶片作为树木与大气水分迁移的一个重要环节,其导水阻力(导水率倒数)占整株树木水分运输阻力的30%~80%[4-5],限制了树木的水分运输。以往对叶片导水率(Klb)的研究大多聚焦在阔叶树种,且通常带叶柄测量[6];针叶树种由于针叶小且多而难以处理,多采用枝条的测量结果作为Klb[7-9]。Meitern等[10]应用高压流速仪(High pre-ssure flowmeter)的准稳态法,将杂交白杨(Populustremula×P.tremuloides)幼苗枝条分成叶片、叶柄和茎段3个组分,分别测量和计算枝条及其组分导水率,证明了枝条及其组分导水率差异显著,其中叶片导水率显著高于枝条。可见对于杂交白杨幼苗来说,采用枝条代替Klb的数据并不合适。然而,对于其他树种尤其是针叶树种枝条及其组分间导水率的关系鲜有报道。
按照木质部的孔性特征,阔叶树种分为散孔材和环孔材,针叶树种为无孔材[11]。在枝条和茎段水平上,不同材性树种的木质部输水单元解剖结构特征与水分运输效率联系紧密。通常环孔材树种水分运输能力最高,散孔材其次,无孔材最低,即阔叶树种水分运输能力高于针叶树种[12-13]。然而在叶片水平上,影响水分运输的因素除了输水单元结构,还与叶脉密度、叶肉以及表皮解剖结构密切相关。一般认为,较高的叶脉密度增加了与叶肉细胞的水分交换面积[14]。但也有研究表明,复杂且冗余的叶脉网络及细小叶脉的木质化反而增加了叶片水力阻力[15]。与枝条和茎段相比,不同材性和叶习性树种的叶水力性状是否存在相似的水分运输规律尚不清楚。
叶片的结构性状影响着叶片的输水、气体交换、光合作用、蒸腾作用乃至植物的生长、分布等[16-17]。其中叶片比叶质量(leaf mass per unit area, LMA)和干物质含量(leaf dry mass content, LDMC)是两个关键的叶结构性状指标。干旱环境中植物的这两个指标明显增大,显著地影响叶片水分运输能力。已有研究表明以上两指标与Klb关系并不一致。例如LMA、LDMC与基于叶面积的Klb(Klb-area)不相关[6,9],但与基于叶质量的Klb(Klb-mass)负相关[6-8],表明树木叶片结构建成与其水分运输系统的碳投资分配之间可能存在权衡关系[8]。研究Klb与LMA和LDMC的关系依赖于Klb的准确测量,如采用带叶柄的叶片或枝条作为Klb数值,分析与LMA或LDMC的关系极有可能影响研究结果的方向。
地处寒带和温带之间的东北地区,近50年以来年均气温已增加1.5 ℃[18],一些地区夏秋季降水减少12%[19]。东北地区是我国木材生产与生态功能具有重要地位的天然次生林分布区之一。该区森林不仅为国家经济建设提供占比约1/3的木材,而且在森林生态系统服务价值上如保持土壤、水文调节、生物多样性保育、碳平衡等具有举足轻重的地位。东北东部山区被破坏的原地带顶极群落阔叶红松林经过几个阶段的演变才逐渐恢复为现有较典型的天然次生林相。在日益暖干化的趋势下,探究该区树木枝条及其组分的导水率分布特征显得尤为迫切。本研究以野外自然生长的主要树种为研究对象,采用基于高压流速仪的准稳态法,分析主要针阔叶树种枝条及其组分导水率分布特征,比较针阔叶树种枝条同一组分导水率的差异,并建立以上指标与叶性状的关系,旨在为该区主要树种枝条水力分割提供较为全面的材料,为该地区暖干化趋势下的树木存亡分析提供参考,并为构建树木枝-叶水力传导机理模型提供科学依据。
1 材料与方法
1.1 研究区概况及样树选择
研究地点位于黑龙江帽儿山森林生态系统国家野外科学观测研究站(127°40′E,45°24′N),处于我国温带典型的针阔混交林-阔叶红松林的中心分布区,平均海拔400 m,平均坡度10°~15°,主要土壤类型为暗棕壤。该地区为典型的温带季风气候,四季分明,夏季短而湿热,冬季寒冷干燥;年均气温3.1 ℃,年均降水量600~800 mm,主要集中在6—8月。
在研究站内选择立地条件基本一致、自然生长良好、包括不同材性和叶性状的7个树种(表1)。每个树种随机选取长势健康的5株样树,于2018年的5—9月每月晴朗天气的凌晨进行指标测定。
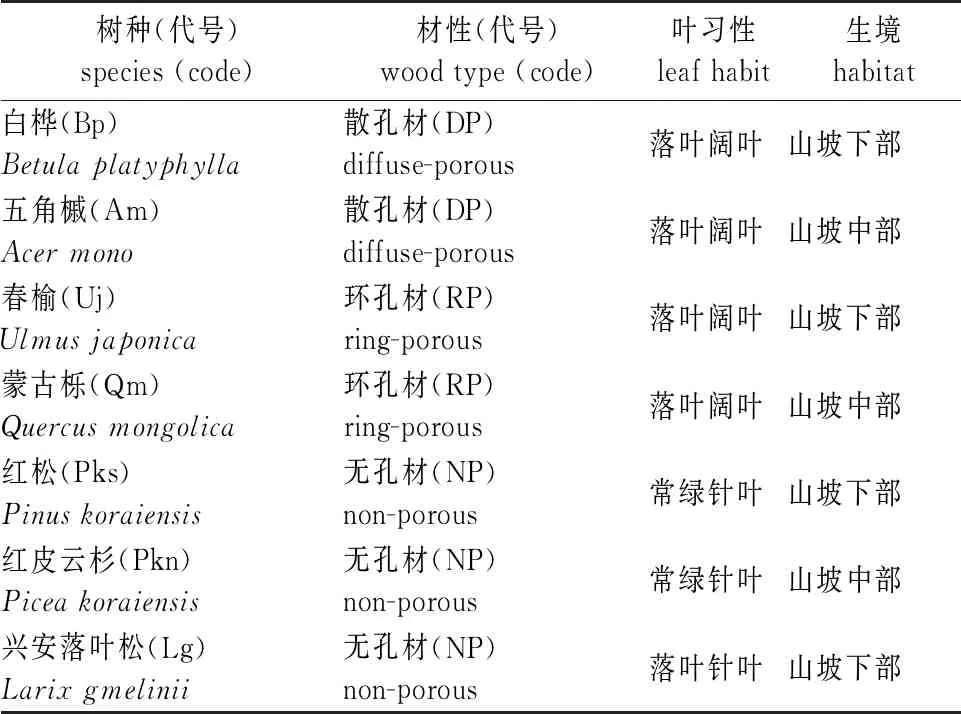
表1 7个树种样木基本特征
1.2 研究方法
黎明前,从每株样木树冠南向中上部剪取长约50 cm的枝条各1枝,迅速放入水桶内并在水下从基部切除10 cm左右,用黑色塑料袋套于枝条上部,立即带回实验室。在蒸馏水中,剪取长约15 cm的枝条,剥去切口端1 cm左右的树皮后,连接到高压流速仪(HPFM-Gen3,Dynamax,USA)的压力耦合器上。仪器设置为准稳态测定模式,在0.42 MPa稳定压强下将去气的蒸馏水灌注到枝条内,达到稳定流速(需要15~25 min),获得枝条导水率(Kwb);然后摘除枝条上所有叶片,继续测量直至稳定流速,此时得到带叶柄的茎段导水率(K(b+p)),通过公式(1)计算叶片导水率(Klb):
(1)
摘除茎段上所有叶柄继续测量,达到稳定流速后得到茎段导水率(Kb),通过公式(2)计算叶柄导水率(Kp):
(2)
最后,利用导水率与其阻力成倒数的关系,计算枝条各组分水力阻力。以上导水率分别除以叶面积或叶质量,得到标准化后基于叶面积和叶质量的枝条导水率(Kwb-area、Kwb-mass)、茎段导水率(Kb-area、Kb-mass)及叶片导水率(Klb-area、Klb-mass)。
将以上待测枝条的叶片泡水至饱和后,通过万分之一电子天平(AR2140,New Jersey,USA)称量叶饱和质量。利用扫描仪(LiDE 120,Canon,中国)扫描叶片,通过批量计算软件(Batch)得到叶面积。最后在75 ℃下烘干48 h确定叶干质量。比叶质量(LMA)=叶干质量/叶面积,叶干物质含量(LDMC)=叶干质量/叶饱和质量。
1.3 数据处理
利用SPSS 21.0统计并分析数据。采用单因素分析法(One-way ANOVA)检验同一树种枝条及其组分与不同树种枝条同一组分间导水率的差异(α= 0.05)。根据枝条各组分导水率的倒数计算相应部位的水力阻力,确定枝条水力阻力分配格局。通过曲线拟合建立水力指标与叶性状之间的关系。利用SigmaPlot 12.5软件作图,图中数据均为平均值±标准误(n=5)。
2 结果与分析
2.1 枝条及其组分导水率比较和水力阻力分配
同一时期,红松的Klb显著高于Kb和Kwb(P<0.05),前者约是后两者的4倍,且Kb和Kwb差异不显著;其余6个树种总体上表现为Klb和Kwb显著低于Kb(P<0.05),且Klb与Kwb差异不显著(图1)。4个阔叶树种的Kp是其相应Kb、Klb和Kwb的10~100倍(图1)。

不同小写字母代表同一树种同一月份不同组分导水率差异显著(P<0.05)。树种缩写见表1,Kb、Klb、Kwb和Kp分别代表茎段、叶片、枝条和叶柄导水率。下同。Different lowercase letters indicate significant differences in hydraulic conductance of different parts of the same tree species in the same month (P<0.05). Tree abbreviations are shown in Table 1. The Kb, Klb, Kwb, and Kp represent the hydraulic conductance of the leafless branch, leaf blades, whole branch and petiole, respectively. The same below.
7个树种枝条水力阻力(简称阻力)分配格局略有不同(图2)。同为针叶树种,红松针叶阻力仅占枝条总阻力的20%左右,茎段阻力占比可达80%;而红皮云杉和兴安落叶松针叶阻力占比分别为61%、70%。阔叶树种叶片阻力占枝条总阻力的67%~80%,茎段阻力仅占18%~39%,叶柄对全枝水力阻力贡献最小,值为1%~6%。7个树种中,红松针叶阻力显著低于其余6个树种,且6个树种间叶阻力相似。
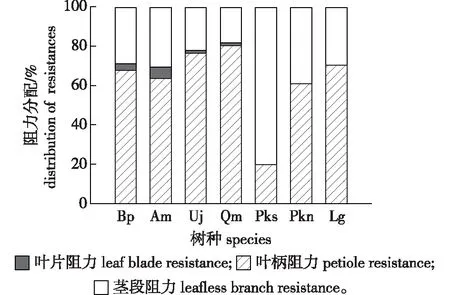
图2 7个树种枝条水力阻力的分配
2.2 不同树种枝条同一组分水力指标对比
按照Kb指标(图3A),树种间排序由高到低依次为:蒙古栎(Qm)、春榆(Uj)、白桦(Bp)、五角槭(Am)、红松(Pks)、红皮云杉(Pkn)和兴安落叶松(Lg);不同材性间Kb表现为环孔材最高,其次为散孔材,无孔材最低(P<0.05);叶习性Kb表现为阔叶树高于针叶树(P<0.05)。若按照Klb和Kwb指标(图3B),树种间排序相似,而且与Kb略有不同。例如,依据Klb和Kwb,红松最高,其他树种排序与Kb相似。另外,不同材性以及叶习性功能群间其Klb或Kwb均无显著差异。
以上3个指标按照叶面积标准化后,树种间排序有一定变化。例如,Kb-area由高到低呈现为白桦、兴安落叶松、红皮云杉、春榆、蒙古栎、五角槭和红松(图3C),Klb-area由高到低依次为红松、红皮云杉、白桦、兴安落叶松、春榆、蒙古栎和五角槭(图3D),Kwb-area由高到低为白桦、红皮云杉、红松、兴安落叶松、春榆、蒙古栎和五角槭(图3D)。相同之处在于3个指标涉及的春榆、蒙古栎和五角槭、白桦、红皮云杉和兴安落叶松排序位置相对稳定;不同在于红松的Kb-area、Klb-area和Kwb-area分别位于最低、最高和居中。不同材性和叶习性功能群间Kb-area和Kwb-area对比结果相似,均无显著差异(图3C、3D);而Klb-area表现为无孔材(针叶树种)显著高于散孔材与环孔材(阔叶树种),且散孔材与环孔材之间差异不显著(图3D)。
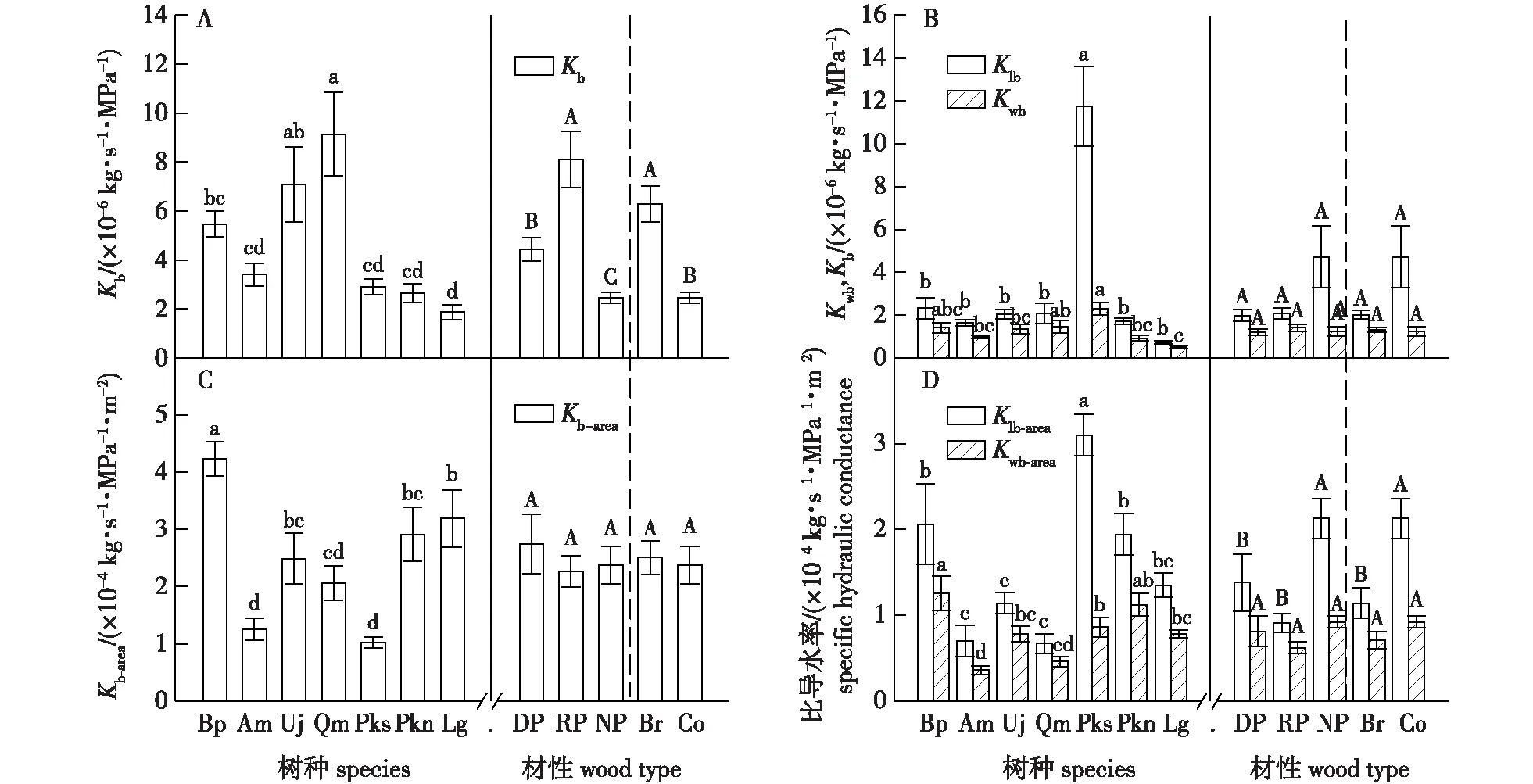
不同小写字母、大写字母分别表示不同树种之间、不同材性及叶习性功能群之间差异显著(P<0.05)。Kb-area、Klb-area和Kwb-area分别代表基于叶面积的茎段、叶片和枝条导水率(比导水率)。下同。DP、RP和NP分别代表散孔、环孔和无孔材树种;Br和Co分别代表阔叶和针叶。Different lowercase and uppercase letters indicate significant differences between different tree species, wood types, and leaf habits (P<0.05). Kb-area, Klb-area, and Kwb-area represent the hydraulic conductance of leafless branch, leaf blades, and whole branch based on leaf area(specific hydraulic conductance). The same below. The DP, RP, and NP represent diffuse-, ring-, and non-porous functional groups, respectively. The Br and Co represent broadleaf and conifer groups, respectively.
2.3 不同树种水力指标与叶性状的关系
7个树种枝条及其组分导水率与叶性状指标拟合结果显示(图4),Klb-area、Kwb-area和Kb-area与LMA和LDMC均为正相关。其中Klb-area与LMA和LDMC关系极显著(P<0.01),Kwb-area和LMA关系显著(P<0.05)。Klb-mass、Kwb-mass与Kb-mass与LMA、LDMC均为负相关,其中Kwb-mass和Kb-mass与两者关系极显著(P<0.01)。

LMA.比叶质量leaf mass per unit area;LDMC.叶干物质含量 leaf dry mass content。
3 讨 论
“脆弱性分割假说”[20]认为,树木在面临干旱胁迫时,通过牺牲“造价廉价”的末端器官保护“造价昂贵”的茎干,即叶片作为安全阀保护树体水力通路,以避免枝条发生栓塞。即使在非干旱胁迫环境下,叶片水分运输能力也会因易栓塞而定期大幅度降低[4]。因此,尽管叶片的水力路径不足树木总水力路径的5%,但构成了树木水流阻力的重要组成部分。已有研究表明,叶片阻力(Rlb)占枝条水分运输阻力(Rwb)的40%~80%[10,21-23]。例如,杂交白杨Rlb占其Rwb的52%~70%,茎段阻力(Rb)和叶柄(Rp)阻力分别占20%~36%和低于10%;南欧紫荆Rlb约占其Rwb的80%,Rb和Rp占比均低于10%。本研究测定的7个树种中,阔叶的白桦、五角槭、春榆、蒙古栎和针叶的红皮云杉、兴安落叶松这6个树种Rlb占Rwb60%以上,最大可达80%;而Rb和Rp仅占18%~39%和1%~6%。因此,以上树种因茎段和叶柄内的阻力较小,Klb与Kwb数据相似。而红松Rlb仅占其Rwb的20%,茎段高达80%,使得Klb是Kwb的4倍左右。因此,除了红松,对其余6个树种可以利用枝条代替叶片测定导水率。
通常因木质部输水组织解剖结构差别,导水率由高到低依次为环孔材、散孔材、无孔材树种。本研究中茎段导水率(Kb)结果符合上述规律。但Klb或基于叶面积的Klb-area表现为无孔材的红松最高,环孔材与散孔材树种相似。若去除数值较高的红松,其他针叶树种Klb和Klb-area与阔叶树相比并不低。Becker等[24]也发现贝壳杉(Agathisborneensis)的Klb-area为3.0×10-4kg/(s·MPa·m2),仅低于血桐(Macarangatriloba)和野牡丹(Melastomamalabathricum),明显高于其余的7个阔叶树种。金鹰等[8]得到红松和红皮云杉的Klb-area分别为3.9×10-4、3.24×10-4kg/(s·MPa·m2),明显比山杨(Populusdavidiana)、蒙古栎和水曲柳(Fraxinusmandshurica)的高,这可能由于阔叶复杂且高度冗余的叶脉网络[24]以及细小叶脉的栓塞[25]和木质化[15]增加了水力阻力。另外,研究发现阔叶叶肉细胞大多远离主脉,导致面积较大的阔叶树叶片中非木质途径水分运输阻力占整个叶片阻力的60%~85%[26-27]。
与阔叶相反,针叶中央具有1~2个维管束,水流通过较短的路径运移到叶肉中,弥补了针叶树种木质部输水效率低的限制[24]。虽同为针叶树种,不同树种针叶同样也存在输水和散逸系统相互协调、相互作用、相互影响,从而保证体内水分平衡。例如红松管胞弦径、纹孔直径与兴安落叶松相似,但管胞长度可达5 060~6 540 μm[11],减少水分穿越不同管胞所需的能量和阻力,维持较高的针叶水分运输,保证水分供应。另一方面,红松针叶角质层较厚,叶肉细胞明显褶皱,气孔导度最大值及平均值介于0.06~0.09 mol/(m2·s),低于兴安落叶松[0.11 mol/(m2·s)]和红皮云杉[0.18 mol/(m2·s)],致使红松蒸腾速率仅为后两者的30%~50%[28-31],因此红松针叶散水少,具有明显的保水功能。这也与红松具有较低的质壁分离渗透势[32]和木质部栓塞脆弱性(P50)[33]的研究结果相一致,均表明红松具有较强的耐旱性。这可能也是红松成为该地区顶极建群种的原因之一。以上说明各树种叶片输水是由于叶脉、叶肉以及表皮解剖结构特征存在一定程度的补偿关系,综合作用于叶片,以达到内在稳态平衡及适应于环境。
本研究中,环孔材与散孔材树种Klb-area相似。如不论是温带长白山地区的环孔材树种裂叶榆(U.laciniata)、春榆、蒙古栎和散孔材树种紫椴(Tiliaamurensis)、糠椴(T.mandshurica)、山杨、大青杨(P.ussuriensis)[34],帽儿山地区的环孔材树种水曲柳、蒙古栎、胡桃楸(Juglansmandshurica)和散孔材树种白桦、山杨、紫椴[8],还是西北半干旱地区的环孔材树种白蜡树(Fraxinuschinensis)、刺槐(Robiniapseudoacacia)、合欢(Albiziajulibrissin)和散孔材树种毛白杨(Populnstomentosa)、法国梧桐(Platanushispanica)、樱花(Cerasusserrulata)[12],两种材性间Klb-area均没有显著差异。这可能是因为导管直径与密度负相关,即环孔材导管直径大于散孔材,但其导管密度低于散孔材,因而平衡了环孔材和散孔材树种的叶片输水效率[6]。
Klb-area是指单位叶面积上的叶导水率,表征叶片-大气界面上的表面生理过程,用于衡量叶水力系统为叶片蒸发表面提供水分的效率[8]。已有研究发现,Klb-area与比叶质量(LMA)和叶干物质含量(LDMC)均不相关[6,9,35]。而本研究结果显示,Klb-area与LMA和LDMC显著正相关。单独分析发现,4个阔叶树种的Klb-area与LMA和LDMC不相关;而针叶树种Klb-area与两者显著正相关(P<0.05)。这可能因为针叶和阔叶性状的较大差异导致Klb-area并不能够代表针叶水力系统向叶组织供应水分的能力。
Klb-mass是指单位叶干质量的叶导水率,表征叶肉组织中的水分运输过程,用于描述叶水力系统提供整个叶组织的供水效率[36]。已有研究发现,Klb-mass与LMA和LDMC显著负相关[6-8]。例如,帽儿山地区水曲柳、蒙古栎、胡桃楸、白桦、山杨、紫椴、红松、红皮云杉和樟子松(Pinussylvestrisvar.mongolica)的Klb-mass与LMA和LDMC均为显著负相关。本研究也发现,Klb-mass、Kwb-mass和Kb-mass均与LMA和LDMC负相关。意味着红松等抗栓塞能力强的树种具有较高的LMA和LDMC,降低了该树种的Klb-mass,表明单位叶质量上的水分运输效率与叶片结构建设碳投资之间存在权衡关系[37],树木通过调节各性状的关系,进行资源优化配置,进而适应环境变化[38]。以上说明,若采用基于单位叶质量的枝条及其组分导水率指标,能够如实反映针阔叶树种叶导水率与叶性状的关系。
目前,已有研究采用高压流速仪测定不同气候带树种导水率。如婆罗洲12个热带雨林树种的Klb-area和Kwb-area分别为1.0×10-4~8.91×10-4、0.44×10-4~4.46×10-4kg/(s·MPa·m2)[24];意大利东北部16个亚热带树种的Klb-area、Kwb-area和Kb-area分别为0.28×10-4~3.73×10-4、0.26×10-4~1.71×10-4和1.63×10-4~6.12×10-4kg/(s·MPa·m2)[39]。针对温带树种的相关研究开展较多,例如法国东北部的夏栎(Q.robur)、无梗花栎、柔毛栎、北美红栎(Quercusrubra)Klb-area分别为0.54×10-4、0.52×10-4、0.41×10-4和0.49×10-4kg/(s·MPa·m2)[23];法国中部8种基因型美洲黑杨(P.deltoides×P.nigra)的Kb-area为2.6×10-4~4.2×10-4kg/(s·MPa·m2)[40];美国东北部红花槭(A.rubrum)、糖槭(A.saccharum)的Klb-area分别为0.77×10-4和0.42×10-4kg/(s·MPa·m2)[22];爱沙尼亚东部杂交白杨幼苗的Klb-area、Kwb-area和Kb-area分别为1.24×10-4~3.21×10-4、0.82×10-4~1.63×10-4和4.21~6.32×10-4kg/(s·MPa·m2)[10]。本研究利用同样方法,得到我国东北东部山区7个温带树种的Klb-area、Kwb-area和Kb-area分别为0.67×10-4~3.10×10-4、0.36×10-4~1.25×10-4和1.02×10-4~4.23×10-4kg/(s·MPa·m2),与前人研究结果相似。
致谢:黑龙江帽儿山森林生态系统国家野外科学观测研究站提供帮助。
参考文献(reference):
[1]SHEFFIELD J, WOOD E F. Global trends and variability in soil moisture and drought characteristics, 1950-2000, from observation-driven simulations of the terrestrial hydrologic cycle[J]. J Climate, 2008, 21(3): 432-458. DOI: 10.1175/2007jcli1822.1.
[2]ALLEN C D, MACALADY A K, CHENCHOUNI H, et al. A global overview of drought and heat-induced tree mortality reveals emerging climate change risks for forests[J]. For Ecol Manag, 2010, 259(4): 660-684. DOI: 10.1016/j.foreco.2009.09.001.
[3]段娜, 汪季, 郝玉光, 等. 水分变化对荒漠植物白刺气体交换参数及形态特征的影响[J]. 南京林业大学学报(自然科学版), 2019, 43(6): 32-38. DUAN N, WANG J, HAO Y G, et al. Effects of gas exchange and morphological characteristics of desert speciesNitrariatangutorumunder moisture variation[J]. J Nanjing For Univ(Nat Sci Ed), 2019, 43(6): 32-38. DOI: 10.3969/j.issn.1000-2006.201812036.
[4]DOMEC J C, PALMROTH S, WARD E, et al. Acclimation of leaf hydraulic conductance and stomatal conductance ofPinustaeda(loblolly pine) to long-term growth in elevated CO2(free-air CO2enrichment) and N-fertilization[J]. Plant Cell Environ, 2009, 32(11): 1500-1512. DOI: 10.1111/j.1365-3040.2009.02014.x.
[5]VOICU M C, ZWIAZEK J J. Diurnal and seasonal changes of leaf lamina hydraulic conductance in bur oak (Quercusmacrocarpa) and trembling aspen (Populustremuloides)[J]. Trees-Struct Funct, 2011, 25(3): 485-495. DOI: 10.1007/s00468-010-0524-8.
[7]VILLAGRA M, CAMPANELLO P I, BUCCI S J, et al. Functional relationships between leaf hydraulics and leaf economic traits in response to nutrient addition in subtropical tree species[J]. Tree Physiol, 2013, 33(12): 1308-1318. DOI: 10.1093/treephys/tpt098.
[8]金鹰, 王传宽. 九种不同材性的温带树种叶水力性状及其权衡关系[J]. 植物生态学报, 2016, 40(7): 702-710. JIN Y, WANG C K. Leaf hydraulic traits and their trade-offs for nine Chinese temperate tree species with different wood properties[J]. Chin J Plant Ecol, 2016, 40(7): 702-710. DOI: 10.17521/cjpe.2016.0064.
[9]MARTINS S C, MCADAM S A, DEANS R M, et al. Stomatal dynamics are limited by leaf hydraulics in ferns and conifers: results from simultaneous measurements of liquid and vapour fluxes in leaves[J]. Plant Cell Environ, 2016, 39(3): 694-705. DOI: 10.1111/pce.12668.
[11]成俊卿, 杨家驹, 刘鹏. 中国木材志[M]. 北京: 中国林业出版社,1992. CHENG J Q, YANG J J, LIU P. Woods of China[M]. Beijing: China Forestry Publishing House, 1992.
[12]左力翔, 李俊辉, 李秧秧, 等. 散孔材与环孔材树种枝干、叶水力学特性的比较研究[J]. 生态学报, 2012, 32(16): 5087-5094. ZUO L X, LI J H, LI Y Y, et al. Comparison of hydraulic traits in branches and leaves of diffuse- and ring-porous species[J]. Acta Ecol Sin, 2012, 32(16): 5087-5094. DOI: 10.5846/stxb201110281610.
[13]BRODRIBB T J, HOLBROOK N M, HILL R S. Seedling growth in conifers and angiosperms: impacts of contrasting xylem structure[J]. Aust J Bot, 2005, 53(8): 749-755. DOI: 10.1071/BT05049.
[14]尹秋龙. 黄土高原木本植物叶经济性状和水力性状研究[D]. 西安: 西北大学, 2019. YIN Q L. A study on the leaf economic traits and hydraulic traits of woody plants on the Loess Plateau[D]. Xi’an: Northwest University, 2019.
[15]OHTSUKA A, SACK L, TANEDA H. Bundle sheath lignification mediates the linkage of leaf hydraulics and venation[J]. Plant Cell Environ, 2018, 41(2): 342-353. DOI: 10.1111/pce.13087.
[16]MCGILL B J, ENQUIST B J, WEIHER E, et al. Rebuilding community ecology from functional traits[J]. Trends Ecol Evol, 2006, 21(4): 178-185. DOI: 10.1016/j.tree.2006.02.002.
[17]KATTGE J, D’IAZ S, LAVOREL S, et al. TRY: a global database of plant traits[J]. Glob Change Biol, 2011, 17(9): 2905-2935. DOI: 10.1111/j.1365-2486.2011.02451.x.
[18]LIU B H, XU M, HENDERSON M, et al. Taking China’s temperature: daily range, warming trends, and regional variations, 1955-2000[J]. J Climate, 2004, 17(22): 4453-4462. DOI: 10.1175/3230.1.
[19]ZHAI P M, ZHANG X B, WAN H, et al. Trends in total precipitation and frequency of daily precipitation extremes over China[J]. J Climate, 2005, 18(7): 1096-1108. DOI: 10.1175/JCLI-3318.1.
[20]TYREE M T, EWERS F W. The hydraulic architecture of trees and other woody plants[J]. New Phytol, 1991, 119(3): 345-360. DOI: 10.1111/j.1469-8137.1991.tb00035.x.
[21]NARDINIA, SALLEO S, RAIMONDO F. Changes in leaf hydraulic conductance correlate with leaf vein embolism inCercissi-liquastrumL.[J]. Trees-Struct Funct, 2003, 17(6): 529-534. DOI: 10.1007/s00468-003-0265-z.
[22]YANG S, TYREE M T. Hydraulic architecture ofAcersaccharumandA.rubrum: comparison of branches to whole trees and the contribution of leaves to hydraulic resistance[J]. J Exp Bot, 1994, 45(2): 179-186. DOI: 10.1093/jxb/45.2.179.
[23]TYREE M T, SINCLAIR B, LU P, et al. Whole shoot hydraulic resistance inQuercusspecies measured with a new high-pressure flowmeter[J]. Ann For Sci, 1993, 50(5): 417-423. DOI: 10.1051/forest:19930501.
[24]BECKER P, TYREE M T, TSUDA M. Hydraulic conductances of angiosperms versus conifers: similar transport sufficiency at the whole-plant level[J]. Tree Physiol, 1999, 19(7): 445-452. DOI: 10.1093/treephys/19.7.445.
[25]SCOFFONI C, ALBUQUERQUE C, BRODERSEN C R, et al. Leaf vein xylem conduit diameter influences susceptibility to embolism and hydraulic decline[J]. New Phytol, 2016, 213(3): 1076-1092. DOI: 10.1111/nph.14256.
[26]SALLEO S, RAIMONDO F, TRIFILP, et al. Axial-to-radial water permeability of leaf major veins: a possible determinant of the impact of vein embolism on leaf hydraulics?[J]. Plant Cell Environ, 2003, 26(10): 1749-1758. DOI: 10.1046/j.1365-3040.2003.01092.x.
[27]COCHARD H, NARDINI A, COLL L. Hydraulic architecture of leaf blades: where is the main resistance?[J]. Plant Cell Environ, 2004, 27(10): 1257-1267. DOI: 10.1111/j.1365-3040.2004.01233.x.
[28]杨金艳, 范晶. 红松光合特性对CO2浓度升高的响应[J]. 东北林业大学学报, 2004, 32(6): 16-18. YANG J Y, FAN J. Photosynthetic characteristics responses ofPinuskoraiensisto elevated carbon dioxide concentration[J]. J Northeast For Univ, 2004, 32(6): 16-18. DOI: 10.3969/j.issn.1000-5382.2004.06.006.
[29]韩士杰, 周玉梅, 王琛瑞, 等. 红松幼苗对CO2浓度升高的生理生态反应[J]. 应用生态学报, 2001, 12(1): 27-30. HAN S J, ZHOU Y M, WANG C R, et al. Ecophysiological response ofPinuskoraiensisseedlings to elevated CO2[J]. Chin J Appl Ecol, 2001, 12(1): 27-30. DOI: 10.1007/s11769-001-0027-z.
[30]杨柳, 孙慧珍. 兴安落叶松水分利用对策[J]. 林业科学, 2016, 52(6): 149-156. YANG L, SUN H Z. Analysis of water management strategy forLarixgmelinii[J]. Sci Silvae Sin, 2016, 52(6): 149-156. DOI: 10.11707/j.1001-7488.20160618.
[31]敖红, 张羽. 亚硫酸钠和亚硫酸氢钠混合液对2种云杉某些生理指标影响的比较[J]. 植物生理学通讯, 2007, 43(2): 259-263. AO H, ZHANG Y. Comparison on effects of mixed li-quid of Na2SO3and NaHSO3on some physiological indexes of two spruces[J]. Plant Physiol Commun, 2007, 43(2): 259-263. DOI:10.13592/j.cnki.ppj.2007.02.011.
[32]段瑞兵, 孙慧珍. 确定P-V曲线中质壁分离点的方法比较[J]. 南京林业大学学报(自然科学版), 2016, 40(4): 89-94. DUAN R B, SUN H Z. Comparison of different methods for determining the turgor loss point in pressure-volume curves[J]. J Nanjing For Univ(Nat Sci), 2016, 40(4): 89-94. DOI: 10.3969/j.issn.1000-2006.2016.04.014.
[33]曾俊, 孙慧珍. 超声发射特征归类识别木质部栓塞信息[J]. 南京林业大学学报(自然科学版), 2018, 42(1): 89-97. ZENG J, SUN H Z. Classification of ultrasonic acoustic emissions features on determining embolism-related signals[J]. J Nanjing For Univ (Nat Sci Ed), 2018, 42(1): 89-97. DOI: 10.3969/j.issn.1000-2006.201703030.
[34]殷笑寒, 郝广友. 长白山阔叶树种木质部环孔和散孔结构特征的分化导致其水力学性状的显著差异[J]. 应用生态学报, 2018, 29(2): 352-360. YIN X H, HAO G Y. Divergence between ring-and diffuse-porous wood types in broadleaf trees of Changbai Mountains results in substantial differences in hydraulic traits[J]. Chin J Appl Ecol, 2018, 29(2): 352-360. DOI: 10.13287/j.1001-9332.201802.035.
[35]SACK L, COWAN P D, JAIKUMAR N, et al. The ‘hydrology’ of leaves: co-ordination of structure and function in temperate woody species[J]. Plant Cell Environ, 2003, 26(8): 1343-1356. DOI: 10.1046/j.0016-8025.2003.01058.x.
[36]ZWIENIECKI M A, BRODRIBB T J, HOLBROOK N M. Hydraulic design of leaves: insights from rehydration kinetics[J]. Plant Cell Environ, 2007, 30(8): 910-921. DOI: 10.1111/j.1365-3040.2007.001681.x.
[37]NARDINI A, LUGLIO J. Leaf hydraulic capacity and drought vulnerability: possible trade-offs and correlations with climate across three major biomes[J]. Funct Ecol, 2014, 28(4): 810-818. DOI: 10.1111/1365-2435.12246.
[38]WIKBERG J, ÖGREN E. Interrelationships between water use and growth traits in biomass-producing willows[J]. Trees-Struct Funct, 2004, 18(1): 70-76. DOI: 10.1007/s00468-003-0282-y.
[39]NARDINI A. Are sclerophylls and malacophylls hydraulically different?[J]. Biol Plantarum, 2001, 44(2): 239-245. DOI: 10.1023/A:1010251425995.
[40]FICHOT R, CHAMAILLARD S, DEPARDIEU C, et al. Hydraulic efficiency and coordination with xylem resistance to cavitation, leaf function, and growth performance among eight unrelatedPo-pulusdeltoides×Populusnigrahybrids[J]. J Exp Bot, 2011, 62(6): 2093-2106. DOI: 10.1093/jxb/erq415.

