无患子不同器官中的总皂苷和总黄酮含量
徐圆圆,周思维,陈 仲,赵国春,刘济铭,王立宪,王 昕,贾黎明*,张端光
(1. 北京林业大学林学院,省部共建森林培育与保护教育部重点实验室,国家能源非粮生物质原料研发中心,北京 100083;2. 福建源华林业生物科技有限公司,福建 建宁 354500)
植物的活性成分主要集中在部分组织器官中[1-4],这些器官是人们采收和利用的主要部位,而植物其他器官通常会被丢弃,这无疑造成了资源的浪费。对植物不同器官中活性成分的分布和积累进行系统研究,可以帮助人们充分利用植物资源。近年来,科研工作者已对牛膝(Achyranthusbidentata)[5]、三七(Panaxnotoginseng)[6]、远志(Polygalatenuifolia)[7]中的皂苷和北柴胡(Bupleurumchinense)[8]、青钱柳(Cyclocaryapaliurus)[4]、光果甘草(Glycyrrhizaglabra)[9]、沙棘(Hippophaerhamnoides)[10]中的黄酮在其体内各器官中的分布进行了研究。此外,研究还发现植物的活性成分在不同器官间或不同活性物质间可能存在着某些联系,如三花龙胆(Gentianatriflora)中的龙胆苦苷和可溶性糖含量呈负相关[11];黄秋葵(Abelmoschusesculentus)中的花青素和总黄酮含量间表现出极显著正相关关系[12],而三七紫、绿茎植株不同营养器官及其总皂苷和总花色苷的含量间也具有一定的相关性[6]。
无患子(Sapindusmukorossi)为无患子科(Sapin-daceae)无患子属(Sapindus)落叶乔木,主要分布于我国东部、南部至西南部及日本、朝鲜、中南半岛和印度等地[13-14],是我国传统的洗护用植物和药用植物,其根、树皮、叶、果皮、种仁等均可入药,具有清热、祛痰、消积、杀虫等功效[15-16]。无患子的主要活性成分是三萜皂苷,主要存在于果皮中(4.14%~27.04%)[17-19];此外,研究发现无患子根、花等器官中也含有三萜皂苷[20-21]。除三萜皂苷外,Zikova等[22]和Shah等[23]还从无患子的叶和树皮中提取到了黄酮类化合物。目前,对无患子的主要利用部位为果实,人们对其他器官的研究和利用极少,而且有关无患子皂苷和黄酮在不同器官中的含量及其相关性方面的研究鲜见报道。鉴于此,本研究对无患子叶、花、果、枝、根中的总皂苷和总黄酮含量进行测定,揭示总皂苷和总黄酮在植株中的分布情况及其在叶中的动态积累规律,并探讨其在不同器官间的相关关系,以期为无患子的综合高效利用提供参考。
1 材料与方法
1.1 试验地概况
试验地位于福建省建宁县源华林业生物科技有限公司的无患子种植园(116°52′E, 26°49′N),海拔300 m。该地区属亚热带海洋性季风气候,同时兼有大陆性山地气候的特点,年平均日照时长1 721 h,3—11月(生长季)降雨量1 765 mm,年均气温17.0 ℃,年最低气温-1.0 ℃;土壤为砂质黏壤土,土壤肥力中等,pH 5.1。该种植园采用实生苗造林,树龄10 a,林分平均树高6.0 m,平均胸径12.5 cm,单株平均年产量20 kg。
1.2 植物材料
于2019年4—11月进行试验材料采集。采用随机区组设计,单株小区,3次重复。在林分中选取3株树体相近、生长健康、结果量稳定的无患子优树进行采样。分别于展叶期(4月30日,L1)、花蕾期(5月11日,L2)、盛花期(6月2日,L3)、初果期(7月8日,L4)、子叶生长期(8月1日,L5)、果实膨大期(9月5日,L6)、果实转色期(10月8日,L7)、果实成熟期(11月6日,L8)等8个生长关键时期采集叶片;于花蕾期、盛花期分别采集花苞(F1)和花朵(F2);于果实成熟期采集果实[分解为果皮(P)、种皮(SC)、种仁(SK)]、枝(当年生枝,B)和根(须根,R)。叶、花、果实和枝样品从每棵树树冠外围中上部的东、南、西、北4个方向上随机摘取;根样品从距离树干50~100 cm的东、南、西、北4个方向上随机挖取;将1棵树上采集的样品混合,作为1个生物学重复。样品采集后,立即带回实验室,用蒸馏水清洗干净后,擦干,装入信封置于烘箱中,40 ℃下烘至质量恒定,然后使用球磨仪粉碎,备用。
1.3 相关指标的测定
1.3.1 主要仪器、试剂与对照品
Lambda 35紫外可见分光光度计(美国Perkin Elmer公司);NB5200型超声波仪(郑州南北仪器设备有限公司);Soxtec 8000索氏提取仪(丹麦Foss公司);MM400球磨仪(德国Retsch公司);Hei-VAP Precision旋转蒸发仪(德国Heidolph公司)。试剂和药品有甲醇、乙醇、正丁醇、冰醋酸、乙酸乙酯、石油醚、高氯酸、浓盐酸、香草醛、NaNO2、Al(NO3)3、NaOH等,均为分析纯,购自现代东方(北京)科技发展有限公司;对照品齐墩果酸(纯度≥98%)、芦丁(纯度≥98%)购自上海源叶生物科技有限公司。
1.3.2 总皂苷含量的测定
总皂苷含量采用香草醛-高氯酸比色法进行测定[24]。准确称取400 mg样品,置于索氏提取器中,加入60 mL石油醚,于105 ℃下提取1.5 h,弃去石油醚,待石油醚挥干,加入90 mL 95%(体积分数)乙醇,于130 ℃下提取4.5 h。提取物使用蒸馏水进行溶解,经水饱和正丁醇萃取、挥干;甲醇溶解后,加入35%(体积分数)盐酸置于沸水浴回流酸水解2 h,而后将液体挥干;蒸馏水溶解,乙酸乙酯萃取,挥干;使用甲醇定容至10 mL,稀释10倍后,进行皂苷含量测定。取0.4 mL待测液于试管中,沸水浴挥干,依次加入0.2 mL 5%香草醛-冰醋酸溶液、0.8 mL高氯酸,充分摇匀后于70 ℃水浴加热15 min,冰浴2 min,然后加入5 mL冰醋酸,摇匀后,测定547 nm处吸光度值,每个样品重复3次。以齐墩果酸对照品溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程:
y=9.729 8x+0.053 5,R2=0.999。
总皂苷质量浓度在0~1.4 mg/mL时线性关系良好。总皂苷含量(质量分数)采用以下公式进行计算:

式中:m为所取样品质量,mg;m1为根据标准曲线计算出待测液中的皂苷质量,mg;n为稀释倍数;2.8为无患子中齐墩果烷型皂苷平均分子质量与齐墩果酸分子质量之比。
1.3.3 总黄酮含量的测定
总黄酮含量采用分光光度计法进行测定[25]。准确称取200 mg样品,置于三角瓶中,加入5 mL 75%(体积分数)乙醇,超声波提取30 min,以4 000 r/min离心20 min,弃去残渣,取上清液用75%乙醇定容至10 mL,每个样品重复3次。取1 mL待测液于试管中,加入0.3 mL 5%(质量分数)NaNO2溶液,摇匀后静置6 min;再加入0.3 mL 10%(质量分数)Al(NO3)3溶液,混匀后静置6 min;再往其中加入4.0 mL 4%(质量分数)NaOH溶液、4.4 mL 75%乙醇,使最终体积为10 mL,混匀后静置12 min,然后测定510 nm处吸光度值。以芦丁对照品溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到回归方程:
y=1.141 4x+0.098 9,R2=0.999。
总皂苷质量浓度在0~0.6 mg/mL时线性关系良好。总黄酮含量(质量分数)采用以下公式进行计算:

式中:m为所取样品质量,mg;m2为根据标准曲线计算出待测液中的黄酮质量,mg;V为样品提取液测定用体积,mL;V1为样品提取液总体积,mL。
1.4 数据分析
采用SPSS 25.0软件进行单因素方差分析、Pearson相关分析和一元线性回归分析;实验数据若不服从正态分布,则进行平方根反正弦转换后再执行相应的数据分析。采用Origin 2017 SR2软件进行绘图。
2 结果与分析
2.1 无患子不同器官中总皂苷和总黄酮含量的分布
对无患子不同器官中的总皂苷和总黄酮含量进行了测定,结果见图1。

LAV. 8个时期叶总皂苷或总黄酮含量的平均值the average content of total saponins or total flavonoids in leaves of eight periods;F1.花苞bud;F2.花朵flower;B.枝branches;R.根root;P.果皮pericarp;SC.种皮testa;SK.种仁kemel. 不同小写字母表示在0.05水平上差异显著。下同。Different lowercase letters indicate significant differences at the level of 0.05. The same below.
结果表明,不同器官中总皂苷和总黄酮含量的分布不同,叶(8个时期叶中相应物质含量的均值)、花、枝、根、果皮等器官中的总皂苷含量(0.98%~13.26%)均显著高于总黄酮含量(0.31%~1.74%),且在种皮和种仁中未检测到黄酮(图1)。果皮中的总皂苷含量最高(13.26%),显著高于其他器官(P<0.05);其次为花苞(6.21%)和花朵(5.68%),花苞与花朵总皂苷含量间差异未达到显著水平(P>0.05);叶(4.11%,8个时期平均值)和根(3.88%)中的总皂苷含量相差不大(P>0.05),但均显著高于枝(P<0.05);种皮的总皂苷含量最低(0.98%)。各器官中总黄酮含量主要表现为:叶(1.74%,8个时期平均值)>花苞(0.88%)>花朵(0.74%)>根(0.53%)>枝(0.44%)>果皮(0.31%),叶中的总黄酮含量分别是花苞、花朵、枝、根、果皮总黄酮含量的1.99、2.35、3.92、3.31和5.65倍,且花苞与花朵间总黄酮含量间差异不显著(P>0.05)。
2.2 无患子叶中总皂苷和总黄酮的积累规律
无患子叶片中总皂苷和总黄酮含量变化趋势存在一定的差异,各时期叶中的总皂苷含量均比总黄酮含量高(图2)。随着生长时间的延长,叶中总皂苷含量总体上呈逐渐升高趋势,L8时期达到最高(5.35%),显著高于其他7个时期(P<0.05);L1—L5时期,总皂苷含量缓慢升高,L5(4.49%)—L7(4.13%)时期有小幅度下降,但L3—L7时期的总皂苷含量间差异均未达到显著水平(P>0.05);而L7—L8时期,总皂苷含量显著升高(P<0.05)。另一方面,叶中总黄酮含量为1.18%~2.42%,在整个年生长周期内呈“升高—降低—升高—降低—升高”趋势,3次积累高峰分别出现在L2(1.93%)、L6(2.42%)和L8(2.15%)时期,其中L6与L8两个时期间的总黄酮含量相差不大(P>0.05)。

图2 无患子叶中总皂苷和总黄酮含量的积累规律
2.3 无患子不同器官间总皂苷和总黄酮的相关性特征
对花蕾期的花及果实成熟期的叶、枝、根、果皮、种皮、种仁等器官间的总皂苷或总黄酮含量进行相关性分析,结果表明不同器官总皂苷和总黄酮含量分布呈现出不同的相关性特征(表1)。
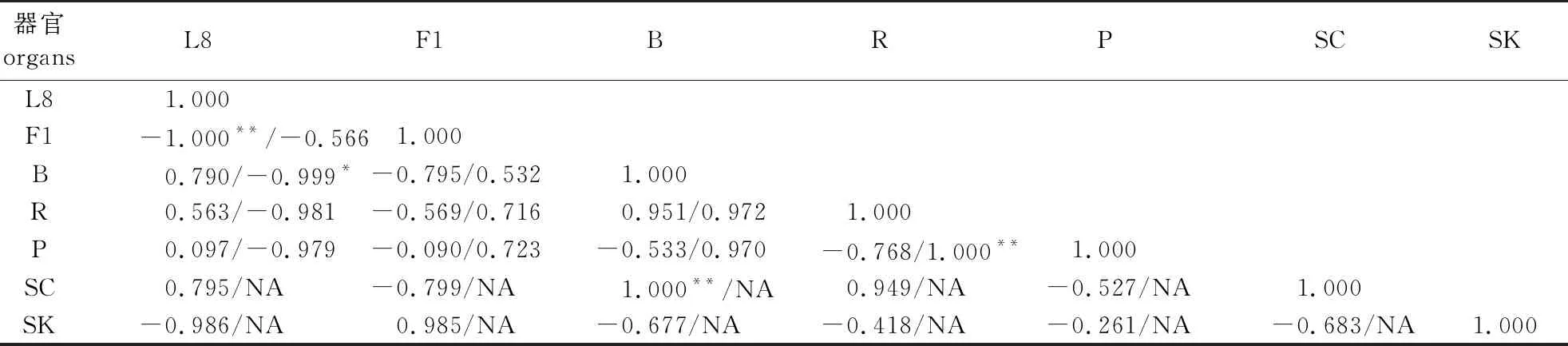
表1 不同器官间总皂苷和总黄酮含量的Pearson相关系数
由表1可见,叶和花的总皂苷含量间呈极显著负相关,枝与种皮的总皂苷含量间呈极显著正相关关系;叶和枝间的总黄酮含量呈显著负相关,果皮和根间的总黄酮含量呈极显著正相关关系。
2.4 无患子中总皂苷和总黄酮间的相关性特征
以总黄酮含量为因变量,总皂苷含量为自变量,采用一元线性回归分析无患子中总皂苷和总黄酮含量间的关系,结果如图3所示,总皂苷(x)和总黄酮(y)间的线性关系为:

图3 总皂苷含量与总黄酮含量之间的相关性
y=-0.093x+1.755(R2=0.107,P=0.024)。
可见,无患子总皂苷含量与总黄酮含量间呈现出一定的负相关关系。
3 讨 论
皂苷和黄酮类化合物是植物中典型的次级代谢物,广泛存在于高等植物中。皂苷参与植物的通讯、防御和感觉调控[26];黄酮具有保护植物免受各类生物或非生物胁迫伤害的作用[25]。然而,这些化合物在不同植物器官中的具体形态和分布存在很大差异[10]。本研究表明,无患子不同器官中总皂苷和总黄酮含量分布情况不同,皂苷分布于叶、花、枝、根、果皮、种皮、种仁等器官中,而黄酮仅在叶、花、枝、根、果皮中被检测到,同时各器官中总皂苷含量均显著高于总黄酮,说明皂苷是无患子各器官的主要次生代谢物。另外,果皮中的总皂苷含量最高,其次为花和叶;总黄酮含量由大到小顺序为:叶、花、根、枝、果皮,这表明无患子中除了果皮富含皂苷,花和叶中也积累了较高水平的皂苷和黄酮。皂苷和黄酮在无患子各器官中的不均衡分布可能与其执行不同的功能有关,叶和根等营养器官及花和果等生殖器官中较高含量的皂苷,可以有效抵御病虫害,以保证正常的生长和繁殖[27-28];同时,叶片中较高含量的总黄酮,可以保护植物免受昆虫和病原体侵害[29],还能有效减少UV-B辐射对叶片造成的伤害[30-31]。
无患子叶中的总皂苷和总黄酮含量在整个生长季变化较为明显,且呈现出不同的变化趋势。随着生长时间的延长,总皂苷含量总体上呈逐渐升高趋势,在L8时期达到最高;而总黄酮含量波动变化,3次积累高峰分别出现在L2、L6和L8时期。花蕾期(L2)叶片光合作用能力强,为次级代谢提供了更多的原料和底物,可能产生并积累了较多的黄酮类化合物[32];盛花期(L3)后无患子进入初果期,叶中总皂苷含量增加缓慢,总黄酮含量保持在较低水平,这可能与生殖生长期间大量营养物质向果实部位运转有关;在果实膨大期(L6)叶中总皂苷水平小幅度降低,而黄酮含量达到最大值,这可能是由于此时光合产物被用于合成黄酮,皂苷合成可能受到抑制或被转移到其他器官;在果实成熟期(L8)植物停止生长,光合产物被重新分配到次级代谢物合成上[32],使叶中总皂苷和总黄酮含量又显著升高。无患子叶中总皂苷和总黄酮含量呈现出一定的季节性变化规律,是其自身基因表达调控和环境影响的共同结果[33],前人在落叶松(Larixgmelinii)[32]、北柴胡[8]、黄蜀葵(Abelmoschusmanihot)[3]、牛膝[5]、三七[34]等植物的研究中也有类似结论。
无患子叶中总黄酮含量为1.18%~2.42%,与几种叶中总黄酮含量较高的树种相比,无患子叶中的总黄酮含量较银杏(2.50%~3.80%)[35]和青钱柳(4.47%~6.78%)[4]小,但与喜树叶中的总黄酮含量(0.24%~2.61%)相差不大[36],说明无患子叶中的黄酮也具有一定的利用价值。本研究结果表明,叶(果实成熟期)和花(花蕾期)的总皂苷含量间极显著负相关,枝与种皮的总皂苷含量间呈极显著正相关,叶(果实成熟期)和枝间的总黄酮含量呈显著负相关,果皮和根间的总黄酮含量呈极显著正相关,可以推测无患子不同器官间的皂苷或黄酮含量具有一定的联系。然而,皂苷和黄酮在无患子中的合成、储存和转移途径,仍有待进一步研究。此外,无患子中总皂苷含量与总黄酮含量间呈现一定的负相关关系,说明无患子中皂苷和黄酮的积累可能存在着间接竞争关系,这可能是植物中皂苷和黄酮的生物合成在原料或前体物质上存在着某些竞争导致的,例如,糖酵解产物丙酮酸氧化生成的乙酰辅酶A是三萜皂苷生物合成的原料,而糖酵解中间产物磷酸烯醇式丙酮酸是黄酮生物合成的原料[37-38]。而皂苷和黄酮等次生代谢物间的代谢关系相当复杂,相关机制还需进一步探讨。
无患子属落叶大乔木,枝叶茂盛,通常人们只采收其果实,进行加工利用。本研究结果表明无患子叶和花也含有较高含量的皂苷和黄酮,如能将其合理开发利用,可提高无患子的综合利用价值。植物的生长发育和活性成分的积累模式是帮助确定最适宜采收期的两个重要指标[39]。无患子叶片中总皂苷和总黄酮在果实成熟期(L8)均积累到较高水平,且在果实成熟后,无患子逐渐进入落叶期[40],在采收果实的时候,可以一并采收叶子,用于提取皂苷或黄酮,但如何实现其开发利用需要深入研究。蔡佳杰等[41]研发出一种无患子茶的加工方法,该茶以无患子树叶为原料进行制作,具有一定的保健作用。无患子萌芽能力强,在采集枝条或叶子后,能迅速萌生出新枝和叶,同时无患子叶多且易于采集,或可以考虑建立无患子叶用原料林,供采集嫩叶用于制茶或采集成熟叶作为提取皂苷或黄酮的原料。此外,无患子的花序属于大型圆锥花序,雌雄同株,花量大[40, 42],开花结果过多,常会造成树体养分供应不足,影响果实的正常发育,在生产上常采取疏花等措施来减少树体养分消耗。由于无患子花苞中含有较高的总皂苷和总黄酮,且花苞和花朵的总皂苷和总黄酮含量相差不大,考虑到无患子花的综合利用,建议在花蕾期进行疏花,并将采集下来的花苞进一步开发成茶或其他保健品,以用代抚,可以实现无患子多功能综合利用。
综上,无患子总皂苷和总黄酮在不同器官中的分布及其在叶中的积累规律不同,皂苷主要存在于果皮、花和叶,总黄酮主要分布在叶和花中;不同器官间的总皂苷或总黄酮含量具有一定相关性,皂苷和黄酮的积累之间可能存在着间接竞争关系;除传统的利用部位果皮,还可以合理地采收无患子的叶和花,对其进行开发利用。然而,如何有效利用无患子叶和花等器官,了解皂苷和黄酮在不同器官中的分布机制及其生物合成机制等将成为未来需要解决的科学问题。
参考文献(reference):
[1]黎阳, 张铁军, 刘素香, 等. 人参化学成分和药理研究进展[J]. 中草药, 2009, 40(1): 164-166. LI Y, ZHANG T J, LIU S X, et al. Advances in chemical constituents and pharmacology of Ginseng [J]. Chin Tradit Herb Drugs, 2009, 40(1): 164-166. DOI:10.3321/j.issn:0253-2670.2009.01.049.
[2]李行诺, 翟文丰, 周孟宇, 等. 黄柏化学成分研究[J]. 浙江工业大学学报, 2012, 40(3): 244-246. LI X N, ZHAI W F, ZHOU M Y, et al. Chemical constituents fromPhellodendronchinense[J]. Zhejiang Univ Technol, 2012, 40(3): 244-246. DOI:10.3969/j.issn.1006-4303.2012.03.002.
[3]PAN X, DU L, TAO J,et al. Dynamic changes of flavonoids inAbelmoschusmanihotdifferent organs at different growth periods by UPLC-MS/MS[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1059: 21-26. DOI:10.1016/j.jchromb.2017.05.020.
[4]米丽雪, 上官新晨, 施利仙, 等. 青钱柳营养器官总黄酮含量测定及分布规律研究[J]. 江西农业大学学报(自然科学版), 2009, 31(5): 896-900. MI L X, SHANGGUAN X C, SHI L X, et al. Studies on the determination and distributon of total flavono ids ofCyclocaryapaliurusvegetative organs[J]. Acta Agric Univ Jiangxiensis (Nat Sci Ed), 2009, 31(5): 896-900. DOI:10.3969/j.issn.1000-2286.2009.05.024.
[5]LI J, HU Z. Accumulation and dynamic trends of triterpenoid saponin in vegetative organs ofAchyranthusbidentata[J]. J Integr Plant Biol, 2009, 51(2): 122-129. DOI:10.1111/j.1744-7909.2008.00764.x.
[6]赵昶灵, 陈中坚, 余育启, 等. 三七紫、绿茎植株营养器官在不同生长阶段的花色苷和皂苷含量及其相关性[J]. 中药材, 2016, 39(9): 1923-1929. ZHAO C L, CHEN Z J, YU Y Q, et al. Contents and the correlations of the total anthocyanins and sa-ponins of the vegetative organs ofPanaxnotoginsengwith purple and green aerial stems at different growth stages[J]. J Chin Med Mater, 2016, 39(9): 1923-1929. DOI:10.13863/j.issn1001-4454.2016.09.001.
[7]高玲玲, 刘文哲, 张兴旺. 皂苷元在远志不同部位的含量分布及其动态变化研究[J]. 分子植物育种, 2019, 17(15): 5131-5135. GAO L L, LIU W Z, ZHANG X W. Study on the content distribution and dynamic changes of senegenin in different parts ofPolygalatenuifolia[J]. Molecular Plant Breeding, 2019, 17(15): 5131-5135.
[8]谭玲玲, 蔡霞, 胡正海. 北柴胡各器官中总黄酮动态变化研究[J]. 中草药, 2008(2): 286-287. TAN L L, CAI X, HU Z H, et al. Dynamic changes of total flavonoids in organs ofBupleurumchinense[J]. Chin Tradit Herb Drugs, 2008(2): 286-287.
[9]李娜, 陆嘉惠, 秦忠立, 等. 光果甘草营养器官不同季节总黄酮消长规律的研究[J]. 西北植物学报, 2012, 32(1): 162-165. LI N, LU J H, QIN Z L, et al. Changes of total flavonoids content in vegetative organs ofGlycyrrhizaglabraL.in different seasons[J]. Acta Bot Boreali-Occidentalia Sin, 2012, 32(1): 162-165. DOI:10.3969/j.issn.1000-4025.2012.01.026.
[10]蔡爽,阮成江,杜维,等.沙棘叶片、果肉和种子中黄酮类成分的差异[J].植物资源与环境学报,2019,28(4):58-67.CAI S,RUAN C J,DU W,et al.Difference in flavonoid constituents in leaf,pulp,and seed ofHippophaerhamnoides[J].J Plant Resour Environ,2019,28(4):58-67.DOI:10.3969/j.issn.1674-7895.2019.04.07.
[11]张兰兰, 张欣欣, 孙阎. 三花龙胆不同器官可溶性糖和龙胆苦苷含量的动态研究[J]. 中国农学通报, 2017, 33(9): 78-83. ZHANG L L, ZHANG X X, SUN Y. Dynamic study on soluble sugar and gentiopicroside content in different organs ofGentianatrifloraPall.[J]. Chin Agric Sci Bull, 2017, 33(9): 78-83.
[12]练冬梅, 姚运法, 赖正锋, 等. 不同黄秋葵花的花青素和总黄酮含量分析[J]. 热带农业科学, 2018, 38(9): 73-75. LIAN D M, YAO Y F, LAI Z F, et al. Determination of the contents of anthocyanin and total flavonoids in different okra flowers[J]. Chin J Trop Agric, 2018, 38(9): 73-75. DOI:10.12008/j.issn.1009-2196.2018.09.015.
[13]中国植物志编辑委员会. 中国植物志: 第47卷 第1分册[M]. 北京: 科学出版社, 1985.
[14]刘济铭, 孙操稳, 何秋阳, 等. 国内外无患子属种质资源研究进展[J]. 世界林业研究, 2017, 30(6): 12-18. LIU J M, SUN C W, HE Q Y, et al. Research progress inSapindusL. germplasm resources[J]. World For Res, 2017, 30(6): 12-18. DOI:10.13348/j.cnki.sjlyyj.2017.0071.y.
[15]李时珍. 本草纲目[M]. 北京: 人民卫生出版社, 1975.
[16]谢媛媛. 毛瓣无患子果皮、怀菊和石榴花生物活性成分的研究[D]. 沈阳: 沈阳药科大学, 2009. XIE Y Y.Studies on bio-active constituents of three natural medicines-pericarps ofSapindusrarak,flowers ofChrysanthemummorifoliumRamat.‘Huaiju’ cv Nov andPunicagranatum[D].Shenyang:Shenyang Pharmaceutical University,2009.
[17]刘济铭, 陈仲, 孙操稳, 等. 无患子属种质资源种实性状变异及综合评价[J]. 林业科学, 2019, 55(6): 44-54. LIU J M, CHEN Z, SUN C W, et al. Variation in fruit and seed properties and comprehensive assessment of germplasm resources of the genusSapindus[J]. Sci Silvae Sin, 2019, 55(6): 44-54. DOI:10.11707/j.1001-7488.20190606.
[18]郑玉琳,刘济铭,史双龙,等.无患子果实成熟过程及其油脂、皂苷动态变化[J].南京林业大学学报(自然科学版),2021,45(4):76-82.ZHENG Y L, LIU J M, SHI S L, et al. Maturation process and the dynamics of oil and saponin inSapindusmukorossi[J].J Nanjing For Univ( Nat Sci Ed), 2021, 45(4) : 76-82.DOI: 10.12302/ j.issn.1000-2006.202103047.
[19]UPADHYAY A, SINGH D K. Pharmacological effects ofSapindusmukorossi[J]. Rev Inst Med Trop Sao Paulo, 2012, 54(5): 273-280. DOI:10.1590/s0036-46652012000500007.
[20]NI W, HUA Y, LIU H Y,et al. Tirucallane-type triterpenoid sapo-nins from the roots ofSapindusmukorossi[J]. Chem Pharm Bull, 2006, 54(10): 1443-1446. DOI:10.1248/cpb.54.1443.
[21]WANG Y H, CAO X L, QIN B Y, et al. Four new tirucallane-type triterpenoids fromSapindusmukorossiGaertn. flowers induced neurite outgrowth in PC12 cells related to insulin-like growth factor 1 receptor/phosphoinositide 3-kinase/extracellular regulated protein kinase signaling pathway[J]. Phytochem Lett, 2019, 34: 5-12. DOI:10.1016/j.phytol.2019.08.011.
[22]ZIKOVA N I, KRIVENCHUK P E. Chemical study of flavonoids from the leaves ofSapindusmukorossiGaerth[J]. FarmatsevtychnyZhurnal, 1970, 25(5): 43-45.
[23]SHAH M, PARVEEN Z, KHAN M R. Evaluation of antioxidant, anti-inflammatory, analgesic and antipyretic activities of the stem bark ofSapindusmukorossi[J]. BMC Complement Altern Med, 2017, 17(1): 526. DOI:10.1186/s12906-017-2042-3.
[24]SUN C W, WANG J W, DUAN J, et al. Association of fruit and seed traits ofSapindusmukorossigermplasm with environmental factors in Southern China[J]. Forests, 2017, 8(12): 491. DOI:10.3390/f8120491.
[25]魏伯平, 张咏梅, 曹致中. 9种豆科牧草总黄酮和总皂苷积累规律的研究[J]. 草地学报, 2012, 20(1): 88-95. WEI B P, ZHANG Y M, CAO Z Z. Accumulation patterns of total flavonoids and saponins in nine legume species[J]. Acta Agrectir Sin, 2012, 20(1): 88-95. DOI:10.11733/j.issn.1007-0435.2012.01.015.
[26]CHUNGI M, MILLER D A. Natural herbicide potential of alfalfa residue on selected weed species[J]. Agron J, 1995, 87(5): 920-925. DOI:10.2134/agronj1995.00021962008700050024x.
[27]SAHA S, WALIA S, KUMAR J,et al. Screening for feeding deterrent and insect growth regulatory activity of triterpenic saponins fromDiploknemabutyraceaandSapindusmukorossi[J]. J Agric Food Chem, 2010, 58(1): 434-440. DOI:10.1021/jf902439m.
[28]EDDAYA T, BOUGHDAD A, SIBILLE E,et al. Biological activity ofSapindusmukorossiGaerten (Sapindaceae) aqueous extract againstThysanoplusiaorichalcea(Lepidoptera: Noctuidae)[J]. Ind Crop Prod, 2013, 50: 325-332. DOI:10.1016/j.indcrop.2013.07.045.
[29]PILBEAM D J. The flavonoids: advances in research[J]. FEBS Lett, 1983,158(1):192.DOI:10.1016/0014-5793(83)80717-0.
[30]AMBASHT N K, AGRAWAL M. Physiological responses of field growthZeamayL. plants to enhanced UV-B radiation[J]. Biotronics, 1995, 24(2): 15-23.
[31]MCCLURE J W. Physiology and functions of flavonoids[M].Boston MA:Springer US,1975:970-1055.DOI:10.1007/978-1-4899-2909-9_18.
[32]WANG W J, LI X Y, ZU Y G. Dynamic feature of flavonoids content in different organs of larch (Larixgmelinii)[J]. J For Res, 2005, 16(2): 89-92. DOI:10.1007/BF02857896.
[33]TOH D F, NEW L S, KOH H L,et al. Ultra-high performance liquid chromatography/time-of-flight mass spectrometry (UHPLC/TOFMS) for time-dependent profiling of raw and steamedPanaxnotoginseng[J]. J Pharm Biomed Anal, 2010, 52(1): 43-50. DOI:10.1016/j.jpba.2009.12.005.
[34]XIA P G, GUO H B, RU M, et al. Accumulation of saponins inPanaxnotoginsengduring its growing seasons[J]. Ind Crop Prod, 2017, 104: 287-292. DOI:10.1016/j.indcrop.2017.04.045.
[35]庄向平, 虞杏英, 杨更生, 等. 银杏叶中黄酮含量的测定和提取方法[J]. 中草药, 1992, 23(3): 122-124, 168. ZHUANG X P, YU X Y, YANG G S, et al. Determination of total flavonoids in the leaves of Ginkgo (Ginkgobilcba) and studies on its extraction process [J]. Chin Tradit Herb Drugs, 1992, 23(3): 122-124, 168.
[36]朱冬雪, 顾采琴, 周伯春. 喜树不同生长发育期及不同器官中黄酮含量的变化[J]. 广东林业科技, 2012, 28(1): 61-64. ZHU D X, GU C Q, ZHOU B C. Changes of flavonoid content in different organs ofCamptothecaacuminataat different growth stages[J]. Guangdong For Sci Technol, 2012, 28(1): 61-64.
[37]ZHAO Y J, LI C. Biosynthesis of plant triterpenoid saponins in microbial cell factories[J].J Agric Food Chem, 2018, 66(46): 12155-12165. DOI:10.1021/acs.jafc.8b04657.
[38]FALCONE F M L, RIUS S P, CASATI P. Flavonoids: biosynthesis, biological functions, and biotechnological applications[J]. Front Plant Sci, 2012, 3: 222-222. DOI:10.3389/fpls.2012.00222.
[39]韩建萍, 梁宗锁, 王敬民. 矿质元素与根类中草药根系生长发育及有效成分累积的关系[J]. 植物生理学通讯, 2003, 39(1): 78-82. HAN J P, LIANG Z S, WANG J M. The relationship between mineral element and the root growth and accumulation of effective ingredient in root of traditional herbs[J]. Plant Physiol Commun, 2003, 39 (1): 78-82. DOI:10.13592/j.cnki.ppj.2003.01.026.
[40]ZHAO G C, GAO Y H, GAO S L, et al. The phenological growth stages ofSapindusmukorossiaccording to BBCH scale[J]. Forests, 2019, 10(6): 462. DOI:10.3390/f10060462.
[41]蔡佳杰, 曹泳, 蔡邦红. 一种无患子茶的加工方法: CN104413175A[P]. 2015-03-18.
[42]高媛, 贾黎明, 苏淑钗, 等. 无患子物候及开花结果特性[J]. 东北林业大学学报, 2015, 43(6): 34-40, 123. GAO Y, JIA L M, SU S C, et al. Phenology and blossom-fruiting characteristics ofSapindusmukorossi[J]. J Northeast For Univ, 2015, 43(6): 34-40, 123. DOI:10.13759/j.cnki.dlxb.20150522.062.

