胸腔镜与开胸手术方式对食管癌患者围术期单肺通气时Qs/Qt和炎性因子及淋巴结清扫的影响
秦恺
(江苏省海安市人民医院心胸外科,江苏 南通 226600)
食管癌是常见的消化道肿瘤疾病,每年全世界约有30万人死于食管癌,我国是食管癌发病率较高国家之一,每年约有15万人死于食管癌,且经临床研究发现,男性患者多于女性,且多见于年龄>40岁的中老年人群中[1-3]。经过长期的调查研究发现患食管癌的发生与患者年龄、性别、职业、生活习惯、饮食习惯、居住条件等密切相关,而这些患者最初的症状往往是事物难以下咽,进而只能食用半流质食物,最终随着病情的发展患者在饥饿和痛苦中丧失生命[4]。随着近年来食管癌疾病逐渐的年轻化、普遍化,探寻有效的治疗方式具有重要意义。目前,临床治疗食管癌的方式主要为放疗与化疗,但实际仍以手术治疗为主。开胸术与胸腔镜术是最常用的手术方式,且由于胸腔镜术创伤小、出血量少逐渐受到更多人的青睐[5]。但由于食管癌手术中需采用单肺通气模式以提供更好的视野,会影响患者的Qs/Qt[6]。基于此,本研究选取本院收治的86例食管癌手术患者作为研究对象,比较两种手术方式对患者单肺通气、炎性因子等指标的影响,现报道如下。
1 资料与方法
1.1 临床资料 选取本院2017年1月至2019年12月收治的86例进行食管癌手术治疗的患者,依据患者所选择的手术方式不同分为开胸术组(n=39)与胸腔镜术组(n=47)。开胸术组男26例,女13例;年龄40~70岁,平均年龄(62.28±9.88)岁;肿瘤直径2.3~6.1 cm,平均直径(3.49±1.04)cm;TNM分期:Ⅱa期34例,Ⅱb期5例。胸腔镜术组男32例,女15例;年龄42~74岁,平均年龄(68.25±10.67)岁;肿瘤直径2.5~6.5 cm,平均直径(3.26±1.12)cm;TNM分期:Ⅱa期38例,Ⅱb期9例。两组患者临床资料比较差异无统计学意义,具有可比性。纳入标准:所有患者均经病理学诊断确诊为食管癌;临床资料完整,依从性较高,且均签署知情同意书;本研究经本院伦理委员会审核批准。排除标准:合并其他肿瘤疾病患者;患有心肺等重要脏器功能性疾病患者;合并其他高血压、糖尿病等慢性疾病患者;凝血、造血功能障碍或近期服用过影响凝血功能药物患者;拒绝参与本研究的患者。
1.2 方法
1.2.1 开胸术组 术前对患者行全身麻醉,将其手术部位进行备皮消毒并铺设手术单与无菌洞巾。待术前准备工作完成后,行动脉穿刺置管并行双肺部机械通气。取患者右侧卧位,左侧第五肋骨后外侧位做手术创口15~20 cm,充分暴露手术视野后清除干净游离于患者胸腔段食管部位的淋巴结;待胸腔操作完成后,沿患者食管裂孔方向左侧切割8 cm左右创口,制作管状胃后行胸部吻合,待吻合完毕后留置胃肠减压管、营养管于胃肠中并缝合创口。
1.2.2 胸腔镜术组 术前,需对患者行全身麻醉,待患者意识全部丧失后铺设消毒铺单,并行动脉穿刺置管与双肺机械通气操作。患者取左侧卧位,以患者右侧腋中线第6和7肋间开长约1 cm观察孔,取患者中线第4肋骨、肩胛骨前缘第5肋骨、第8肋骨间开长约1 cm作为手术操作口,清扫干净游离与食管位纵膈淋巴结,并缝合创口。取患者平卧位,于脐部上方、剑突两侧弓内侧开0.5~1 cm切口,放置腹腔镜观察患者肺部和胸腔内部组织。再打一个3 cm左右的操作口,切断游离胃网膜左血管,胃短血管,清扫淋巴结后,扩张食管裂孔撑开患者左胸锁乳突前缘,颈部浅肌肉群以充分暴露颈部食管视野,并保护喉反神经,待病灶完整切除后彻底止血,清点纱布器械无误,待无活动出血后留置引流管,逐层缝合。
1.3 观察指标 ①单肺通气Qs/Qt。采集两组患者单肺通气在T0(开始前5 min)、T1(开始后5 min)、T2(开始后10 min)、T3(开始后30 min)、T4(开始后40 min)的动脉与静脉血,并采用血气分析仪进行分析。②临床指标:手术时间,出血量及淋巴结清除数量。③炎性因子:血清肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-8(IL-8)、丙二醛(MDA)、超氧化物歧化酶(SOD)。
1.4 统计学方法 采用SPSS 23.0统计软件进行数据分析,计量资料以“±s”表示,比较采用t检验,计数资料以[n(%)]表示,比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者单肺通气Qs/Qt比较 T0时点,两组患者Qs/Qt水平比较差异无统计学意义;T1、T2、T3、T4时点,胸腔镜组Qs/Qt水平明显高于开胸术组(P<0.05),见表1。
表1 两组单肺通气Qs/Qt比较(±s)Table 1 Comparison of Qs/Qt of one-lung ventilation between the two groups(±s)
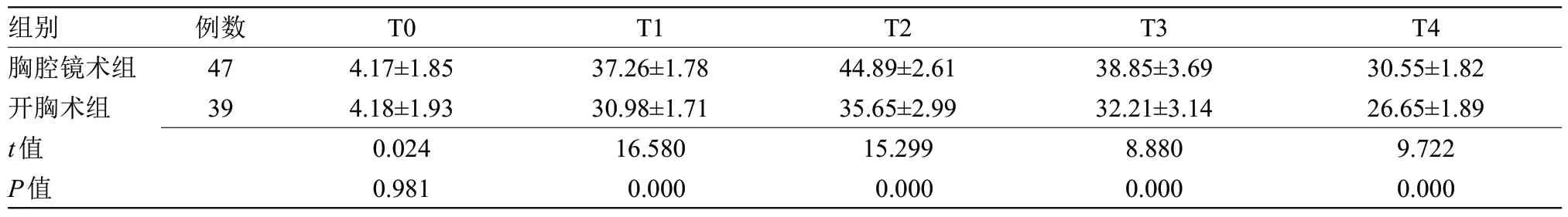
表1 两组单肺通气Qs/Qt比较(±s)Table 1 Comparison of Qs/Qt of one-lung ventilation between the two groups(±s)
组别 例数T0T1T2T3T4胸腔镜术组474.17±1.8537.26±1.7844.89±2.6138.85±3.6930.55±1.82开胸术组394.18±1.9330.98±1.7135.65±2.9932.21±3.1426.65±1.89 t值0.02416.58015.2998.8809.722 P值0.9810.0000.0000.0000.000
2.2 两组患者临床指标比较 两组患者手术时间、淋巴结清除数量比较差异无统计学意义,胸腔镜术组患者出血量明显少于开胸术组(P<0.05),见表2。
表2 两组临床指标比较(±s)Table 2 Comparison of clinical indicators between the two groups(±s)

表2 两组临床指标比较(±s)Table 2 Comparison of clinical indicators between the two groups(±s)
组别 例数 手术时间 出血量 淋巴结清除个数(min) (mL) (个)胸腔镜术组47138.52±14.64187.67±75.2112.01±3.21开胸术组39142.01±16.10353.39±81.0112.39±3.41 t值1.0529.8230.531 P值0.2960.0000.597
2.3 两组术前术后炎性因子比较 术前,两组TNF-α、IL-6、IL-8、MDA、SOD水平比较差异无统计学意义;术后,胸腔镜术组患者TNF-α、IL-6、IL-8、MDA水平均显著低于开胸术组,SOD水平明显高于开胸术组(P<0.05),见表3。
表3 两组术前术后炎性因子比较(±s)Table 3 Comparison of inflammatory factors between the two groups before and after surgery(±s)

表3 两组术前术后炎性因子比较(±s)Table 3 Comparison of inflammatory factors between the two groups before and after surgery(±s)
注:MDA,丙二醛;SOD,超氧化物歧化酶;TNF-α,肿瘤坏死因子-α;IL-6,白细胞介素-6;IL-8,白细胞介素-8
指标 时间 胸腔镜术组 开胸术组t值P值(n=47) (n=39)MDA(nmol/mL)术前3.64±0.743.63±0.870.0580.954术后5.17±1.126.41±2.193.3870.001 t值7.8147.435 P值0.0000.000 SOD(U/mL) 术前72.35±9.2173.16±9.180.4070.685术后65.53±9.0959.33±8.453.2500.002 t值3.6136.922 P值0.0000.000 TNF-α(pg/mL) 术前23.27±6.2923.04±6.310.1690.867术后37.62±11.2956.81±16.626.3480.000 t值7.61211.863 P值0.0000.000 IL-6(pg/mL) 术前12.48±3.1112.54±2.980.0910.928术后15.82±6.1520.26±7.443.0300.003 t值3.3236.015 P值0.0010.000 IL-8(pg/mL) 术前5.51±1.415.53±1.390.0660.948术后7.62±3.1212.13±4.185.7230.000 t值4.2259.357 P值0.0000.000
3 讨论
食管癌属于消化道上皮组织病变的恶性肿瘤疾病,引发组织病变原因较多,如亚硝胺等化学物,人类机体缺乏某种微量元素,人体长期遭受烟酒、热食、口腔不洁等问题困扰[7]。食管癌早期临床症状并不显著,患者仅会在吞咽硬物时出现不同程度吞咽不适感,如胸骨后烧灼感、针刺或牵拉摩擦感疼痛等,疾病进一步发展至中晚期时,临床症状逐步加重,且吞咽障碍明显加重,仅能食用半流质食物,且食道长期被黏液状唾液、痰液占据,并伴随持续性胸痛、背痛等症状,严重者水与唾液也会出现吞咽障碍[8-9]。由于食管癌早期症状并不明显,加之患者健康意识不强,极易被误认为消化道慢性疾病,进而延误治疗时机,造成终身遗憾。随着医学技术的快速发展,影像学为食管癌疾病的诊断提供科学依据,临床医师也可根据患者影像学资料制定相应的治疗方案[10]。
手术切除是食管癌治疗的重要方式之一,但因食管位置特殊手术难度较大,不易被患者接受。单肺通气的应用可为临床手术提供更清晰的视野,有效缩短手术时间,提高切除效果,避免血液进入非手术区[11]。但食管癌患者身体机能较差,合并性疾病情况较多,行单肺通气时会出现Qs/Qt水平升高现象,患者会出现低氧血症、急性缺氧性血管收缩、肺水肿、肺缺血再灌注等情况。本研究结果表明,胸腔镜术组患者Qs/Qt水平呈先上升后下降的趋势,究其原因发现胸腔镜术患者胸腔处于封闭状态,术后肺部残留气体随手术操作排出体外,但T1、T2、T3时点胸腔镜术组肺内血流量水平明显高于开胸术组(P<0.05),表明无论是开胸术还是胸腔镜术均需作好术前准备,尤其是行胸腔镜术患者。本研究结果表明,胸腔镜术组患者出血量明显少于开胸术组(P<0.05);术后,胸腔镜术组患者TNF-α、IL-6、IL-8、MDA水平均显著低于开胸术组,SOD水平明显高于开胸术组(P<0.05)。分析原因为,胸腔镜术是微创手术,无需撑开肋间,因此,其炎性因子水平、出血量均低于开胸手术患者。
综上所述,胸腔镜手术与开胸手术治疗食管癌患者均具有积极效果,但胸腔镜术在炎性反应与肺内血流量上更具有优势。

