γ-聚谷氨酸的生物合成及提取工艺
荀顺义,朱 海,刘 庆,单继军
(博瑞生物医药泰兴市有限公司,江苏泰兴 225400)
1 搅拌转速对γ-PGA合成的影响分析
搅拌转速对γ-PGA合成影响较强,会影响生物反应机制以及氧传递,因此,也称为生物合成γ-PGA以及提升产率的重要问题。国外研究发现,提高转速以及采用高纯氧,能够有效控制容量,以解决该问题,提升γ-PGA的生产速率。高转速对于发酵体系传质来说具有重要作用,但较高转速也会形成剪切力作用,对培养群体细胞产生不利影响。之外,搅拌转速较大,还会形成大量泡沫,使发酵体积增加,对于发酵来说是不利的,因此,研究非流动型流体发酵参数,利于优化发酵过程,提高γ-PGA产率。本研究在5L发酵罐中分析了不同转速对于分批发酵γ-PGA的影响,具体如下。
1.1 实验材料
在本研究中所使用的实验仪器,包括电子天平、5升发酵罐、恒温摇床、紫外检测器、生物传感器、电热恒温干燥箱、精密pH计、凝胶渗透色谱柱等。所使用的试剂包括硫酸镁、硫酸铵、葡萄糖、蛋白胨、牛肉膏、磷酸氢二钾、谷氨酸钠等。实验菌种为Bacillus snbtilis NX2,使用平板基类型,包括斜面基、平板培养基、种子培养基,发酵培养基。
1.2 研究方法
在具体培养中,接菌于斜面和平板培养基中,将其置于32℃,24h培养。接一环菌将其置于50mL种子培养基的三角瓶中,转速为220r/min,置于32.5℃,培养15h。以5%接种量将种子接种液置于3L发酵培养基的发酵罐中,通气量为0.8vv m, 温度设置为32.5℃,通过控制转速进行发酵。测定细胞生长,包括浊度及细胞干重。测定发酵液中葡萄糖以及谷氨酸浓度,可使用生物传感器进行测定。
2 研究结果
搅拌转速对Bsubtilis NX2细胞生长产生的影响。使用不同转速包括300、400、600、800、1 000r/min,分析在发酵时细胞生长情况,结果发现,转速会影响细胞生长,提高搅拌转速,会增加菌体生长速率,达到菌体浓度最大值,使时间有一定程度缩短。当转速为1 000r/min时,在24h生物量达到最高值。当转速为300r/min时,生物量在68h可达到最高值,较大搅拌转速利于发酵液传质,以及细胞对底物的消耗。由于γ-PGA是在细胞膜中合成,并将其分泌到胞外的,是细胞荚膜的重要成分。荚膜中产物高浓度会影响营养物质进入细胞,进而影响细胞生长代谢、产物合成。搅拌转速越高时,会使荚膜更快散落,降低荚膜对细胞的营养物质,以及氧传递阻碍,因此,根据实验研究发现,搅拌转速越高,此时菌体的代谢周期会越短,会促进菌体生长。当转速为1 000r/min时,此时生物量可达到最高值,浓度为7.72g/L。分别比较不同搅拌转速下细胞生长曲线以及残余葡萄糖曲线结构发现,细胞生长与葡萄糖浓度具有一定联系,在发酵后期葡萄糖逐渐消耗尽之后,细胞衰亡,并且提高搅拌转速,会加快细胞凋亡速度。
3 搅拌转速对γ-PGA产率的影响分析
结合上述研究发现,发酵时间延长,会使γ-PGA产量有所降低,主要由于菌体衰亡,γ-PGA降解酶在其中发挥作用。在处于较高转速下,体系传输速度较快,能够使细胞浓度在短时间内达到饱和,之后衰亡,γ-PGA产率较低。在处于较低搅拌转速下,体系传质慢,γ-PGA合成率降低。当转速为400r/min时,此时PGA的产值最高,其浓度可达到21.78g/L。转速对γ-PGA平均分子量的影响。γ-PHA以及衍生物加工和应用,从一定程度上是与平均分子量具有紧密联系的,结合实际生产需求,在发酵过程中γ-PGA平均分子量也是其重要指标。
4 γ-PGA分批发酵动力学分析
当前,国内外针对γ-PGA发酵相关研究较多,大多数集中于菌种选育、合成机理、发酵工艺化等,很少涉及发酵动力学研究。针对γ-PGA生产菌发酵动力学特性研究,包括γ-PGA合成速率和基质浓度变化规律、菌体生长速率等,利于有效控制发酵过程,以提高γ-PGA物质的产率,降低企业生产成本。根据Richarda等人研究表明,PGA和生物聚合物分批发酵模型中观察,细胞生长无明显的抑制效果。拓展细胞生长是符合Monod方程的,产物的浓度是扩展细胞与实际细胞浓度差值。利用该实验构建的模型,没有考虑外源谷氨酸对于γ-PGA物质合成产生的影响,该模型能够用于生长发酵期,没有考虑发酵后期影响。对于本次研究群体Bacillus subtilis NX2为谷氨酸依赖型菌,γ-PGA合成产物的谷氨酸单体来源于外源谷氨酸,少量则来源于葡萄糖。
4.1 研究材料和方法
在本次研究中,所采用的菌种信号为Bacillussubtilis NX-2。由于B.Subtilis为谷氨酸依赖型菌,在无谷氨酸基础上,无法合成γ-PGA。外源谷氨酸是该菌株γ-PGA前体以及γ-PGA合成的重要活化剂,该群体能够利用葡萄糖以及谷氨酸合成γ-PGA,具体路径如图1所示。

图1 葡萄糖以及谷氨酸合成γ-PGA路径
4.2 研究结果
分析γ-PGA分批发酵代谢变化以及动力学。5L发酵罐中初始葡萄糖浓度为40g/L,将其置于32.5℃,400r/min下,分批发酵γ-PGA,如图2所示。
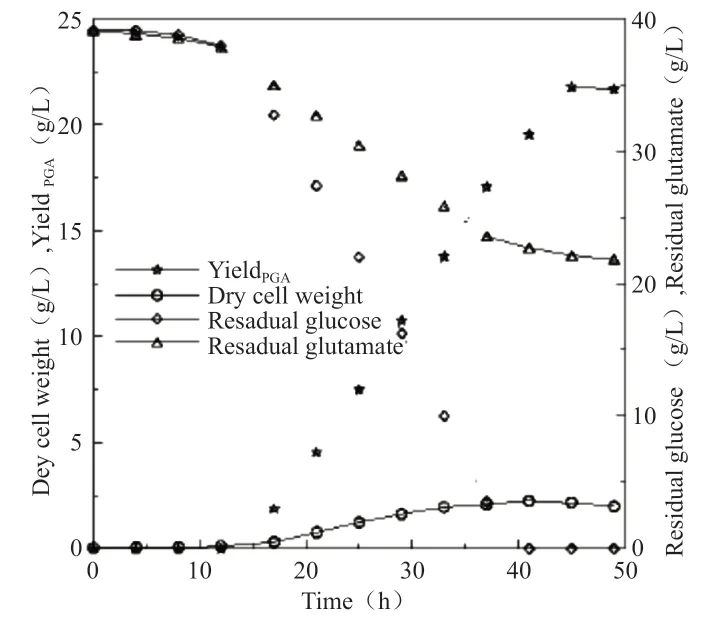
图2 γ-PGA分批发酵代谢变化以及动力学变化
根据该结果可以发现,细胞生长与葡萄糖浓度具有紧密联系的,当耗尽葡萄糖之后,菌体会进入衰亡期,继续合成,而随发酵时间延长,会使γ-PGA存在一定程度的降解。分析菌体生长速率以及γ-PGA合成速率随时间变化,结果发现,γ-PGA物质在发酵中,菌体成长可分为4个阶段,包括延迟期、加速生长期、减速期、衰亡期。在菌体合成γ-PGA质时,发酵前期γ-PGA合成是与细胞生长保持同步的,当菌体生长至一定时期,会受多种因素的影响,降低其生长速率,但仍会以较高的速率合成γ-PGA物质,因此,表明γ-PGA物质的合成与细胞生长具有一定联系。在细胞反应过程中,细胞生长速率降低,主要是由于存在部分物质对细胞生长起到抑制作用。根据γ-PGA浓度对于菌体生长速率产生的影响,可以发现初始葡萄糖浓度为30~60g/L时,细胞增殖浓度理论值与实验值能够获得一定吻合,当葡萄糖的初始浓度为30~50g/L时,利用动力学方程能够反映γ-PHA的生物合成过程。γ-PGA产率理论值与实验值相关性为0.99以上,当葡萄糖初始浓度为60g/L,此时γ-PGA产率理论值与实验值在发酵后期存在一定偏离,表明本研究所构建的模型,在一定程度上能够准确预测实验结果。
5 γ-PGA物质的分离提取
5.1 材料和方法
本实验中使用菌株分批发酵,结合上述实验方法,通过发酵获得γ-PGA发酵液,将发酵液稀释25倍之后,使其光密度值为0.323,浓度对应24g/L,发酵液呈淡黄色。将pH调至3.0,取1L发酵液,分别采用不同孔径微滤膜处理,比较发酵原液以及透过液菌体含量、产物浓度,计算菌体去除率以及产物损失率。
5.2 实验结果
pH及温度对γ-PGA酵液黏度的影响分析。在发酵过程中γ-PGA培养基pH为中性,聚谷氨酸由于侧链具有游离羧基,导致其带有负电荷,可作为菌株荚膜重要成分分泌至胞外,因已经替代负电荷菌体,无法聚集,而悬浮于发酵液中。γ-PGA分子量较大,在胞外逐渐积累之下,会使发酵液黏度提高,给菌液分离以及γ-PGA物质分离纯化提高难度,通过pH对发酵体系黏度影响,结果发现,pH由7调至3,会降低发酵液的黏度,当pH低于3时,发酵液黏度变化不明显,在碱性条件下黏度较高。当pH为6时,黏度降低,当pH为3时,黏度达3kcp,主要由于pH会影响γ-PGA分子构象,酸性溶液中γ-PHA分子为β片层结构,中性条件下则为无规卷曲结构,在碱性下为收缩随机结构,不同pH条件所表现的黏度变化不同。当pH低于4时,温度对于发酵液体系黏度产生影响不明显,在常温下可进行菌液分离以及产物超滤提取。结合pH对γ-PGA物质分子构象产生的影响,可以推测,在酸性条件下,γ-PGA分子相比中性、碱性易于透过微滤膜,因此,选择pH为3时,进行发酵微滤除菌。
6 结束语
通过实验探究了不同搅拌转速对B.subtilis NX-2分批发酵γ-PGA产生的影响,最终选择了400r/min搅拌转速,该菌体物质产率较高,可达到21.78g/L,在处于该转速下,对该菌体γ-PGA代谢变化和动力学分析,构建细胞生长以及产物合成动力学模型,求解模型参数后,获得γ-PGA分批发酵动力学模型,该模型表明在30~60g/L葡萄糖初始浓度下,细胞增殖浓度理论值与实验值具有良好吻合度。当初始葡萄糖浓度低于50g/L,γ-PGA生物合成产率理论值和实验值具有良好吻合,当葡萄糖初始液浓度为60g/L时,此时γ-PGA产率理论值和实验值在发酵后期存在一定的偏离,将发酵液pH调至3,采用0.8um孔径微滤膜,其除菌率为70.9%,产物损失率为5%。

