胶体金免疫层析法测定菲律宾蛤仔中氯霉素残留变化
郑泽洋,林丹*,张家意,朱惠绵,黄敏丰,丘韶麟,周英雅,陈乘
(1.广东省食品工业研究所有限公司,广东 广州 511442;2.食品企业质量安全检测技术示范中心,广东 广州 511442;3.珠海市香洲区市场监督管理局,广东 珠海 519000)
氯霉素(Chloramphenicol,CAP)是一种广谱抗生素,其效高价廉,曾在畜牧业、水产养殖业中广为应用。抗生素的使用不仅给海洋环境带来不利影响,包括抑制沉积物中有益微生物的活性,影响生物地球化学循环,且长期使用会引起病原生物的抗药性增强和水生生物体药物残留等问题[1]。我国自2002年起已明确禁止氯霉素及其盐、酯添加或用于所有食品动物中,规定在所有动物可食部分中不得检出[2]。但近年来在各省市的食品安全监督抽查中,频繁在水产品中检出氯霉素,严重危害了消费者的健康。
食品快速检测技术具有快速、简便、灵敏等特点,已广泛用于食品安全监管中[3]。胶体金免疫层析法(Colloidal gold immunochromatography assay,GICA)是常用的快速检测方法之一,是以胶体金作为示踪标志物应用于抗原抗体的一种新型的免疫标记技术。目前,胶体金免疫层析法已广泛应用于动物产品中氯霉素残留初筛,能在短时间内检测几十甚至上百个样品,并且不需用到复杂仪器设备,样品处理简单。与传统的仪器法相比,胶体金免疫层析法具有快速、操作简单、结果准确、重复性好的特点。刘文珍等[4]应用胶体金免疫层析法快速检测9种水产品中残留的氯霉素,表明方法具有良好的稳定性,特异性较好,与国标方法相比,试验结果基本一致。王媛等[5]分析比较了3种测定水产品中氯霉素残留的商品化胶体金快速检测产品,其灵敏度、精密度、符合性和稳定性均能满足目前对氯霉素监控的限量要求,适合水产品中氯霉素残留的现场筛选。
现以胶体金免疫层析快速检测方法作为检测手段,以菲律宾蛤仔为试验对象,探究其氯霉素残留变化规律,为推进快速检测方法在基础研究中的应用提供参考,也为提高消费者的贝类食用安全提供依据。
1 研究方法
1.1 试剂与样品
氯霉素(CAS号:56-75-7)纯度为99%,购自德国Dr.Ehrenstorfer公司;氯霉素残留检测试纸条,购自北京勤邦生物技术有限公司;菲律宾蛤仔由广州市某市场购得。
1.2 灵敏度与精密度试验
(1)灵敏度。对产品进行加标试验,该氯霉素试剂盒产品检出限为0.1μg/kg。采用空白菲律宾蛤仔样品添加0.1、0.5和1μg/kg CAP标准溶液,每个浓度做6次平行。
(2)精密度。采用空白菲律宾蛤仔样品添加0.1μg/kg CAP标准溶液,用同一批号的产品在同一时间测定10次,判断产品的精密度。
1.3 试验设计
(1)停药处理。将菲律宾蛤仔分别暂养于低中高3个质量浓度(0.25,1.5,5 mg/L)的CAP溶液中;4 h后置于海水中暂养24 h,并于第1,3,6,9,12,18和24 h取样;采用胶体金免疫层析法测定其CAP残留。
(2)换水处理。将菲律宾蛤仔暂养于5 mg/L的CAP溶液中,暂养4 h;停药后,在海水暂养24 h内,每1、3和6 h换一次水,并于第1,3,6,9,12,18和24 h取样;采用胶体金免疫层析法测定其CAP残留。
(3)换水和预煮协同处理。将菲律宾蛤仔暂养于5 mg/L的CAP溶液中,暂养4 h。停药后,在海水暂养24 h内,每1,3,6 h换一次水,并于第1,3,6,9,12,18和24 h取样,在沸水中处理10 min,采用胶体金免疫层析法测定菲律宾蛤仔中CAP残留情况。
1.4 样品处理
参考氯霉素残留检测试纸条说明书方法,取5~10个菲律宾蛤仔,去壳,匀浆。称取(2.00±0.02)g匀浆好的组织样本至10 mL聚苯乙烯离心管中,加入4 mL提取剂,涡旋混匀,剧烈震荡约2 min后,3 000 r/min离心5 min;移取3 mL上层有机相至10 mL聚苯乙烯离心管中,于50~60℃水浴氮气流或空气流下吹干;加入样本复溶液,用涡旋仪涡动20 s后待检。
1.5 样品测定
取出试纸条回温至室温(即开即用),置于平整的台面上。吸取1.4中待测样本溶液75μL垂直滴加于加样孔中,液体流动时开始计时,在10 min内读取结果。以磷酸盐缓冲液代替样品提取液作为空白进行对照试验。
1.6 结果判定
参考氯霉素残留检测试纸条说明书结果判定方法。
(1)试剂板有效性判定。如果空白对照控制线(以下简称C线)没有出现红色条带,见图1(c),则说明检测试剂条已经失效,不能进行检测;如果C线和检测线(以下简称T线)均出现红色条带,而且检测线比空白对照线颜色深或一样深,见图1(a)(b)。说明检测试剂板有效,可进行检测。
(2)结果读取。肉眼观察样品检测结果,如果未出现C线,则表明操作不当或试剂条已失效,见图1(c);当待检样品T线出现红色条带,且颜色比C线深或一样深则表示待检样品为阴性,见图1(a),未检测到样品含有氯霉素﹔当待检样品T线无显色或比C线颜色浅,则表示待检样品为阳性,见图1(b),检测到样品含有氯霉素。
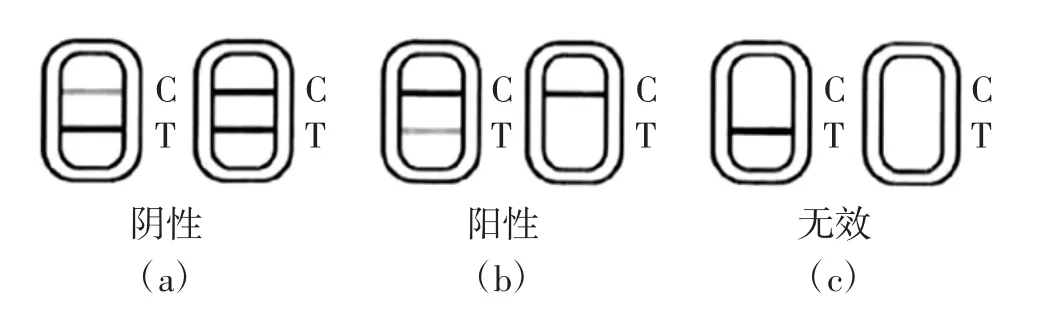
图1 氯霉素残留检测试纸条判定结果
2 结果与讨论
2.1 灵敏度与精密度试验
(1)灵敏度。按照氯霉素检测试剂盒说明书,以灵敏度试验进行测定,依据判定方法,测定结果见表1。由表1可见,该氯霉素检测试剂盒产品在0.1,0.5和1μg/kg CAP加标量下均可以得出测定结果,且6次测定结果一致,检出率为100%,假阴性率为0。
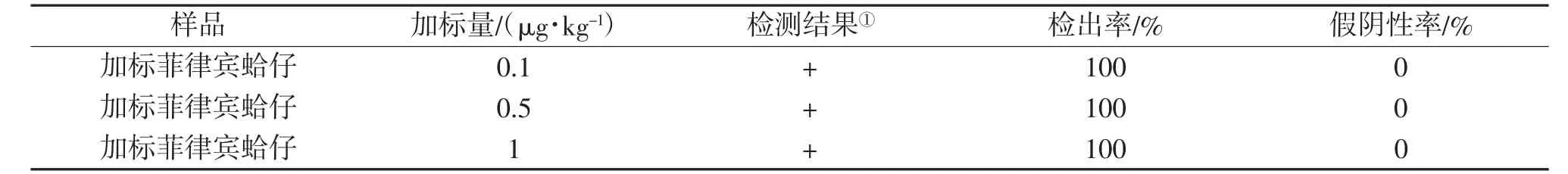
表1 氯霉素快速检测试剂盒产品的灵敏度测试结果(n=6)
(2)精密度。该氯霉素检测试剂盒检测限为0.1μg/kg,在精密度试验中将检测限作为测定浓度,在空白菲律宾蛤仔中加入0.1μg/kg CAP,用同一批号产品在同一时间平行测定10次,测定结果见表2。由表2可见,在检测限点,该氯霉素试剂盒产品10次平行测定的结果均一致,检出率为100%,假阴性率为0。

表2 氯霉素快速检测试剂盒产品的精密度测试结果(n=10)
2.2 停药后菲律宾蛤仔中氯霉素残留量变化
停药后菲律宾蛤仔中氯霉素残留量判定结果见表3。由表3可见,经低质量浓度CAP(0.25 mg/L)处理的菲律宾蛤仔在海水暂养的24 h内,氯霉素残留检测试纸条判定结果均为阴性;经中质量浓度CAP(1.5 mg/L)处理的菲律宾蛤仔在海水暂养的24 h内,在0~18 h时,氯霉素残留检测试纸条判定结果均为阳性,在第24 h时,检测结果为阴性;经高质量浓度CAP(5 mg/L)处理的菲律宾蛤仔在海水暂养的24 h内,氯霉素残留检测试纸条判定结果均为阳性。另外,菲律宾蛤仔经0.25 mg/L氯霉素处理4 h后,其体内未能检出CAP残留;经1.5和5 mg/L CAP处理后,其体内检出CAP初始残留。
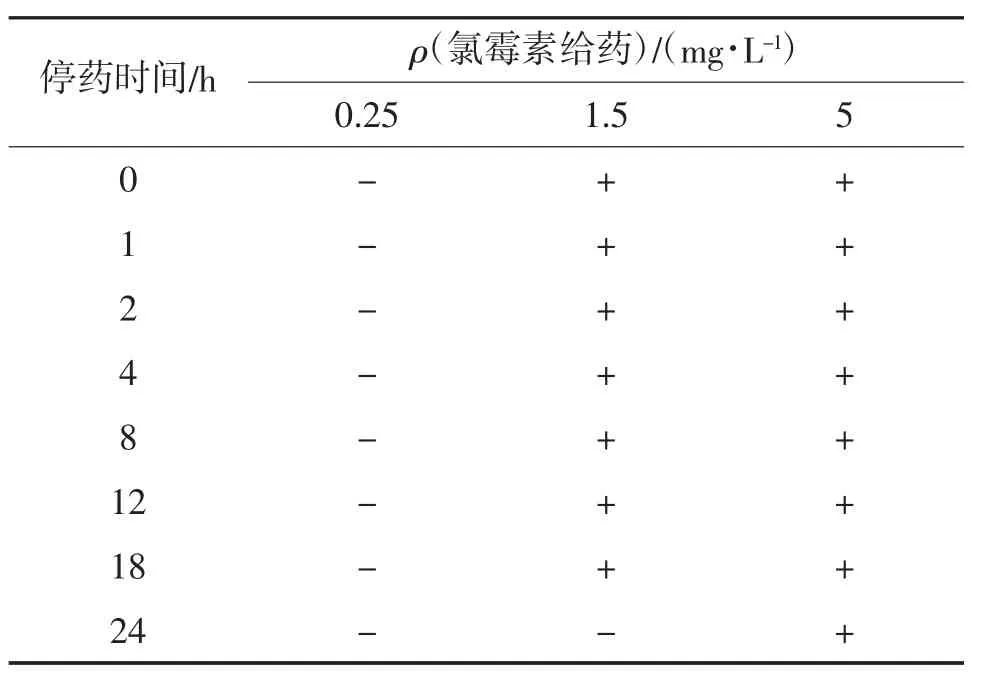
表3 停药后菲律宾蛤仔中氯霉素残留量判定结果①
菲律宾蛤仔中CAP初始残留量随氯霉素给药浓度的增加而增加,且CAP残留量随暂养时间的增加而减少。李爱等[6]做了相关研究,发现菲律宾蛤仔组织中氯霉素初始残留量随氯霉素给药量的增加而增加,并且氯霉素残留量随停药时间的延长而降低,该结果与文章结论相符,说明快速检测方法在基础理论研究中有一定的实际意义,可作为样品条件筛选的依据。
2.3 换水处理后菲律宾蛤仔中氯霉素残留量变化
经5 mg/L CAP溶液处理停药后,菲律宾蛤仔采用换水处理暂养24 h,换水频率分别为间隔1,3和6 h/次。换水后菲律宾蛤仔中氯霉素残留量判定结果见表4。由表4可见,未换水的菲律宾蛤仔在24 h内,氯霉素残留检测试纸条判定结果均为阳性;换水频率为间隔1,3,6 h/次,在第0~12 h时,氯霉素残留检测试纸条判定结果均为阳性;从第18 h开始,判定结果转为阴性。
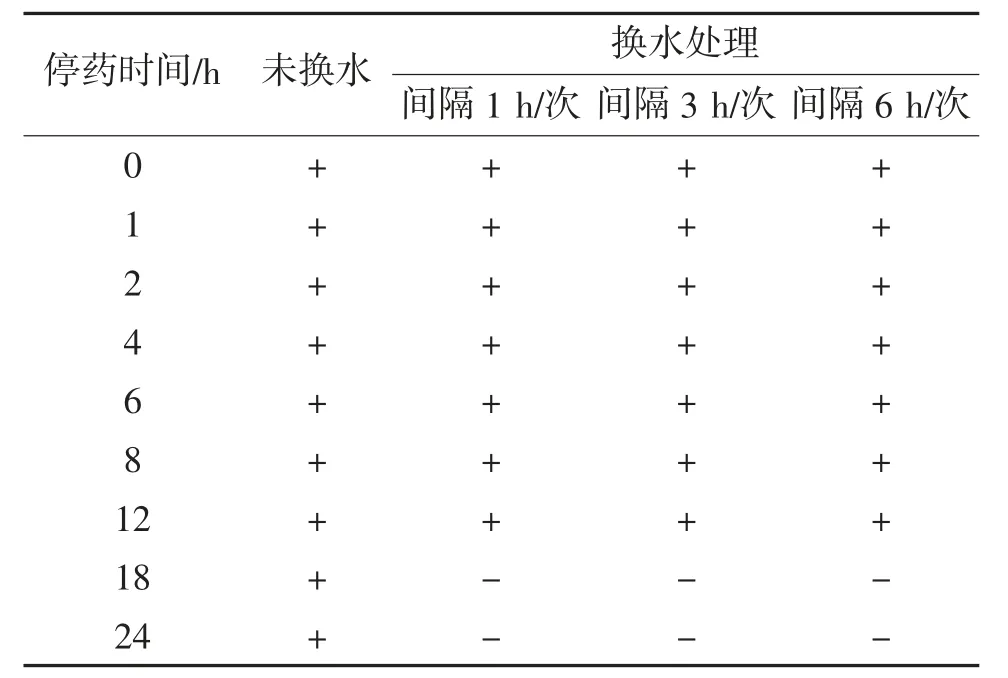
表4 换水后菲律宾蛤仔中氯霉素残留量判定结果①
在CAP初始残留量一致的情况下,换水可有效降低菲律宾蛤仔中CAP残留量,但换水频率对CAP残留量影响不大。原因可能是换水处理能保证菲律宾蛤仔的正常生命活动,保持其代谢能力。而未换水处理的菲律宾蛤仔在24 h暂养过程中产生的代谢物流入海水溶液中,随着时间的延长,代谢物增加,生存环境变得恶劣,其本身的代谢能力降低,从而影响氯霉素代谢。
2.4 换水和预煮协同处理后菲律宾蛤仔中氯霉素残留量变化
经5 mg/L CAP溶液处理停药后,菲律宾蛤仔采用换水处理暂养24 h,测定前采用沸水预煮处理10 min。换水和预煮协同处理后菲律宾蛤仔中氯霉素残留量判定结果见表5。
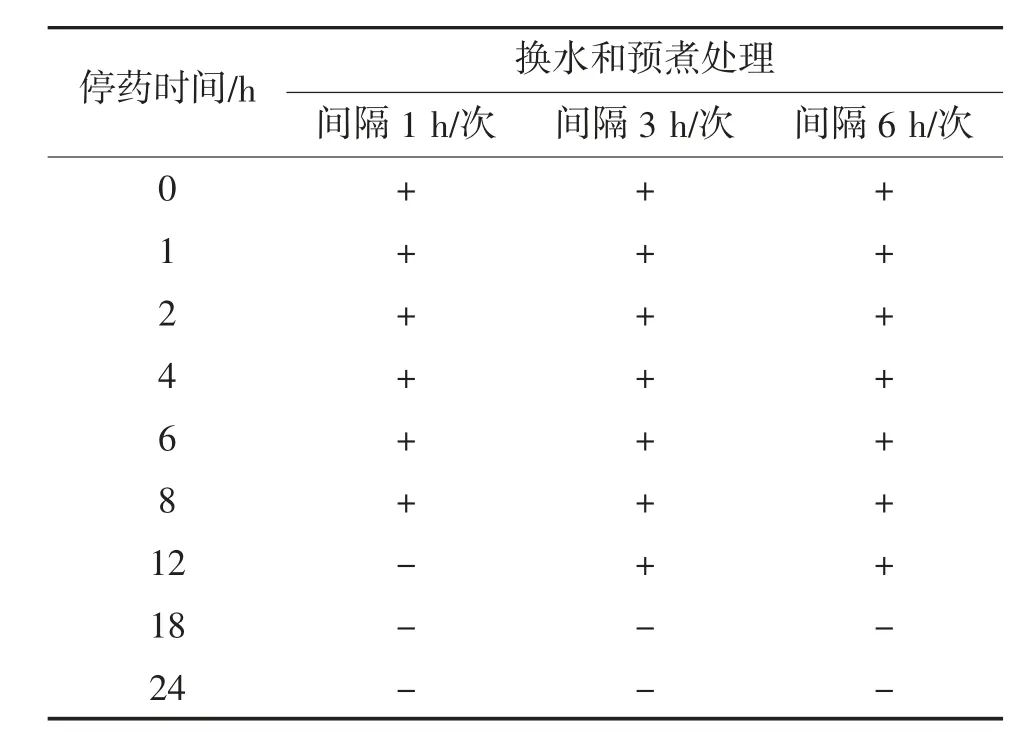
表5 换水和预煮协同处理后菲律宾蛤仔中氯霉素残留量判定结果①
由表5可见,经过间隔1 h换一次水后,在第0~8 h沸水预煮10 min时,检测结果均为阳性;从第12 h开始,检测结果转为阴性。经过间隔3和6 h换一次水后,在第0~12 h沸水预煮10 min时,检测结果均为阳性;从第18 h开始,检测结果转为阴性。
在CAP初始残留量一致的情况下,当换水频率较高(间隔1 h/次)时,与换水处理相比换水和预煮协同处理能明显降低残留量,在处理的第12 h氯霉素检测结果已为阴性。当换水频率相对较低(间隔3、6 h/次)时,换水和预煮协同处理对氯霉素残留量影响较小。
3 结论
氯霉素快速检测试剂盒具有高灵敏度和高精确度,其检测限基本满足目前对氯霉素监控的限量要求。用胶体金免疫层析法测定菲律宾蛤仔中氯霉素残留量的变化,发现氯霉素初始残留量随氯霉素给药浓度的增加而增加,且氯霉素残留量随暂养时间的增加而减少;在氯霉素初始残留量一致的情况下,换水能有效降低菲律宾蛤仔中氯霉素残留量,但换水频率对氯霉素残留量影响不大;当换水频率较高时,换水和预煮协同处理能明显降低氯霉素残留量。
试验结果表明,快速检测方法在基础理论研究中具有一定的实际意义,可作为样品条件筛选的依据。

