民猪脂肪细胞分化过程中抗寒相关基因表达规律研究
范文博,马 红,马守正,汪 亮,刘 娣,*
(1.东北农业大学动物科学技术学院,哈尔滨 150036;2.黑龙江省农业科学院畜牧研究所,哈尔滨 150000)
民猪具有抗寒、产仔多、肉质好、耐粗饲等突出优点。民猪的抗寒能力是它能在东北地区生存的关键因素,而脂肪是民猪抗寒的主要组织。脂肪组织主要分为3种类型:白色脂肪、棕色脂肪及米色脂肪。白色脂肪组织(white adipose tissue,WAT)的主要功能是以三酰基甘油(triacylglycerol,TAG)的形式存储多余的能量;棕色脂肪组织(brown adipose tissue,BAT)是哺乳动物体内非颤抖性产热的主要器官,通过解偶联蛋白 1(uncoupling protein,UCP1)介导的氧化磷酸化与三磷酸腺苷(adenosine triphosphate,ATP)合成的解偶联作为热量来耗散能量[1-2]。当机体交感神经兴奋时,如处于低温环境,白色脂肪会发生棕色化,转变成米色脂肪组织(beige adipose tissue)[3],同棕色脂肪一样,米色脂肪也可以促进代谢产热[4-5]。民猪的抗寒机理一直是重要的研究方向,猪缺少棕色脂肪,但有研究发现可能存在米色脂肪[6]。
本试验选取了3个产热相关基因:1)解偶联蛋白3(uncoupling protein,UCP3),解偶联蛋白受体基因属于线粒体载体蛋白家族,主要参与机体的能量代谢,也是影响肉质的重要功能基因[7],UCP3在哺乳动物的产热和脂代谢调控中有重要作用[8-10]。2)过氧化物酶体增殖物激活受体-γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α),PGC-1α 是参与调节适应性产热的主因子。研究表明,PGC-1α 在处于寒冷环境中的棕色脂肪和骨骼肌中高表达。PGC-1α作为PPARγ 的辅助激活因子激活了决定棕色脂肪细胞的主要基因,例如UCPs[11]。3)过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs),其家族中的PPARα对调节脂肪代谢有重要作用[12]。
本试验还选取了3个米色脂肪标记基因:1)核转录因子(early B-cell factor,EBF),其家族中的EBF2在脂肪细胞的成熟分化中起关键作用[13];2)四跨膜蛋白家族成员中的分化簇81(cluster designation 81,CD81),CD81作为细胞表面的免疫调节分子,参与细胞的黏附,影响细胞的生长和分化[14];3)血小板衍生生长因子受体α(platelet-derived growth factor receptors,PDGFRα),PDGFRα是酪氨酸蛋白激酶受体家族成员之一,是一种跨膜糖蛋白,在脂肪组织形成中具有重要作用[15]。
米色脂肪对民猪的抗寒能力起重要作用,本研究通过检测产热基因和米色脂肪标记基因的表达为研究民猪抗寒能力提供依据。
1 材料与方法
1.1 主要试剂及仪器
TRIzol、荧光定量试剂、DMEM/F12培养基购自Life Technologies公司;反转录试剂盒、胎牛血清(FBS)、磷酸盐缓冲溶液(PBS)、胰蛋白酶购自TaKaRa公司;青链霉素混合液、IV型胶原酶、油红O染液、地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX)、胰岛素、罗格列酮、吲哚美辛、三碘甲状腺原氨酸(T3)购自Sigma公司;引物由安徽通用生物系统有限公司合成。
1.2 样品采集
试验动物来自黑龙江省农业科学院畜牧研究所养殖基地,采集1月龄东北民猪的背部皮下脂肪组织用于前体脂肪细胞的培养。采样程序:屠宰后迅速去除皮毛,用无菌的剪刀、镊子剪下1 cm ×1 cm的背部皮下脂肪组织块。用含有10%双抗(青霉素和链霉素)的无菌PBS溶液冲洗2~3遍后,将组织块浸泡于15 mL含有双抗的PBS溶液中,然后冷藏保存带回实验室。
1.3 民猪前体脂肪细胞的分离培养
将民猪脂肪块放于100 mm培养皿中,滴加少量组织消化液(DMEM/F12基础培养基含1%IV型胶原酶,10 mmoL·L-1CaCl2),并用剪刀将组织块剪成细小的碎块。组织剪好后,转移至50 mL离心管中,加入足量的组织消化液和2%浓度的BSA(用DMEM/F12培养基配置,现用现配),封口膜封口,置37 ℃摇床中,150 r·min-1震荡消化40~50 min,期间每10~15 min检查一次组织消化情况;待组织样消化完全后,加入等体积的DMEM/F12细胞培养基(含1%双抗、10%FBS)终止消化;用100 μm细胞筛过滤组织消化产物,将滤液转移至干净的50 mL离心管中;1 000 r·min-1离心5 min;弃上清,将细胞沉淀用1 mL细胞培养基重悬,转移到60 mm培养皿中,再加3 mL细胞培养基后放入37 ℃,5% CO2恒温培养箱中过夜。第2天用PBS冲洗培养皿3次,将未贴壁细胞洗去,并加入4 mL DMEM/F12细胞培养基(含1%双抗、10%FBS)继续培养,每2 d更换1次培养基,至细胞生长至合适的密度。
1.4 民猪前体脂肪细胞诱导分化
当细胞长满后,将生长培养基换成含有0.5 mmoL·L-1IBMX、5 μg·mL-1胰岛素、1 μmoL· L-1地塞米松、1 μmoL·L-1罗格列酮、1 μmoL·L-1三碘甲状腺原氨酸 (T3)、1 μmoL·L-1吲哚美辛的DMEM/F12细胞培养基(含1%双抗、10%FBS),2 d后换液,替换成只含有5 μg·m L-1胰岛素、1 μmoL·L-1三碘甲状腺原氨酸(T3)及1 μmoL·L-1罗格列酮的DMEM/F12细胞培养基(含1%双抗、10%FBS),每2 d换液1次至第8天。在诱导培养的第0、2、4、6、8天收集细胞RNA样用于检测基因的表达量。
1.5 油红O染色法检测脂滴形成
将诱导分化第8天的民猪前体脂肪细胞拿出,弃去培养皿内培养基,用PBS轻轻地洗3次,加入4%多聚甲醛固定30 min。用PBS洗3次去除多聚甲醛,向培养基中加入油红O工作液至刚好没过底部进行染色。染色30 min后,吸出油红O,再用PBS清洗3次。使用相差显微镜观察。
1.6 基因定量引物设计
利用Primer 5.0在线设计软件,根据GenBank上猪的UCP3、PGC-1α、PPARα、EBF2、CD81、PDGFRα序列设计定量引物,以β-actin为内参基因,基因的引物序列由安徽通用生物系统有限公司合成。引物序列见表1。

表1 基因定量引物序列Table 1 Real-time PCR primer sequence of genes
1.7 细胞总RNA的提取、检测和反转录
按照TRIzol试剂盒使用说明提取民猪前体脂肪细胞诱导分化细胞的总RNA,利用琼脂糖凝胶电泳法对提取的总RNA进行质量检测。提取的RNA经反转录得到cDNA,反应体系:1)5×gDNA Eraser Buffer 2 μL,gDNA Erase 1 μL,RNA (1 000/RNA 浓度)μL,Free H2O补足10 μL。扩增条件:42 ℃ 2 min,16 ℃ 1 min;冰浴2 min。2)Primre Seript RT Enzyine Mix I 1 μL,RT Primer Mix 1 μL,5×Primre Seript Buffer2 4 μL,Free H2O 4 μL。扩增条件:37 ℃ 15 min,85 ℃ 5 s,16 ℃ 1 min。
1.8 qRT-PCR验证
用设计的定量引物(表1)进行实时荧光定量PCR反应,反应体系:cDNA样品0.5 μL,2×SYBR Green PCR Mixture 10 μL,上、下游引物各0.5 μL,灭菌水补充至20 μL。每个样品重复3次。扩增条件:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,72 ℃ 30 s,40个循环;熔解曲线程序为:95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s;60 ℃ 1 min。每组试验重复3次。采集荧光信号绘制扩增曲线和熔解曲线。
1.9 数据统计分析
以β-actin基因为内参,qRT-PCR数据采用2-ΔΔCt法分析,计算UCP3、PGC-1α、PPARα、PDGFRα、EBF2、CD81每个基因的相对表达量。试验均设置3个重复,所有数据使用GraphPad Prisms软件中的One-way ANOVA进行方差分析和显著性检验。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 脂肪细胞RNA的提取
本试验采用TRIzol法提取细胞不同诱导时间点的RNA,并用1.5%琼脂糖凝胶进行电泳检测。从图1 中可以看出,所有样品的 RNA 在凝胶上均显示出3条清晰明亮的条带,由上至下分别为28S、18S、5S。经紫外分光光度计测定,提取的总 RNA 质量较好,可用于后续基因表达量的检测。

图1 RNA电泳图Fig.1 RNA detection electrophoresis map
2.2 民猪前体脂肪细胞诱导分化及油红O鉴定
前体脂肪细胞在不诱导分化正常传代培养时只会出现少数分化现象,由图2可以看到诱导处理第0 天时细胞呈长梭形,几乎没有脂滴形成,在加入诱导分化试剂培养第2天时,视野中出现了亮的脂滴,第4天明显看到形成的脂滴变多,并有聚拢的趋势,当诱导分化第6天时,开始出现大片脂滴聚拢现象,从图中可以看到脂滴覆盖率达到60%,第8天时,视野下是大片脂滴,覆盖率达80%,有的地方出现脂滴重叠现象。在第8天进行油红O染色,也可以清晰看到脂滴被染成红色,确定诱导分化成功。
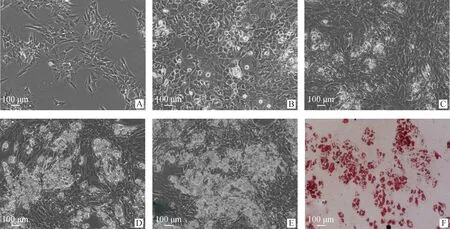
A~E.诱导分化第0、2、4、6、8天细胞形态;F.第8天油红O染色细胞形态A-E.Cell morphology on day 0,2,4,6 and 8 of differentiation;F.On day 8,the morphology of cells stained with Oil red O图2 诱导分化和油红O染色的民猪前体脂肪细胞(100×)Fig.2 Adipogenic differentiation and Oil red O staining of preadipocytes of Min pig(100×)
2.3 目的基因在民猪前体脂肪细胞中的表达
2.3.1 产热相关基因表达UCP3表达量随着脂肪细胞的分化其表达量持续升高,在第6天时达到最高值,为第0 天时表达量的164倍(P<0.01),第8天时表达量略有降低,但仍为第0天时的63倍(P<0.01)(图3);PGC-1α基因在诱导分化后第2天 表达量最高,达到第0天的334倍(P<0.01)(图3),第4、6 和8天时的表达量与第2天比较有较大幅度地降低,但也分别达到第0天表达量的35、22和13倍(图3);PPARα的表达量在诱导后的第2天达到第0天表达量的7倍(P<0.01),并在此后始终保持4~7倍的较高表达量(P<0.01)(图3)。

不同大写字母表示组间差异极显著(P<0.01)。下同Different uppercase letters indicate extremely significant differences among different groups(P<0.01).The same as below图3 产热相关基因表达情况Fig.3 Expression of genes related to thermogenesis
结合3种产热相关基因在脂肪细胞成熟分化过程中的表达趋势可见(图3),当前体脂肪细胞向成熟脂肪细胞分化的过程中,与产热相关的基因表达量迅速提高,虽然在完成成熟转化后表达量有所降低,但相比于未分化状态时依然终保持了较高的表达水平。
2.3.2 米色脂肪转化相关基因表达EBF2基因在诱导分化后的第2天表达量最高,达到第0天的29倍(P<0.01),在第4、6 和8 天时的表达量比第2天有较大幅度地降低,但也达到第0天表达量的7、9和4倍(图4);CD81基因在第2、4天的表达量为第0天表达量的4倍左右(P<0.01),第8天和第0天的表达量接近,为第0天表达量1.2倍(图4)。PDGFRα基因的表达量在第2天时最高,为第0天表达量的5倍(P<0.01),第4天为第0天表达量的3倍(P<0.01),第6天几乎与第0天相同,第8 天时低于第0天的表达量(图4)。结合3种米色脂肪转化相关基因表达情况可见(图4),当前体脂肪细胞向成熟脂肪细胞分化的过程中米色脂肪特异性基因发生表达。

图4 米色脂肪转化相关基因表达情况Fig.4 Expression of genes related to beige fat transformation
3 讨 论
3.1 脂肪细胞分化过程中产热相关基因的表达
UCP3基因属于线粒体载体基因家族,主要参与线粒体呼吸链的解偶联作用,用于机体非战栗产热。目前,对猪UCP3基因的研究主要集中在多态性分析及其对脂肪沉积和肉品质的影响[16-17]。Lin等[18]证明,1周龄藏猪受到冷刺激后出现米色脂肪组织,UCP3基因表达量显著上调,介导机体脂肪组织产热,抵抗寒冷环境对机体的影响。PGC-1α是一种转录共激活因子,是参与调节适应性产热的主因子,主要在棕色脂肪组织中表达,当小鼠处于冷暴露时,PGC-1α在白色脂肪组织中含量明显增加,并进一步促进UCP1的表达,说明其在促进白色脂肪棕色化中有重要作用[19-20]。PPARα高表达于代谢活性强的组织,如肝、心、肌肉和米色脂肪组织。肝内,PPARα参与调控肝内的3条脂肪酸氧化代谢通路(过氧化物酶体和线粒体β-氧化及微粒体ω-氧化),控制着肝内脂质及机体能量平衡。在米色脂肪细胞和巨噬细胞分化及饥饿过程中,PPARα的表达水平均升高[21]。研究发现,PGC-1α和PPAR家族共同作用于UCP3,是UCP3基因分子调控的重要组成部分,同时UCP3对于PGC-1α诱导的氧化能力至关重要[22]。本研究中,PGC-1α和PPARα在第2天有较高表达,UCP3表达量在2 d 后逐渐升高,说明随着时间的增加PGC-1α和PPARα促进UCP3的表达,符合上述研究结果。UCP3、PGC-1α、PPARα表达量的升高说明细胞产热能力明显增加。
3.2 脂肪细胞分化过程中米色脂肪标记基因的表达
EBF2、PDGFRα、CD81是研究发现的米色脂肪标志性基因。通过对小鼠EBF2基因的敲除发现,EBF2控制着小鼠米色脂肪细胞的形成[23]。EBF2通过增加PGC-1α的表达来促进产热基因转录,从而促进米色脂肪细胞生成[24]。EBF2在成人棕色前体脂肪中高丰度表达,表明其在人类棕色前体脂肪的形成过程中也发挥着重要的调控作用[25]。EBF2缺失小鼠的棕色脂肪细胞和组织显示出棕色特异性特征和产热能力的丧失,确定了EBF2是棕色脂肪细胞功能的关键转录调节因子。通过在小鼠中研究皮下和内脏脂肪发现,PDGFRα信号传导促进米色脂肪细胞生成[26-27]。CD81是在研究中发现的一种新的更准确的米色脂肪标志基因,Oguri等[28]将CD81+和CD81-细胞分别从小鼠的腹股沟脂肪中分选出来并进行体外培养,结果发现,只有CD81+细胞能够分化成成熟的脂肪细胞并表达多个米色脂肪所特有的基因。本研究中,EBF2、CD81和PDGFRα在前体脂肪细胞中均有表达,且在诱导分化的第2天出现最高表达量,随着诱导时间的继续增加,表达量明显降低,可能是前体脂肪细胞更多向白色脂肪细胞转化而向米色脂肪细胞转化的较少。
4 结 论
本研究结果显示,在民猪的前体脂肪细胞向成熟脂肪细胞诱导分化的过程中,产热和米色脂肪标记相关基因的表达会随着诱导时间的增加而产生规律性变化。产热相关基因的表达量会随着诱导时间的增加而增加,并维持较高水平;而米色脂肪标记基因在诱导第2天表达量最高,随后则明显降低。本研究结果说明,前体脂肪细胞的分化具有明显的阶段特异性,为进一步分析如何影响民猪前体脂肪细胞向米色脂肪细胞的分化,以及从分子角度研究民猪抗寒机理提供参考。

