幕上Ⅱ~Ⅳ级胶质瘤多模态MRI的分级诊断与病理学结果的相关性研究
张格,陈旺生,陈峰,赵应满
脑胶质瘤是常见的颅内恶性肿瘤,发病率较低,约为3/10万~8/10万,但具有较高的死亡率,5年存活率仅为10%[1-2]。临床上通常将脑胶质瘤分为高、低级别,其中低级别胶质瘤分化较好,为良、恶性交界肿瘤,而高级别胶质瘤分化较差,治疗预后也相对较差[3-4]。手术切除为该病首要治疗方式,但不同级别采取的手术方案各不相同,也决定患者术后放化疗选择及预后进展,故术前对胶质瘤的准确分级诊断至关重要。磁共振成像(magnetic resonance imaging,MRI)凭借其无创、多种成像序列、图像对比度高、任意方位断层成像等优势,在中枢神经系统疾病中应用广泛,也是胶质瘤最主要的影像学检查方式[5]。不过MRI成像序列众多,根据成像原理可分为结构、扩散、灌注三种模态,常规结构成像如T1加权成像(T1-weighted imaging,T1WI)、T2加权成像(T2-weighted imaging,T2WI)以及动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI),扩散成像如扩散加权成像(diffusion weighted imaging,DWI)、扩散张量成像(diffusion tensor imaging,DTI),灌注成像如三维动脉自旋标记灌注成像(3D-arterial spin labeling,3D-ASL)。不同的成像序列诊断效能不一,尤其是常规序列在影像学表现上存在高度重合,对胶质瘤高低级别的准确分级诊断敏感性差[6-7],难以满足临床需求。MRI的多模态指的是采用多种成像序列,综合分析其定性与定量参数,达到MRI诊断的最大效能。本研究运用多模态MRI对胶质瘤进行分级诊断,分析其与手术病理的一致性。
材料与方法
1.研究对象
回顾性搜集本院2017年1月-2019年12月收治的胶质瘤患者的病例资料。纳入标准:①年龄≥18岁;②符合胶质瘤的诊断标准[8];③幕上胶质瘤,肿瘤位于大脑半球;④均进行手术治疗且取得术后病理结果;⑤患者术前行MRI检查,资料齐全。排除标准:①接受保守治疗;②手术病例或胶质瘤穿刺活检证实为WHOⅠ级胶质瘤;③MRI成像质量不佳、无法研究分析;④肿瘤位置为幕下胶质瘤、脑干胶质瘤、脊髓胶质瘤;⑤合并其他神经系统疾病,如脑梗死、脑出血等。最终纳入126例胶质瘤患者,根据WHO中枢神经系统肿瘤分类标准[9],分为Ⅱ级56例、Ⅲ级42例、Ⅳ级28例,其中低级别胶质瘤(Ⅱ级)56例,高级别胶质瘤(Ⅲ级和Ⅳ级)70例。
2.仪器设备
采用Siemens Magnetom Verio 3.0T磁共振成像仪,32通道头颅专用线圈。MRI图像处理软件Sante MRI Viewer。对比剂采用钆喷酸葡胺注射液(国药准字H10950272,广州康臣药业有限公司)。扫描序列包括:T1WI、T2WI、DWI、DTI、DCE-MRI以及3D-ASL。T1WI扫描参数:TR 500 ms,TE 18 ms,层距5 mm,视野(FOV)240 mm×240 mm,采集矩阵320×320,激励次数(NEX)2次。T2WI扫描参数:TR 700 ms,TE 20 ms,层距5 mm,FOV 240 mm×240 mm,矩阵320×320,NEX 2次。DWI扫描参数:TR 6200 ms,TE 12 ms,层距5 mm,FOV 240 mm×240 mm,矩阵512×512,NEX 2次。DTI扫描参数:TR 6200 ms,TE 12 ms,层距5 mm,FOV 240 mm×240 mm,矩阵512×512,NEX 2次,张量是对称的(Dxy=Dyx ,Dxz=Dzx ,Dyz=Dzy),施加6个非共线方向扩散敏感梯度,就是X、Y、Z、XY、XZ、YZ方向。DCE-MRI扫描参数:TR 500 ms,TE 18 ms,层距5 mm,FOV 240 mm×240 mm,采集矩阵320×320,NEX 2次;经静脉注射对比剂钆喷酸葡胺,剂量为0.1 mmol/kg,注射流率为3 mL/s。3D-ASL扫描参数:TR 1525 ms,TE 26 ms,标记后延迟时间青年人为1525 ms,老年人为3025 ms,层距4 mm,FOV 240 mm×240 mm,采集矩阵320×320,NEX 2次。观察颅脑病变部位及信号变化等。
3.图像处理与分析
扫描完成后,图像资料自动导入Sante MRI Viewer,对原始数据进行后处理。兴趣区(region of interest,ROI)结合伪彩图及常规增强后T1WI图像确定,由两位有经验的神经影像医师在不知道病理结果的情况下对所有图像进行测量,ROI置于病灶实性部分及瘤周水肿区,尽量包含所有实性强化部分并避开坏死组织及血管,每个部位测3次取平均值。不同模态图像ROI的选取一致。计算DWI的表观扩散系数(apparent dispersion coefficient,ADC)、DTI的部分各向异性分数(fractional anisotropy,FA),DCE-MRI的容量转移常数(Ktrans)、血管外细胞外间隙容积比(volume ratio of extracellular space,Ve),3D-ASL成像的最大肿瘤血流量值/相对肿瘤血流量值(rTBF)。最大肿瘤血流量值/相对肿瘤血流量值(rTBF)=最大肿瘤血流量值(TBFmax)/对侧正常白质的脑血流量值(CBF),rTBF=TBFmax/CBF。由2名具有5年以上经验的影像学主治医师独立阅片,上述测量值均测量3次取平均值。
4.统计学方法
结 果
1.患者基线资料
本研究纳入126例胶质瘤患者,男63例,女63例;年龄23~76岁,平均(49.00±6.20)岁。肿瘤最大直径2.35~7.89 cm,平均最大直径(5.16±1.30) cm;肿瘤体积14.25~66.37 cm3,平均(40.52±11.83) cm3;累及灰质107例,跨越中线向对侧生长27例;低级别胶质瘤56例,病理类型:少突星形细胞瘤32例,弥漫星形细胞瘤19例,少突胶质细胞瘤5例;高级别胶质瘤70例,病理类型:间变性星形细胞瘤39例,间变性少突胶质细胞瘤3例,胶质母细胞瘤28例。低级别与高级别胶质瘤患者的性别分布、肿瘤大小、是否累及灰质比较,差异均无统计学意义(P>0.05)。高级别胶质瘤患者的年龄大于低级别胶质瘤患者,跨越中线向对侧生长的比例高于低级别患者,差异均有统计学意义(P<0.05),见表1。

表1 低级别与高级别胶质瘤患者的基线资料比较
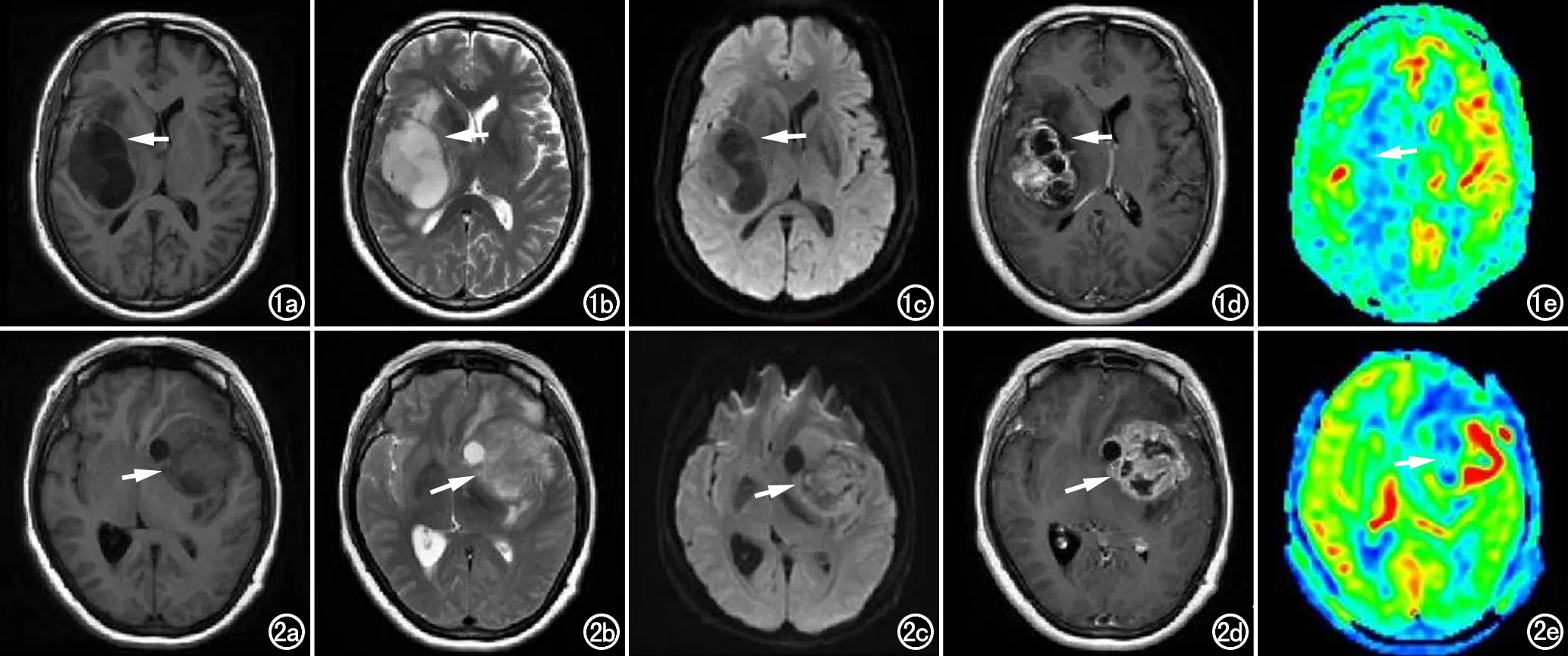
图1 男,40岁,少突星形细胞瘤(低级别WHO Ⅱ级)。a) T1WI示病灶呈低信号(箭); b) T2WI示病灶呈高信号(箭); c) DWI示病灶呈低信号(箭),少量水肿区域为等信号; d) DCE-MRI示混杂弱强化(箭),表现为低灌注; e) 3D-ASL示均匀强化低灌注(箭)。 图2 男,62岁,胶质母细胞瘤(高级别WHO Ⅳ级)。a) T1WI示病灶呈低信号(箭); b) T2WI示病灶呈高信号(箭); c) DWI示病灶呈等或稍高信号(箭),少量水肿区域为等信号; d) DCE-MRI示混杂明显强化(箭),表现为高灌注; e) 3D-ASL示病灶不均匀环形高灌注(箭)。
2.多模态MRI成像表现
低级别、高级别胶质瘤患者T1WI均呈低信号,T2WI均呈高信号(图1、2)。
低级别胶质瘤病灶的ADC与FA图均呈低信号(图1c);低级别胶质瘤病变周围水肿无或轻,13例低级别胶质瘤存在明显瘤周水肿,瘤周水肿区域呈低信号或等信号;10例低级别胶质瘤存在坏死囊变,坏死囊变区域为低信号;低级别胶质瘤瘤周水肿与坏死囊变区域与肿瘤病灶的分界不清晰。高级别胶质瘤病灶的ADC与FA图均呈等信号或高信号(图2c),高级别胶质瘤病变周围水肿重,55例高级别胶质瘤存在明显瘤周水肿,瘤周水肿区域呈低信号或等信号;28例高级别胶质瘤存在坏死囊变,坏死囊变区域为低信号;高级别胶质瘤瘤周水肿与坏死囊变区域与肿瘤病灶的分界较为清晰。
在DCE-MRI成像中,低级别胶质瘤增强后表现为无或弱强化40例,弱强化区域表现为低灌注(图1d);明显强化16例,明显强化区域表现为高灌注。高级别胶质瘤增强后表现为明显强化70例,明显强化区域表现为高灌注(图2d)。10例低级别胶质瘤、28例高级别胶质瘤的坏死囊变区域表现为低灌注或灌注缺失。
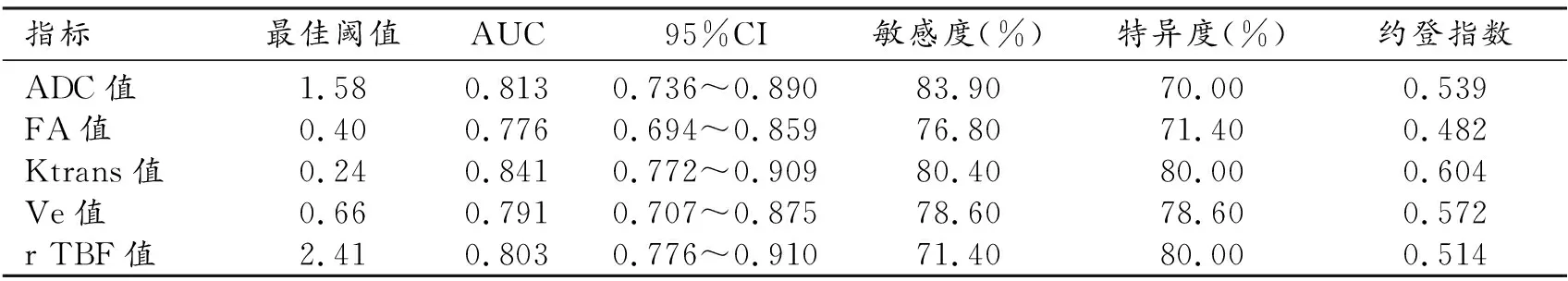
表2 多模态MRI各检测值的ROC曲线分析
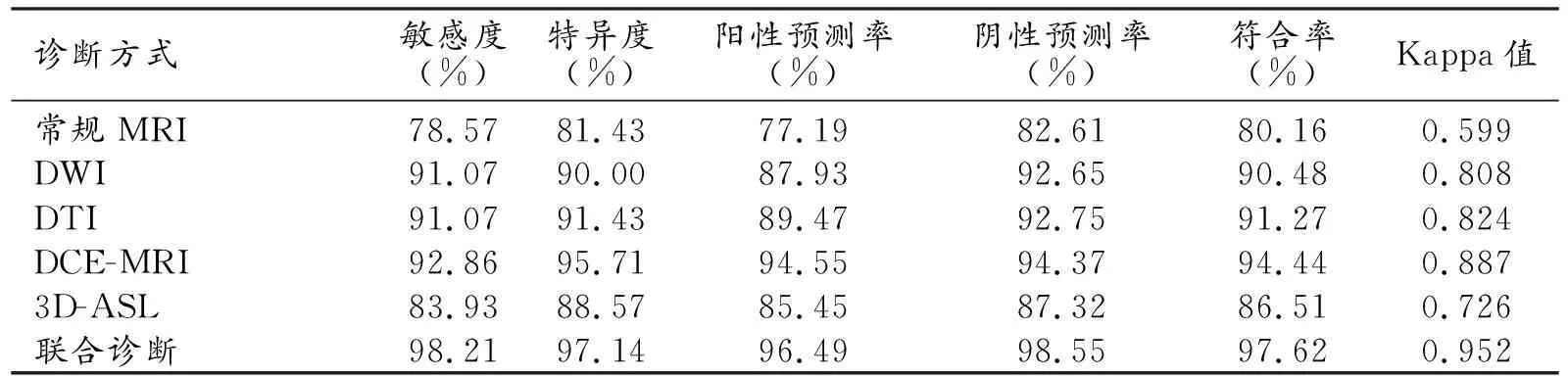
表3 MRI不同成像方式对低级别与高级别胶质瘤鉴别诊断的符合率与Kappa值
在3D-ASL成像中,低级别胶质瘤表现为不强化或均匀强化(图1e);高级别胶质瘤表现为不均匀环形高灌注,坏死囊变区域表现为低灌注或灌注缺失(图2e)。
3.不同病理分级患者各成像定量检测值比较
高级别胶质瘤患者ADC值(1.46±0.36)低于低级别患者(1.68±0.42),差异有统计学意义(t=3.165,P=0.002)。高级别胶质瘤患者DTI成像FA值(0.38±0.10)低于低级别患者(0.44±0.12),差异有统计学意义(t=3.061,P=0.003);高级别胶质瘤患者DCE-MRI成像Ktrans值(0.28±0.07)、Ve值(0.81±0.20)均高于低级别患者(0.19±0.05、0.50±0.15),差异有统计学意义(t=8.106,P<0.001;t=9.630,P<0.001)。高级别胶质瘤患者3D-ASL成像r TBF值(2.98±0.57)高于低级别患者(1.83±0.45),差异有统计学意义(t=12.331,P<0.001)。
4.多模态MRI各检测值与病理分级的相关性分析
DWI的ADC值、DTI的FA值与病理分级呈负相关(r=-0.522,r=-0.483,P<0.001)。DCE-MRI的Ktrans值、Ve值与病理分级呈正相关(r=0.639,r=0.642,P<0.001)。3D-ASL成像rTBF值与病理分级呈正相关(r=0.457,P<0.001)。
5.低级别与高级别胶质瘤鉴别诊断的多模态MRI各检测值的ROC曲线分析
DWI、DCE-MRI和3D-ASL的各种参数鉴别低级别与高级别胶质瘤的效能,其中Ktrans的诊断效能最高,ROC曲线下面积(area under curve,AUC)为0.841,敏感度为80.40%,特异度为80.00%(表2,图3)。
6.低级别与高级别胶质瘤鉴别诊断的多模态MRI与病理学的一致性分析
各种MRI序列鉴别诊断低级别与高级别胶质瘤与病理学的一致性由高到低依次为:DCE-MRI(Kappa=0.887)、DTI(Kappa=0.824)、DWI(Kappa=0.808)、3D-ASL(Kappa=0.726)、常规MRI序列(Kappa=0.599)。联合诊断鉴别诊断低级别与高级别胶质瘤的敏感度为98.21%,特异度为97.14%,符合率为97.62%,与手术病理高度一致(Kappa=0.952),见表3。
讨 论
胶质瘤恶性程度决定了手术方案选择以及患者预后,对于胶质瘤分级诊断,组织病理学检查具有明显的局限性。胶质瘤颅内穿刺活检为有创操作,一方面送检标本会受到取材偏倚影响,取材病变可能出现坏死囊变或钙化等情况,导致活检病理低估了肿瘤恶性程度,影响对病情的判断;另一方面,对于胶质瘤手术后需要接受放化疗患者,预后随访采用穿刺活检也会诱发脑出血、癫痫等并发症,增加医源性损害[10-11]。MRI作为一种安全无创的影像学检查,可以准确展现胶质瘤的位置、大小、边界等形态学结构特征,对软组织的分辨率更高,相比颅脑CT检查更具优势[12]。目前临床常见的扫描序列包括T1WI、T2WI、DWI、DCE-MRI以及3D-ASL等,临床普遍发现,单一序列检查均具有一定局限性,在常规序列基础上结合对比增强、扩散成像和灌注扫描,可弥补常规MRI的不足。
1.DWI与DTI的定量参数诊断
本研究分析多模态MRI扫描的定量参数对胶质瘤的诊断价值,结果显示,高级别胶质瘤DWI的ADC值、DTI的FA值均低于低级别,ADC值、FA值与病理分级呈负相关。冯贵堂等[13]研究与本文观点相似,认为各定量参数不仅与病理分级相关,还与肿瘤细胞的增殖活性相关。分析原因:DWI的原理是不同组织间水分子扩散情况存在差异,在DWI成像中,高级别胶质瘤对脑白质细胞亚结构的影响较大,水分子扩散受限,故而高级别胶质瘤呈等或高信号、低级别胶质瘤呈低信号,高级别胶质瘤DWI与DTI参数ADC值、FA值均较低[14-15]。
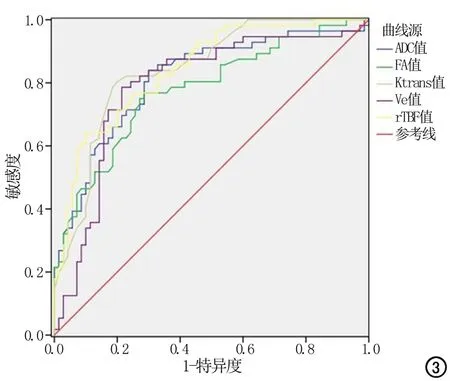
图3 多模态MRI各检测值的ROC曲线。
2.DCE-MRI的定量参数诊断
DCE-MRI成像是相对有创的检查方式,需要静脉注射对比剂,通过观察毛细血管T1驰豫率的改变,反映微血管密度,从而展示脑组织的灌注信息。本研究发现DCE-MRI的Ktrans值、Ve值均高于低级别,韩秋月等[16]研究与文本观点相似,也认为高级别胶质瘤的定量参数Ktrans值、Ve值高于低级别,并且Ktrans值的诊断效能较高。分析原因:在正常情况下,对比剂无法通过血脑屏障,Ktrans值(容量转移常数)理论上为零,而在胶质瘤病理状态下,血脑屏障被破坏,毛细血管通透性增加,Ktrans值升高,Ve值(血管外细胞外间隙容积比)也相应升高。有Meta分析研究表明[17-18],高级别胶质瘤恶性程度高,病灶组织中血管内皮生长因子水平较高,肿瘤侵袭生长迅速,进行DCE-MRI成像注射对比剂后,对比剂在血管内与血管外细胞间隙之间交换,体现为Ktrans值、Ve值的升高。本研究发现,低级别胶质瘤增强后主要表现为无或弱强化、低灌注,而高级别胶质瘤增强后表现为明显强化、高灌注,这与Liang等[19]、刘宵雪等[20]研究报道相符。
3.3D-ASL成像的定量参数诊断
3D-ASL成像是一种新型灌注成像技术,无需注射对比剂。DCE-MRI的原理是判断血脑屏障的破坏程度及毛细血管通透性来进行分级诊断高、低级别胶质瘤[21],而3D-ASL成像是基于氢质子自旋状态的像素成像,在快速自旋回波构架下,提高图像的信噪比,增强采集效率,减少伪影,增强扫描的准确性[22],在胶质瘤的分级诊断中具有良好的应用前景。本研究发现,高级别胶质瘤3D-ASL成像rTBF值高于低级别患者,rTBF值是指最大肿瘤血流量值与脑白质相对肿瘤血流量值的比值,高级别胶质瘤3D-ASL成像表现为不均匀环形高灌注,故rTBF值较高,这与王琳琳等[23]研究报道一致,该研究还指出,3D-ASL定量反映肿瘤微循环的灌注情况,诊断的符合率在90%以上,高于常规MRI。一项Meta分析研究表示[24],3D-ASL对505例胶质瘤患者的分级诊断敏感度为89%,特异度为80%,建议在胶质瘤常规MRI中可考虑实施3D-ASL。
4.多模态MRI的定性诊断
本研究探讨多模态MRI诊断与手术病理结果的一致性,结果显示,一致性由高到低依次为DCE-MRI、DTI、DWI、3D-ASL、常规T1WI与T2WI,联合诊断的敏感度为98.21%,特异度为97.14%,与手术病理高度一致。这说明在常规MRI的基础上联合DCE-MRI、DTI、DWI、3D-ASL多模式诊断有助于提高MRI的诊断敏感度,获取更多的诊断信息。邓慧媛等[25]研究表示,在T2WI、DWI和DCE-MRI三个序列中,DWI及DCE-MRI对高、低级别胶质瘤的鉴别效能较高。Yan等[26]研究运用直方图分析方法探讨各序列的诊断效能,发现DCE-MRI对胶质瘤分级和预后判断具有最佳的效能。
综上所述,多模态MRI定性与定量诊断高、低级别胶质瘤,显著提高与手术病理结果的一致性,对患者手术方案制定具有重要的参考价值。定量参数可以充分挖掘数据内部的深层信息,使胶质瘤的诊断更加客观、全面,也为传统定性诊断扩宽了思路。不过,本研究样本量有限,受临床条件限制,不同病理分级患者的样本不够均衡。在今后的研究中,笔者将更加全面收集患者多模态MRI诊疗资料,建立诊断模型,并观察多模态MRI对手术后放化疗患者预后随访、病情监测中的应用价值。

