NH2-UiO66/rGO 纳米复合材料的制备及其在铅离子和镉离子电化学传感中的应用
申 优 ,齐有啸 ,杨 星 ,张 波 ,万 均* ,王新星
(1.青岛科技大学a.环境与安全工程学院;b.化学与分子工程学院,山东 青岛 266042;2.鲁南制药集团股份有限公司,山东 临沂 276000;3.贵州红星发展股份有限公司,贵州 安顺 561206)
随着工业化的飞速发展,越来越多的含有毒性重金属离子的废物被排放到环境中。这些重金属离子在生态系统中是不可降解的、可转移的并且具有生物蓄积性,对人们的健康和生态环境构成有害风险[1-7]。因此,开发简单、快速、灵敏和可靠的检测技术对重金属离子的污染防治具有重要意义。
迄今为止,已经开发了一些方法用于测定重金属离子,例如原子吸收光谱法[8]、紫外可见光谱法[9]、离子色谱法[10]、电感耦合等离子体发射光谱法[11]和电化学传感方法等[12-17]。其中,电化学传感方法因仪器设备体积小、响应速度快、操作简单和灵敏度高等优点而在现场和实时检测中引起了广泛的关注。
金属有机骨架(MOFs),也称为多孔配位聚合物,是一类新兴的无机有机杂化多孔材料,由金属节点(金属离子或簇)和有机配体通过分子自组装形成[18-20]。由于其大的比表面积,超高的孔隙率,可调节的微孔结构和开放的金属活性位点,MOFs材料近年来成为了广大科研工作者的关注热点,在气体/能量存储[21]、吸附[22]、分离[23]、传感[24]、药物输送[25]和催化[26]等领域展现出广阔的应用前景。
在重金属离子检测领域,基于MOFs的传感器近年来正在不断探索。由于其多孔性质、可调节的结构和易于功能化等特点,MOFs材料在重金属离子的吸附、预浓缩和选择性识别方面显示出独特的优势[18]。目前,基于MOFs材料的重金属离子传感器已成功用于Fe3+、Fe2+、Cu2+、Al3+、Cr3+和Hg2+等的检测。但是,这些重金属离子传感器中的大多数是基于发光MOFs 的发光传感器。由于MOFs材料有着较低的电导率,在电化学重金属离子检测中受到了极大的限制。另外,大多数MOFs材料相对较低的结构稳定性也是限制其传感应用的重要原因[19]。
针对上述问题,采用具有高结构稳定性的MOFs材料并将MOFs与导电材料(碳材料、金属/金属氧化物纳米颗粒和导电聚合物等)偶合是一种有效的解决方法[6]。NH2-UiO66 是一种Zr基MOF(Zr-MOF),由六聚体Zr6O32和2-氨基对苯二甲酸连接体组成,有着较高的热稳定性和化学稳定性。本研究将NH2-UiO66与电化学还原的氧化石墨烯(r GO)复合,制备出了NH2-UiO66/r GO 纳米复合材料。基于NH2-UiO66的上述特性以及r GO的高电导率和大的比表面积[27],构建了用于同时检测Cd2+和Pb2+的电化学传感平台。
1 实验部分
1.1 试剂与仪器
所有药品均为分析纯,使用前未经过进一步处理。冰乙酸,天津市北辰方正试剂厂;无水乙酸钠、氯化镉(Cd Cl2),天津博迪化工股份有限公司;氯化铅(PbCl2),天津市市申泰化学试剂有限公司;无水乙醇,国药集团化学试剂有限公司;氧化石墨烯,先锋纳米有限公司;N,N-二甲基甲酰胺(DMF),天津市富宇精细化工有限公司;四氯化锆(Zr Cl4)、2-氨基对苯二甲酸,阿拉丁工业公司。本实验所用到的超纯水均由Milli-Q 系统提供。
扫描电子显微镜(SEM),SU 8010型,日本HITACHI公司;X 射线粉末衍射(XRD),D-MAX 2500/PC 型,日本Rigaku 公司;电化学工作站,CHI660E型,上海辰华仪器有限公司,使用玻碳电极(3 mm 直径,高仕睿联科技有限公司)及其修饰电极作为工作电极,饱和甘汞电极(高仕睿联科技有限公司)作为参比电极,铂片电极作为对电极(上海辰华仪器公司)组成三电极系统。
1.2 NH2-UiO66的制备
NH2-UiO66是根据WANG 等[6]报告的水热法合成的,并做了轻微改动。具体来说,在室温下将156 mg的2-氨基对苯二甲酸和150 mg的Zr Cl4溶解在18 m L的DMF中,然后超声处理10 min。然后,将混合物转移至内衬为特氟隆的50 m L不锈钢高压釜中,并添加1.35 m L的冰乙酸。密封所得的混合溶液,并在80 ℃的烘箱中放置12 h,然后在100 ℃的温度下放置24 h。自然冷却至室温后,通过以10 000 r·min-1离心5 min获得NH2-UiO66。将获得的产物在60 ℃下用无水乙醇洗涤3 d,并在真空烘箱中室温干燥。
1.3 复合材料NH2-UiO66/GO 的制备
首先,将1 mg的GO 分散在5 m L 的超纯水中,并对得到的悬浮液进行超声处理,直至变成均匀的溶液。随后,将5 mg的NH2-UiO66分散在上述混合物中,并超声分散10 min以获得NH2-UiO66与GO 的质量比为5∶1的均匀混合物。所得混合物表示为NH2-UiO66/GO,并保存在4℃下以备进一步研究。
1.4 NH2-UiO66/rGO 修饰电极的制备
将10μL 制备的NH2-UiO66/GO 悬浮液滴到新鲜的GCE表面上,并在室温下干燥,并将得到的修饰电极表示为NH2-UiO66/GO/GCE。为了获得NH2-UiO66/r GO 修饰的电极(NH2-UiO66/r GO/GCE),用恒电位法在0.1 mol·L-1HAc-Na Ac缓冲溶液(pH=5)中将NH2-UiO66/GO/GCE 电化学还原(还原电位为-1.2 V,还原时间为100 s)。此外,还制备了NH2-UiO66 修饰电极(NH2-UiO66/GCE)进行比较研究。NH2-UiO66 悬浮液的浓度为1 mg·m L-1。NH2-UiO66/GCE 的制备方法与NH2-UiO66/GO/GCE相同。
1.5 电化学表征参数
在包含1.0 mmol·L-1[Fe(CN)6]3-/4-的0.1 mol·L-1KCl溶液中进行了循环伏安(CV)实验和电化学阻抗(EIS)实验。CV 测量的扫描速率为0.1 V·s-1。对于EIS测量,振幅为0.005 V,电压频率范围为0.01 Hz至100 k Hz,施加的电压为0.2 V。使用差分脉冲阳极溶出伏安法(DPASV)检测Cd2+和Pb2+,振幅为0.05 V,脉冲宽度为0.05 s,脉冲周期为0.5 s。除非另有说明,否则沉积电位和沉积时间分别为-1.2 V 和100 s。
2 结果与讨论
2.1 材料的表征
图1 为NH2-UiO66 和NH2-UiO66/GO 复 合材料的SEM 照片。由图1 可以看出,NH2-UiO66具有典型的多面体形貌(图1(a)),尺寸为200~400 nm。如图1(b)所示,NH2-UiO66颗粒较为均匀地分散在GO 表面。而且,可以看出GO 和NH2-UiO66紧密接触,这有利于促进电荷转移和增加比表面积。该结果说明已经成功制备了NH2-UiO66/GO 复合材料。

图1 NH2-UiO66和NH2-UiO66/GO的SEM 照片Fig.1 SEM images of the NH2-UiO66 and NH2-UiO66/GO
NH2-UiO66和NH2-UiO66/GO 的XRD 谱图见图2。

图2 NH2-UiO66和NH2-UiO66/GO的XRD谱图Fig.2 XRD patterns of the NH2-UiO66 and NH2-UiO66/GO
图2中,NH2-UiO66的衍射峰与先前报道的结果吻合[6],并且峰型很尖锐,表明所制备的NH2-UiO66具有理想的晶体结构。NH2-UiO66/GO 与NH2-UiO66相比,除了略微的峰强度差异外,其他几乎相同,这表明在材料的复合过程中MOFs骨架结构保持完整,这也与SEM 结果一致。
2.2 电化学表征
通过CV 和EIS 研究了NH2-UiO66/r GO/GCE的电化学性质,并对裸GCE 和NH2-UiO66/GCE的电化学性质进行了比较见图3。图3(a)显示了上述电极在含有1.0 mmol·L-1[Fe-(CN)6]3-/4-的0.1 mol·L-1KCl溶液中的CV图。如图3(a)所示,在裸GCE 上观察到一对明确定义的[Fe(CN)6]3-/4-氧化还原峰。相比之下,[Fe(CN)6]3-/4-的氧化还原峰值电流在NH2-UiO66/GCE 上略有下降。与它们相比,在NH2-UiO66/r GO/GCE上观察到峰值电流显著增加,表明电极上的GO 已被成功还原,NH2-UiO66/r GO有利于加速电极表面的电子传递。
从图3(b)中可以看出,与裸GCE 相比,NH2-UiO66/GCE的EIS 图显示出更大的半圆弧,这表明NH2-UiO66/GCE 的电荷转移电阻更大。与上述两个电极相比,NH2-UiO66/r GO/GCE 的半圆弧明显减小,这表明NH2-UiO66/r GO 修饰的GCE可以大大增强电极表面的电荷转移动力学。该结果与CV 的结果一致,并证明r GO 的加入可以提高电极表面的电荷转移能力。
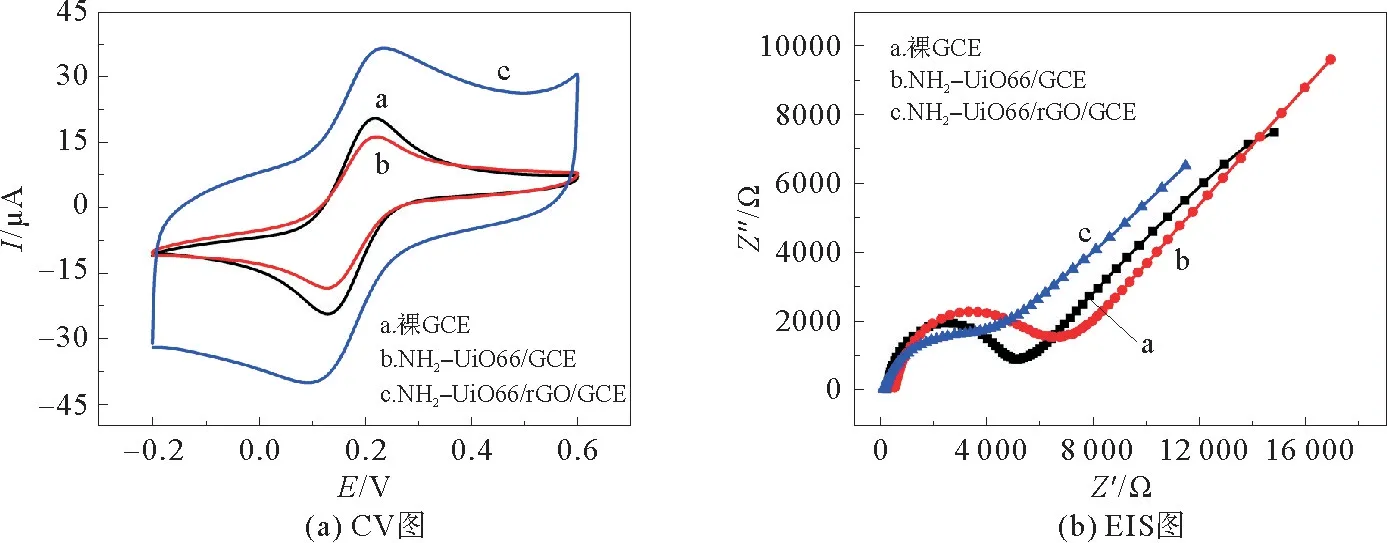
图3 不同电极在含有1.0 mmol·L-1[Fe(CN)6]3-/4-的0.1 mol·L-1 KCl溶液中的CV和EIS图Fig.3 CV and EIS plots of the different electrodes in a 0.1 mol·L-1 KCl solution containing 1.0 mmol·L-1(Fe(CN)6)3-/4-
在不同扫速(v)下,NH2-UiO66/r GO/GCE 在含有1.0 mmol·L-1[Fe(CN)6]3-/4-的0.1 mol·L-1KCl溶液中的氧化峰电流与v1/2的线性关系见图4。从图4可以看出,在10~200 m V·s-1的变化范围内,氧化峰电流随着扫速的平方根(v1/2)线性增加,线性相关系数为0.997 4,这表明NH2-UiO66/r GO/GCE表面发生的是扩散过程控制的氧化还原过程。

图4 NH2-UiO66/r GO/GCE在含有1.0 mmol·L-1[Fe(CN)6]3-/4-的0.1 mol·L-1 KCl溶液中氧化峰电流与v 1/2的线性关系图Fig.4 Linear relationship graph of oxidation peak current and v 1/2 of NH2-UiO66/r GO/GCE in 0.1 mol·L-1 KCl solution containing 1.0 mmol·L-1[Fe(CN)6]3-/4-
2.3 可行性研究
通过使用DPASV 测定Cd2+和Pb2+评估了裸GCE,NH2-UiO66/GCE和NH2-UiO66/r GO/GCE的传感性能见图5和图6。如图5所示,裸GCE 的DPASV 曲线中有两个阳极峰,它们位于-0.85和-0.60 V,分别对应于Cd2+和Pb2+的阳极溶出峰。与裸GCE相比,NH2-UiO66/GCE表现出明显增强的峰电流强度。该结果可能是由于NH2-UiO66的多孔结构和开放的结合位点有利于电极表面上Cd2+和Pb2+的预富集。对于NH2-UiO66/r GO/GCE,Cd2+和Pb2+的峰电流进一步增大。这应归因于NH2-UiO66/rGO/GCE具有增强的电荷转移能力。此外,这两个溶出峰均是尖峰,并且分离良好。因此,表明NH2-UiO66/r GO/GCE 可作为同时测定Cd2+和Pb2+的传感平台。

图5 不同电极在含5μmol·L-1 Cd2+和5μmol·L-1 Pb2+的0.1 mol·L-1 ABS(pH=5)中的DPASV图Fig.5 DPASV diagram of different electrodes in 0.1 mol·L-1 ABS(pH=5)containing 5μmol·L-1 Cd2+and 5μmol·L-1 Pb2+
为了验证使用NH2-UiO66/r GO/GCE 同时测定Cd2+和Pb2+的可行性,记录了不同浓度的Cd2+和Pb2+的DPASV 响应。如图6所示,Cd2+和Pb2+的峰电流信号随其浓度的增加而增加。这表明NH2-UiO66/rGO/GCE可用于同时检测Cd2+和Pb2+。

图6 NH2-UiO66/r GO/GCE在含不同浓度Cd2+和Pb2+的0.1 mol·L-1 ABS(p H=5)中的DPASV图Fig.6 DPASV diagram of the NH2-UiO66/r GO/GCE in 0.1 mol·L-1 ABS(pH=5)containing different concentrations of Cd2+and Pb2+
2.4 实验条件的优化
为了获得最优的电化学性能,对NH2-UiO66/rGO/GCE同时检测Cd2+和Pb2+的几个重要的实验条件(pH 值、沉积电位、沉积时间)进行了优化,见图7。
电解液的pH 值是影响重金属离子电化学响应的重要因素。在pH 值为3到7的0.1 mol·L-1ABS中探索了pH 对Cd2+和Pb2+电流响应的影响,见图7(a)。如图7(a)所示,随着pH 值从3增加到5,Cd2+和Pb2+的峰电流逐渐增加。当pH 从5继续增加到7时,Cd2+和Pb2+的峰电流减小。在pH=5时观察到Cd2+和Pb2+的最大电流信号。因此,在随后的实验中采用的电解质溶液pH 值为5。
图7(b)展示了沉积电位对Cd2+和Pb2+的峰电流响应的影响。结果表明,Cd2+和Pb2+的电流响应随着沉积电位从-0.9 V 变为-1.2 V 而增加。这是因为电位的负移促进了目标重金属离子在电极表面的还原。然而,电位的进一步负移(从-1.2 V 到-1.4 V)会对目标重金属离子的电流响应产生不利影响,并且电流响应的可重复性变差,这是由于析氢反应的发生阻碍了金属离子在电极表面的沉积。根据以上结果,选择-1.2 V 作为沉积电位。

图7 实验参数对0.1 mol·L-1 ABS中的Cd2+和Pb2+的电流信号的影响Fig.7 Influence of experimental parameters on the current signals of Cd2+and Pb2+in 0.1 mol·L-1 ABS
在50~300 s的范围内,研究了沉积时间对Cd2+和Pb2+电流信号的影响,结果如图7(c)所示。当沉积时间从50 s增加到200 s时,Cd2+和Pb2+的电流响应逐渐增加并在200 s处观察到最大的电流信号。随着沉积时间继续增加到300 s,Cd2+和Pb2+的峰电流信号逐渐减小,这可能是由于大量重金属离子的积累,导致活性位点饱和或不同金属离子之间的竞争反应[28]。因此,后续实验选择200 s作为沉积时间。
2.5 NH2-UiO66/rGO/GCE同时检测Cd2+和Pb2+
NH2-UiO66/r GO/GCE在含有不同浓度Cd2+和Pb2+的0.1 mol·L-1ABS (pH =5)中 的DPASV 图见图8。
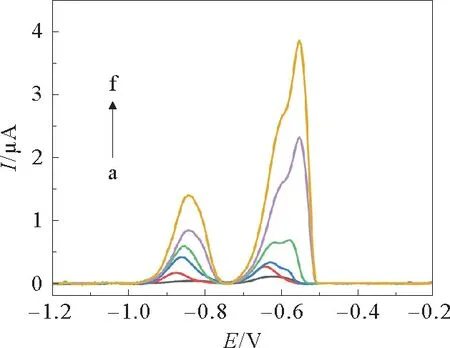
图8 NH2-UiO66/rGO/GCE在含有不同浓度Cd2+和Pb2+的0.1 mol·L-1 ABS(pH=5)中的DPASV图Fig.8 DPASV plot of the NH2-UiO66/rGO/GCE in 0.1 mol·L-1 ABS(pH=5)containing different concentrations of Cd2+and Pb2+
Cd2+和Pb2+的峰电流都随着浓度在0.05 μmol·L-1至2.0μmol·L-1的范围内增加而增加。所绘制的标准工作曲线如图9所示。从标准工作曲线中可以看出在0.05μmol·L-1至2.0μmol·L-1范围内,Cd2+和Pb2+的响应峰电流和浓度之间呈现出良好的线性关系,线性回归方程分别y=0.605 4x+0.141 4(R2=0.992 0)和y=1.681 6x+0.164 3(R2=0.998 8),其中x 是Cd2+和Pb2+的浓度(μmol·L-1),y 是响应峰电流(μA),R2是线性相关系数。基于信噪比为3(S/N =3)的方法,估算出Cd2+和Pb2+的检出限(LOD)分别为0.2和6 nmol·L-1。

图9 Cd2+和Pb2+相应的标准工作曲线Fig.9 Corresponding calibration curves of Cd2+and Pb2+,respectively
2.6 干扰离子检测
为了评估NH2-UiO66/r GO/GCE 对Cd2+和Pb2+测定的选择性,记录了这些目标金属离子与其他金属离子共存时的电流响应,见图10。选择的非目标金属离子包括Cu2+、Zr2+、K+、Fe3+、Mn2+、Al3+、Na+和Ca2+,其 中Cu2+、Zr2+、K+、Fe3+、Mn2+和Al3+的浓度为2.5μmol·L-1,比Cd2+和Pb2+高5 倍;Na+和Ca2+的浓度为0.5 mmol·L-1,比Cd2+和Pb2+高1 000倍。对比了干扰离子存在与不存在时Cd2+和Pb2+的峰电流I(Cd2+)代表不存在干扰离子时Cd2+的峰电流,I(Cd2++O)代表加入干扰离子后Cd2+的峰电流,I(Pb2+)代表不存在干扰离子时Pb2+的峰电流,I(Pb2++O)代表加入干扰离子后Pb2+的峰电流)。如图8所示,将上述干扰离子加入检测溶液中对Cd2+和Pb2+的信号影响均小于5%。这表明,所制备的电化学传感平台在Cd2+和Pb2+的测定中表现出良好的选择性。

图10 NH2-UiO66/r GO/GCE对Cd2+和Pb2+测定的选择性(Cu2+、Zr2+、K+、Fe3+、Mn2+和Al3+的浓度为2.5μmol·L-1,Na+和Ca2+的浓度为0.5 mmol·L-1)Fig.10 Selectivity of the NH2-UiO66/rGO/GCE for the determination of Cd2+and Pb2+(The concentration of Cu2+,Zr2+,K+,Fe3+,Mn2+and Al3+is 2.5μmol·L-1,and the concentration of Na+and Ca2+is 0.5 mmol·L-1)
2.7 重现性和稳定性
为了评估NH2-UiO66/r GO/GCE检测Cd2+和Pb2+的重现性,准备了7 个平行电极并进行了测试,结果见图11显示。I(Cd2+)和I(Pb2+)的相对标准偏差(RSD)分别为5.9%和6.5%。结果表明,NH2-UiO66/r GO/GCE具有良好的重现性。为了研究NH2-UiO66/r GO/GCE的稳定性,将电极在4℃储存20 d,结果如图12所示。Cd2+和Pb2+在该电极上的电流信号仍为初始峰电流的89.6%和93.5%。这表明制备的NH2-UiO66/rGO/GCE 表现出良好的稳定性。

图11 NH2-UiO66/r GO/GCE的重现性Fig.11 Reproducibility of NH2-UiO66/r GO/GCE

图12 NH2-UiO66/rGO/GCE的稳定性Fig.12 Stability of NH2-UiO66/rGO/GCE
2.8 实际样品检测
为了评估所开发的电化学传感平台在实际样品检测中的适用性,在从当地水源(自来水和污水)收集的两个样品中进行了加标回收测试。污水水样在测试前使用0.45μm 滤膜过滤以除去其中的悬浮颗粒。分别使用自来水和处理后的污水水样来配制0.1 mol·L-1ABS溶液(pH=5),并通过标准添加方法制备了两种浓度(即0和0.5μmol·L-1)的自来水和污水样品,用于回收率评估,结果汇总在表1中。Cd2+和Pb2+在自来水中的回收率分别为98%和102%,在污水中的回收率分别为122% 和138%。从表中可以看出Cd2+和Pb2+测定结果的RSD 均小于6%。结果表明,本研究提出的电化学传感平台在真实水样检测中具有广阔的应用前景。

表1 实际水样中Cd2+和Pb2+的回收率实验结果Table 1 Recovery experiment results of Cd2+and Pb2+detection in real water samples
3 结 论
构建了一种基于NH2-UiO66/r GO 纳米复合材料的电化学传感平台,用于同时测定Cd2+和Pb2+。NH2-UiO66具有较大的比表面积以及丰富的活性位点,可促进重金属离子的吸附和预富集。r GO 的引入提高了MOFs 材料的导电性。基于NH2-UiO66 和r GO 的协同作用,可以在NH2-UiO66/r GO/GCE上灵敏地同时测定Cd2+和Pb2+。Cd2+和Pb2+的LOD分别为0.2和6 nmol·L-1。此外,该传感平台还具有良好的选择性、重现性和稳定性,在自来水的回收测试中也证明了其实用性。

