丹参通络解毒汤对缺氧/复氧大鼠心肌微血管内皮细胞自噬及血管生成的影响
刘仕成,李鑫辉,陈欣
丹参通络解毒汤对缺氧/复氧大鼠心肌微血管内皮细胞自噬及血管生成的影响
刘仕成,李鑫辉,陈欣
湖南中医药大学,湖南 长沙 410208
观察丹参通络解毒汤药物血清对缺氧/复氧大鼠心肌微血管内皮细胞(CMECs)自噬及血管生成的影响,探讨其作用机制。建立CMECs缺氧/复氧损伤模型,将CMECs随机分为空白组、模型组、丹参通络解毒汤药物血清组、3-MA自噬抑制剂组,除空白组外其余各组均置于低糖无血清DMEM培养基中培养,同时置于37 ℃、94%N2、1%O2、5%CO2培养箱中缺氧2 h,换正常DMEM培养基,给氧3 h,再给予相应药物干预。倒置显微镜观察CMECs细胞生长及形态,检测试剂盒测定培养液中乳酸脱氢酶(LDH)活性,Western blot检测自噬相关蛋白Beclin 1、p62及血管内皮生长因子(VEGF)表达,免疫荧光检测CMECs细胞特征性表面标志物蛋白CD34表达。与空白组比较,模型组CMECs细胞坏死程度增加,培养液中LDH含量明显增加(<0.01),Beclin 1、VEGF蛋白表达明显升高(<0.01,<0.05),p62蛋白表达明显降低(<0.01),CD34蛋白红色荧光明显减弱;与模型组比较,丹参通络解毒汤药物血清组和3-MA自噬抑制剂组CMECs细胞坏死程度减轻,培养液中LDH含量明显减少(<0.01),Beclin 1蛋白表达明显降低(<0.01),p62、VEGF蛋白表达明显升高(<0.01,<0.05),CD34蛋白红色荧光明显增强。丹参通络解毒汤能适度抑制缺氧/复氧CMECs细胞自噬,从而促进血管生成,达到保护CMECs细胞的目的。
丹参通络解毒汤;心肌缺血再灌注损伤;心肌微血管内皮细胞;自噬;血管生成;大鼠
急性心肌损伤(acute myocardial injury,AMI)后缺血组织血管骤然再通与血液复流,将进一步加重病理损伤,即心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)。目前,再灌注引起血管内皮细胞结构损伤和功能异常、炎症因子激活及自噬性死亡等MIRI已成为心血管领域研究热点[1-2]。研究发现,再灌注可诱发心肌细胞过度自噬,使凋亡抑制基因Bcl-2表达下调,增加细胞凋亡,扩大梗死面积,降低左室射血分数,影响左室重构[3]。研究表明,心肌缺血早期,自噬被激活,促进血管生成;再灌注期,自噬进一步加剧反而抑制血管生成,心肌损伤加重[4]。目前,如何运用中医药达到治疗性血管生成作用,促进药物建立侧支循环即实现“药物搭桥”已成为治疗心肌缺血的新方向。课题组前期研究发现,丹参通络解毒汤能适度抑制MIRI引起的过度自噬以减轻心肌损伤,并可联合内皮祖细胞上调血管内皮生长因子(VEGF)、碱性成纤维生长因子(bEGF),促进血管生成以保护受损心肌[5-6]。本实验在前期研究基础上,观察丹参通络解毒汤药物血清对缺氧/复氧心肌微血管内皮细胞(CMECs)自噬及血管生成相关因子的影响,探讨其作用机制。
1 材料与方法
1.1 细胞株和动物
大鼠CMECs购于武汉普诺赛生命科技有限公司。SPF级雄性SD大鼠30只,体质量220~260 g,购于湖南斯莱克景达实验动物有限公司,动物许可证号SYXK(湘)2016-0002。常规饲养于湖南中医药大学动物实验中心SPF级动物房。
1.2 药物
丹参通络解毒汤(丹参15 g,生地黄15 g,金银花10 g,连翘10 g,玄参15 g,麦冬12 g,黄连6 g,栀子15 g,檀香10 g,黄芪30 g,当归10 g,川芎10 g,红花10 g,水蛭6 g),饮片购于湖南中医药大学附属第一医院中药房,常规煎煮2次,合并2次药液,浓缩为含原药材4 g/mL,置于4 ℃冰箱保存备用。
1.3 主要试剂与仪器
大鼠CMECs完全培养基(普诺赛,货号CM-R135),0.25%胰酶-EDTA(Gibco,货号25200056),CCK8试剂盒(Biosharp,货号BS350B),PBS(Solarbio,货号blz-0099),乳酸脱氢酶(LDH)试剂盒(上海联迈生物工程有限公司,货号GWB-4F1107),RIPA裂解液(武汉皮诺飞生物科技有限公司,货号P2002),3-甲基腺嘌呤(3-MA,HyClone,货号S24823-1g),胎牛血清(FBS,HyClone,货号SH30109.03),青链霉素混合液(上海吉至生化有限公司,货号AP1400-100),VEGF抗体(Sino Biological,货号101465-MM02),Beclin 1抗体(Sino Biological,货号201473-T38),p62抗体(Fine Test,货号FNab06087),HRP goat anti-mouse IgG(Proteintech,货号SA00001-1),HRP goat anti-rabbit IgG(Proteintech,货号SA00001-2)。CO2饱和湿度细胞培养箱(美国Thermo),倒置显微镜(日本Olympus公司,CKX53),-70 ℃低温冰箱(美国Thermo Fisher),低温高速离心机(德国Eppendorf,5427R),恒温水浴箱(上海精宏,DK-SD),酶标仪(Molecular Devices,HBS- 1096A),倒置荧光显微镜(日本Nikon)。
1.4 药物血清制备
将30只大鼠随机分为对照血清组和药物血清组,各15只。药物剂量按人(60 kg)与动物体表面积换算,灌胃丹参通络解毒汤药液3.9 mL/(kg•d)[相当于原药材15.6 g/(kg•d)],对照血清组给予等体积蒸馏水灌胃,2次/d,连续7 d。末次给药2 h后,大鼠腹腔注射水合氯醛麻醉,腹主动脉插管,用无菌不抗凝管采血,室温静置2 h,3000 r/min离心15 min,取上清液,0.22 μm滤膜过滤,再56 ℃灭活30 min,分装,-20 ℃冰箱中保存,用DMEM培养基稀释成相应体积分数的药物血清备用。
1.5 缺氧/复氧细胞模型建立
将CMECs加入含1%青链素双抗混合液及10%FBS的高糖DMEM培养基,置于37 ℃、5%CO2饱和湿度培养箱培养,待细胞生长80%~90%,弃去原培养液,PBS冲洗3次,替换成无血清低糖DMEM培养基,置于37 ℃,气体体积分数为94%N2、1%O2、5%CO2培养箱中缺氧2 h,再复氧并换正常DMEM培养基,置于37 ℃、95%O2、5%CO2培养箱培养3 h。
1.6 CCK8法筛选药物血清最佳实验浓度
取对数生长期CMECs,加胰酶消化,加培养液终止消化并离心,弃上清液,PBS重悬,制成密度为5×104个/mL细胞悬液,接种于96孔板,贴壁后配制体积分数为5%、10%、15%、20%、25%药物血清,空白组加等量含正常大鼠血清的DMEM培养基,每孔加100 μL完全培养基和CCK8溶液10 μL,避光37 ℃孵育2 h,于酶标仪波长450 nm处检测吸光度(OD值),计算最佳药物血清浓度。
1.7 分组及给药
采用随机数字表法将处于对数生长期的CMECs随机分为空白组、模型组、丹参通络解毒汤药物血清组(药物血清组)、3-MA自噬抑制剂组(3-MA组)。空白组用含10%FBS的DMEM培养基培养,置于37 ℃、95%空气、5%CO2培养箱中培养28 h;模型组用低糖无血清DMEM培养基培养,置于37 ℃、94%N2、1%O2、5%CO2培养箱中缺氧2 h,换正常DMEM培养基再给氧3 h;药物血清组按模型组方法造模后,加最佳药物血清浓度培养基培养24 h;3-MA组加3-MA(10 mmol/L)预培养30 min后造模。
1.8 细胞形态观察
倒置显微镜观察CMECs生长及形态变化。
1.9 比色光度法检测乳酸脱氢酶含量
实验结束后收集细胞上清液,胰酶消化,离心后取上清液,按照试剂盒说明书进行操作,测定LDH含量。
1.10 Western blot检测Beclin 1、p62及血管内皮生长因子蛋白表达
PBS洗涤细胞,加入RIPA裂解液,冰上裂解30 min,4 ℃、12 000 r/min离心5 min,收集上清液,BCA法测定蛋白浓度并定量;蛋白样品上样,10%SDS聚丙烯酰胺凝胶电泳分离蛋白,转移至PVDF膜,迅速置于TBS液,室温含5%脱脂奶粉TBST中封闭1 h;洗涤后用一抗、二抗按相应比例稀释后孵育,TBST洗3次,每次10 min,用ECL-Plus试剂发光,Image J 6.0分析蛋白表达条带。
1.11 免疫荧光检测CD34蛋白表达
细胞胰酶消化制成细胞悬液,1×105个/孔接种于6孔板,按“1.7”项下方法培养。PBS洗3次,每次4 min;4%多聚甲醛固定20 min;PBS洗3次,每次5 min;常温滴加200 μL FBS,室温孵育封闭1 h;滴加50~100 μL一抗,室温避光孵育过夜,PBS洗3次,每次4 min;滴加50~100 μL二抗,室温避光孵育1 h;最后滴加50~100 μL DAPI染核,室温避光孵育10 min。同时做同型对照,不加一抗,步骤同前,荧光显微镜观察并拍照。
1.12 统计学方法
2 结果
2.1 细胞形态
空白组细胞形态规则,呈梭形或多角形,贴壁生长良好,折光性强,悬浮细胞极少;模型组细胞形态不规则,并有大量悬浮细胞,细胞间隙增大,折光性减弱,胞质中有空泡和颗粒;药物血清组及3-MA组细胞大部分形态规则,细胞间隙不明显,折光性良好,细胞质可见少量零散颗粒,有少量悬浮细胞。
2.2 药物血清最佳实验浓度筛选结果
丹参通络解毒汤药物血清干预后,与空白组比较,不同浓度药物血清对CMECs细胞活力有明显影响(<0.05),其中15%药物血清效果最佳,见表1。因此,后续实验选用15%药物血清。

表1 不同浓度丹参通络解毒汤药物血清对大鼠CMECs细胞活力的影响(±s)
注:与空白组比较,*<0.05,**<0.01
2.3 丹参通络解毒汤对模型细胞乳酸脱氢酶含量的影响
与空白组比较,模型组、药物血清组、3-MA组CMECs LDH含量明显增加(<0.01);与模型组比较,药物血清组和3-MA组LDH含量明显减少(<0.01)。结果见图1。
2.4 丹参通络解毒汤对模型细胞Beclin 1、p62、血管内皮生长因子表达的影响
与空白组比较,模型组CMECs Beclin 1、VEGF蛋白表达明显升高,p62蛋白表达明显降低(<0.01);与模型组比较,药物血清组、3-MA组CMECs Beclin 1蛋白表达明显降低,p62、VEGF蛋白表达明显升高(<0.01,<0.05)。结果见图2。
2.5 丹参通络解毒汤对模型细胞CD34表达的影响
免疫荧光染色显示,细胞核染成蓝色荧光,CD34着色于细胞质,CD34阳性表达为红色荧光。与空白组比较,模型组CMECs荧光强度减弱,CD34蛋白表达降低;与模型组比较,药物血清组和3-MA组CMECs红色荧光明显增强,CD34蛋白表达明显升高。结果见图3。
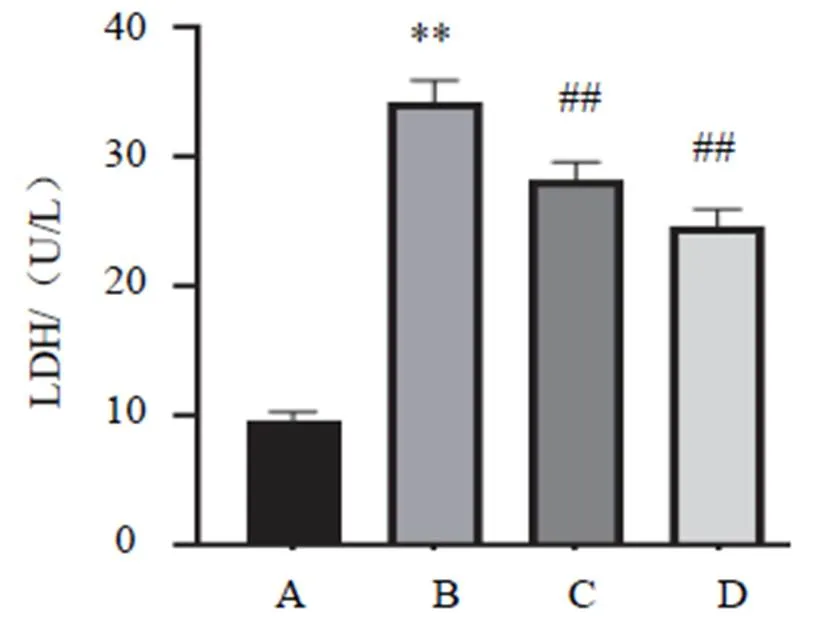
注:A.空白组;B.模型组;C.药物血清组;D. 3-MA组;与空白组比较,**P<0.01;与模型组比较,##P<0.01

注:A.空白组;B.模型组;C.药物血清组;D. 3-MA组;与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01
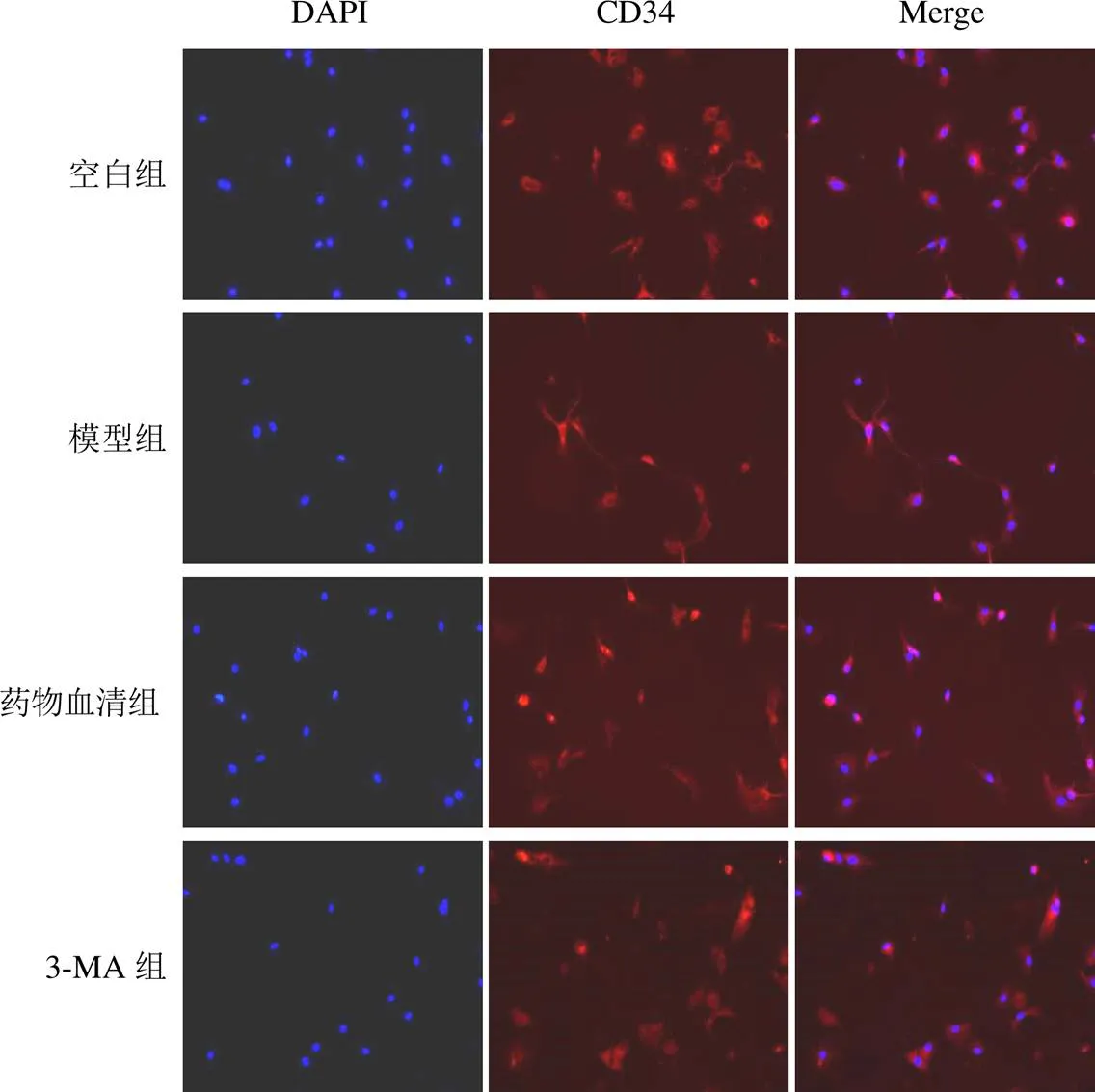
图3 各组大鼠CMECs CD34蛋白阳性表达(免疫荧光,×200)
3 讨论
MIRI属中医学“胸痹”范畴,总体呈气阴亏虚、热毒血瘀、心脉受损之本虚标实之证。本研究针对复杂病机,发挥中药多靶点、多向调节的优势,取《温病条辨》清营汤与《时方歌括》丹参饮合方加减组成丹参通络解毒汤,该方损益结合、标本兼治,主以治标,共奏凉营解毒、活血通络、益气养阴之效[7]。
心肌细胞受损或坏死时,LDH从受损细胞中释放进入血液,作为检测心肌细胞损伤的常规指标,LDH具有较强的特异性。本研究发现,模型组CMECs明显受损,丹参通络解毒汤药物血清组缺氧/复氧后CMECs LDH含量明显减少,提示本方可改善缺氧/复氧后的CMECs损伤。
自噬是维持真核细胞内稳态的重要机制之一,常态下,自噬保持正常或稍高水平,呈适度状态,以调节、稳定细胞结构与功能[8]。应激状态下,自噬能将功能异常的蛋白质和受损或老化细胞器降解成氨基酸、核苷酸等[9]。在感染、炎症反应、氧化应激、缺血缺氧等情况下,诱发细胞过度自噬进而损伤细胞或诱导细胞自噬性死亡[10-11]。自噬启动因子Beclin 1与Bcl-2/Bcl-XL解离并激活Ⅲ型PI3K是启动自噬的关键。相较于心肌缺血期,Beclin l蛋白在MIRI期大量增加,阻碍自噬体的清除,加重心肌细胞的凋亡[12]。一般情况下,p62蛋白水平高低与自噬活性成反比,即自噬减弱而p62表达升高,p62蛋白增多表明自噬/溶酶体降解途径受到抑制[13]。Western blot检测结果显示,药物血清组和3-MA组较模型组均能下调自噬蛋白Beclin 1的表达,上调自噬蛋白p62的表达,在一定程度上可抑制CMECs自噬。
血管生成是在促血管生成因子和抑制因子协调作用下,使血管内皮细胞激活、增殖、迁移形成新的血管网络的复杂过程。缺血缺氧时,机体应激性地通过促血管生成因子建立侧支循环以改善心肌损伤[14]。研究表明,中药能加速代偿循环血液供应,增加微血管密度数量,改善梗死区缺血缺氧,减少心肌细胞损伤与凋亡,缩小梗死面积,改善心功能[15-16]。VEGF是一种高度特异性的促血管内皮细胞生长因子。在低氧环境下,VEGF与内皮细胞膜上的受体结合,引起受体的自身磷酸化,从而激活有丝分裂原活化蛋白激酶,实现VEGF的有丝分裂原特性,诱导内皮细胞增生。同时VEGF明显促进血管内皮再生,提高血管通透性,促进血管内皮细胞迁移、增殖和血管形成等。CD34是主要表达在人或鼠的血管内皮细胞和造血干细胞表面的跨膜糖蛋白,是内皮细胞表面特征性标记物之一,其表达水平能较好地反映内皮细胞状态,又能反映新生血管程度。Western blot检测结果显示,药物血清组和3-MA组较模型组VEGF表达升高,且药物血清组优于3-MA组;免疫荧光染色显示,药物血清组和3-MA组较模型组CD34蛋白表达升高。
综上,本研究结果表明,丹参通络解毒汤能适度抑制缺氧/复氧CMECs自噬,进而更好地促进血管生成,达到保护CMECs的作用。
[1] DONG Q, LI J, WU Q F, et al. Blockage of transient receptor potential vanilloid 4 alleviates myocardial ischemia/reperfusion injury in mice[J]. Sci Rep,2017,7:42678.
[2] LU S, ZHANG Y, ZHONG S, et al. N-n-butyl haloperidol iodide protects against hypoxia/reoxygenation injury in cardiac microvascular endothelial cells by regulating the ROS/MAPK/Egr-1 pathway[J]. Front Pharmacol,2016,7:520.
[3] HAUSENLOY D J, YELLON D M. Myocardial ischemia-reperfusion injury:a neglected therapeutic target[J]. J Clin Invest,2013, 23(1):92-100.
[4] FANG B, LI X Q, BAO N R, et al. Role of autophagy in the bimodal stage after spinal cord ischemia reperfusion injury in rats[J]. Neuro Science,2016,328:107-116.
[5] 王静雯.丹参通络解毒汤对心肌缺血再灌注损伤大鼠自噬的实验研究[D].长沙:湖南中医药大学,2019.
[6] 肖青.丹参通络解毒汤联合内皮祖细胞移植对心肌缺血再灌注损伤大鼠促血管生成机制研究[D].长沙:湖南中医药大学,2018.
[7] 李鑫辉,王静雯,肖青,等.丹参通络解毒汤对冠心病不稳定型心绞痛患者黏附分子的影响[J].湖南中医药大学学报,2018,38(2):136-140.
[8] SALAZAR M, CARRACEDO A, LORENTE M, et al. Cannabinoid action induces autophagy-mediated cell death through stimulation of ER stress in human glioma cells[J]. Journal of Clinical Investigation,2009,119(5):1359-1372.
[9] 伍思霖,黄玉莹,丁海林,等.自噬、自噬性细胞死亡与肿瘤的研究进展[J].生命科学,2017,29(8):763-768.
[10] ZHANG D Y, QIU W, WANG P, et al. Autophagy can alleviate severe burn-induced damage to the intestinal tract in mice[J]. Surgery, 2017,162(2):408-417.
[11] SHENG R, QIN Z H. The divergent roles of autophagy in ischemia and preconditioning[J]. Acta Pharmacol Sin,2015,36(4):411-420.
[12] MA X, LIU H, FOYIL S R, et al. Impaired autophagosome clearance contributes to cardiomyocyte death in ischemia/reperfusion injury[J]. Circulation,2012,125(25):3170-3181.
[13] BEN Y A, TAJEDDINE N, TAILLER M, et al. A fluorescence microscopic and cytofluorometric system for monitoring the turnover of the autophagic substrate p62/SQSTM1[J]. Autophagy, 2011,7(8):883-891.
[14] LIBERIS A, STANULOV G, CHAFOUZ A E, et al. Pre-eclampsia and the vascular endothelial growth factor:a new aspect[J]. Clinical and Experimental Obstetrics and Gynecology,2016,43(1):9-13.
[15] 黄明艳,刘超,王阶.活血化瘀中药促内皮祖细胞血管修复和新生研究进展[J].中国中医药信息杂志,2019,26(7):141-144.
[16] 曾晓,闫喜明,赵倩.单味中药对血管新生的促进作用研究进展[J].山东医药,2019,59(20):110-112.
Effects ofDecoction on Autophagy and Angiogenesis of Cardiac Microvascular Endothelial Cells in Rats with Hypoxia/Reoxygenation
LIU Shicheng, LI Xinhui, CHEN Xin
To investigate the effects ofDecoction containing serum on autophagy and angiogenesis of cardiac microvascular endothelial cells (CMECs) in rats with hypoxia/reoxygenation (H/R); To explore the mechanism of action.H/R injury model of CMECs was established. CMECs were randomly divided into blank group, model group,Decoction containing serum group, and 3-MA autophagy inhibitor group. Except the blank group, all the other groups were cultured in low-sugar and serum-free DMEM medium, and placed in a 37 ℃, 94% N2, 1% O2, 5% CO2incubator under hypoxia for 2 h, and then replaced with normal DMEM medium. Oxygen was given for 3 hours, and then the corresponding drugs were given. The cell growth and morphology of CMECs were observed with an inverted microscope, and the activity of lactate dehydrogenase (LDH) in the culture medium was detected with the detection kit. Western blot was used to detect the expressions of autophagy-related proteins Beclin 1, p62 and VEGF, and immunofluorescence was used to detect the expression of CD34, a characteristic surface marker of CMECs.Compared with the blank group, the degree of cell necrosis, the LDH content in the cultrue medium, Beclin 1 and VEGF protein expressions in the model group increased (<0.01,<0.05), while p62 protein expression decreased (<0.01), and the red fluorescence of CD34 protein was significantly reduced in the model group. Compared with the model group, the degree of cell necrosis of CMECs, the LDH content in the culture medium, Beclin 1 protein expression were significantly reduced (<0.01), while p62 and VEGF protein expression significantly increased (<0.01,<0.05), and the red fluorescence of CD34 protein was significantly increased in theDecoction containing serum group and 3-MA autophagy inhibitor group.Decoction can moderately inhibit the autophagy of H/R CMECs, so as to better promote angiogenesis and protect CMECs.
Decoction; myocardial ischemia reperfusion injury; cardiac microvascular endothelial cells; autophagy; angiogenesis; rats
R285.5
A
1005-5304(2021)06-0065-05
10.19879/j.cnki.1005-5304.202010121
国家自然科学基金(82074392);湖南省自然科学基金(2019JJ40210);湖南省教育厅科学研究项目(15A143);湖南省中医药科研计划(201559、201790);长沙市科技计划(kq1706058);全国名老中医药专家传承工作室建设项目(2019年)
李鑫辉,E-mail:2208637467@qq.com
(2020-10-12)
(2020-12-16;编辑:华强)

