经腹膜后入路腹腔镜下腔静脉滤器取出7例*
王海东 刘建龙 朱晓斐 刘振华 李贵忠 李 玮 周 宁 满立波
(北京积水潭医院泌尿外科,北京 100096)
下肢深静脉血栓脱落可导致肺栓塞,危及生命。目前通常使用下腔静脉滤器预防致死性肺栓塞发生,包括临时性滤器、可回收滤器和永久性滤器。可回收下腔静脉滤器因既可拦截血栓,又可避免临时性滤器和永久性滤器带来的诸多并发症而成为目前的主流,但其回收率并不高,仅为34%~54%[1,2]。对于腔内滤器回收失败者,目前通常放弃回收或采用开放手术取滤器,通过腹腔镜行滤器取出的报道很少。我们于2018 年报道3 例腹腔镜下腔静脉滤器取出,其中经腹腔入路2 例,经腹膜后入路1 例[3,4],至2020 年7 月又完成6 例经腹膜后入路,现将腹膜后入路7 例报道如下。
1 临床资料与方法
1.1 一般资料
本组7 例,男6 例,女1 例。年龄24~58 岁,中位数48 岁。因下肢静脉及髂静脉血栓形成而预防性置入滤器5 例,因下肢深静脉血栓形成导致肺栓塞而置入滤器2 例,其中1 例2 次肺栓塞置入滤器2个,腔内仅取出1 个。滤器种类:Celect 滤器(美国COOK 公司)5 例,Denali 滤器(美国BARD 公司)2例。滤器留置体内时间41~440 d,中位数114 d。腔内取滤器失败1 次2 例,2 次2 例,3 次3 例。均行CT 检查,为了术中滤器头的精确定位,我们将滤器头端位于肾静脉上缘与下腔静脉交界处水平以上称为肾静脉上型(图1),滤器头端位于肾静脉下缘与下腔静脉交界处水平以下称为肾静脉下型,滤器头端正对肾静脉汇入下腔静脉水平称为肾静脉型。本组肾静脉上型2 例,肾静脉下型1 例,肾静脉型4 例;滤器头端均紧贴下腔静脉后外侧壁(图2)。
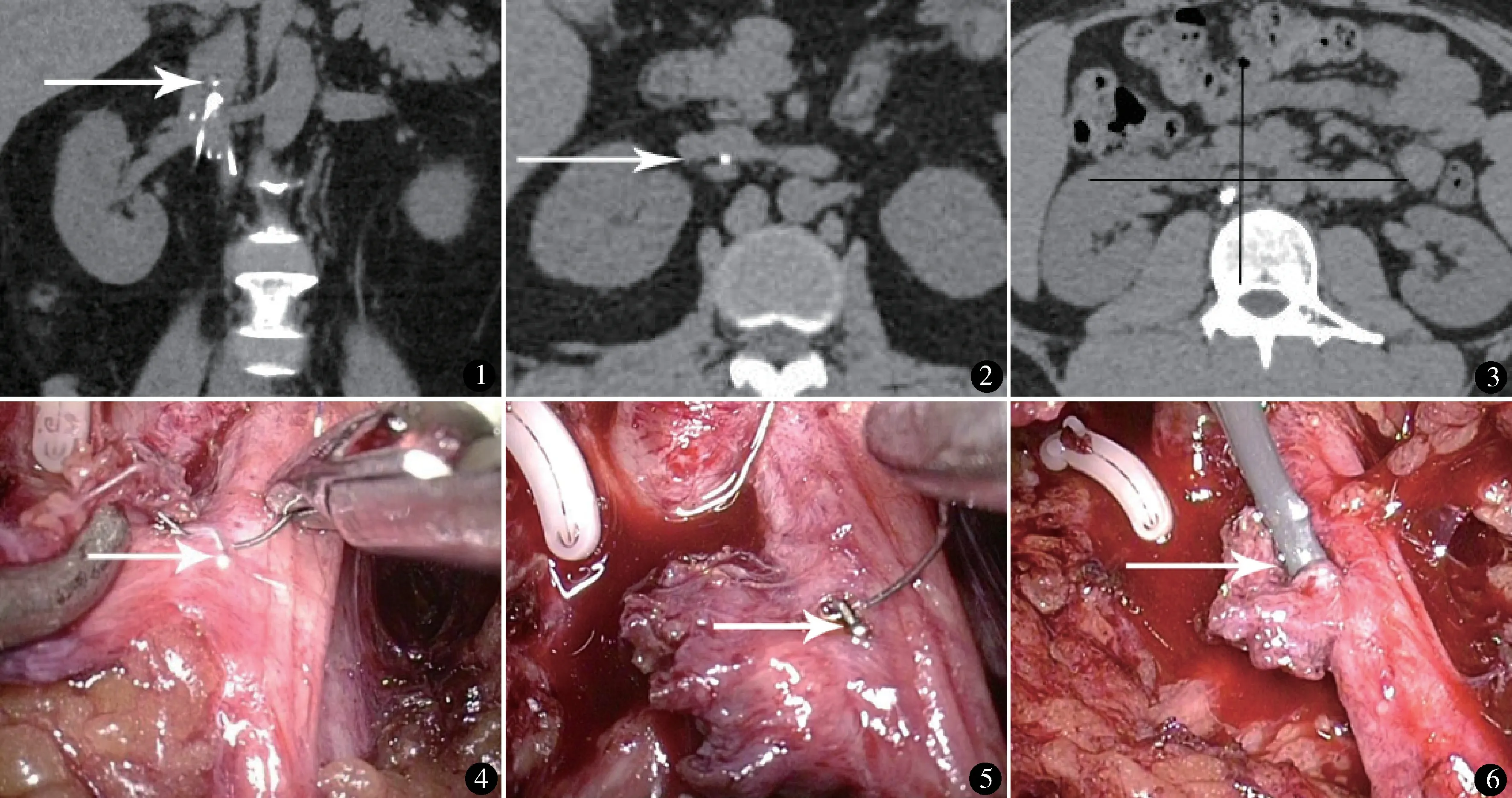
图1 肾静脉上型:滤器头端位于肾静脉上缘与下腔静脉交界处水平以上 图2 滤器头端紧贴下腔静脉后外侧壁 图3 以下腔静脉中心为原点建立坐标系,滤器头位于第三象限 图4 隐约可见顶起下腔静脉壁的滤器钩 图5 切开下腔静脉壁,即可见滤器钩 图6 抓捕环套住滤器回收钩,回收滤器至血管鞘内
病例选择标准:可回收滤器经血管腔内套取失败,并且滤器头位于下腔静脉后外侧壁(准确的说,以下腔静脉中心为原点建立坐标系,滤器头位于第三象限)(图3)。
1.2 手术方法
术前穿弹力袜,预防术中血栓形成。气管插管全身麻醉,左侧卧位,升高腰桥,扩大肋弓与髂嵴间的距离。于右侧腋后线肋缘下切开皮肤2~3 cm,用大弯钳突破深层肌肉进行扩张,手指推开腹膜,建立放置球囊的空间,置入用手套自制的球囊,充气500~600 ml,保持球囊压力1 min 左右,放空球囊,建立腹膜后空间。在手指引导下分别于腋前线肋缘下及腋中线髂嵴上2 cm 各置入1 个10 mm trocar,需要时于右髂前上棘上2~3 cm 加1 个5 mm trocar。切开肾周筋膜,沿腰大肌向内分离,找到肾蒂,于肾蒂处仔细分离,可见肾动脉,于肾动脉后方可见肾静脉及下腔静脉。沿下腔静脉向上、下充分游离至肾脏上极、下极,可见下腔静脉壁被滤器钩和滤器脚顶起(图4)。观察CT 片上滤器头的具体位置,仔细分离,找到滤器头部的回收钩,亦可用针挑起滤器钩,使之显示更清楚,不必阻断下腔静脉,直接用电钩或电刀切开该处下腔静脉壁长2~3 mm,滤器钩即清晰可见(图5),将抓捕环套于滤器回收钩上,将滤器拉入回收血管鞘内(图6)。用5-0 Prolene 线间断缝合下腔静脉切口1~2 针,腹膜后放1 根多孔引流管引流。
1.3 术后处理及随访
观察引流量及引流液颜色,<20 ml/d 可拔除引流管。术后皮下注射低分子量肝素钠0.4 ml/12 h,持续1 周。3 例术前服用利伐沙班,术后24~48 h继续服用。术后第2 天即可进食,由流质饮食逐渐过渡至普通饮食。术后第2 天可适度下床活动,以防下肢血栓形成。出院后,建议患者术后定期复诊。
2 结果
7 例下腔静脉滤器均腹腔镜完整取出,下腔静脉均未阻断。手术时间70~200 min,(133.1 ±45.9)min。术中出血量10~150 ml,中位数20 ml,其中6 例出血量<50 ml,1 例出血150 ml。术后引流时间2~5 d,平均3.4 d。总住院时间6~14 d,中位数12 d。均未出现术后大出血、肺栓塞、感染及下肢深静脉血栓形成等并发症。术后随访12~28 个月,平均18 个月,均未见局部血肿及血栓复发。
3 讨论
可回收滤器目前临床应用广泛,一旦不再需要滤器保护,最好尽早将其取出,因为滤器长期留置体内可出现损伤下腔静脉、邻近脏器及主动脉等并发症[5~9]。但有些滤器用常规腔内方法无法取出,有以下几种原因:回收钩紧贴或穿出血管壁;滤器倾斜程度过大;滤器移位等。本组7 例均经1~3 次腔内取出失败。尽管国内外文献报道了多种腔内取滤器的手术方法,如支气管钳和准分子激光辅助法、胃肠镜活检钳辅助法、LOOP 改进法、双导丝配合法等[10~17],但多为个案报告,很难推广应用。对于不能取出的滤器,大多数只能放弃取出,因为外科手术风险大,游离出下腔静脉后找到滤器头并非易事。一般滤器头周围下腔静脉局部粘连较重,可能与既往腔内取滤器时用力过猛致局部损伤、穿孔、出血有关。开放手术创伤大,有大出血的可能,还要面临失败的风险,文献报道很少[18],腹腔镜取滤器手术难度更大。我院开展多学科诊疗模式,因泌尿外科有腹腔镜下腔静脉取癌栓经验,故参入其中。2016 年在国内率先成功开展经腹腔入路腹腔镜取滤器手术[3]。因经腹腔入路腹腔镜需要游离并阻断下腔静脉,操作复杂,手术时间长,下腔静脉与周围组织粘连重,大出血风险高。因此,我们试图找到一种新的更微创的手术方式。
经腹膜后入路是泌尿外科常用方式,所以我们探索通过此入路行下腔静脉滤器取出术。腹膜后入路取滤器不用切开侧腹膜,不必向中线翻转结肠及十二指肠,对肠道干扰少,更安全,本组手术时间最短70 min。切开肾周筋膜,抬起肾周脂肪即可见下腔静脉,游离下腔静脉即见滤器头。术前应认真阅CT 片,根据滤器头与肾静脉的相对位置,有目标地寻找,因腔内取滤器过程中损伤下腔静脉,致局部出血粘连,有时滤器头不易找到,需仔细游离。找到滤器头后,切开下腔静脉前,不需要荷包缝合(第1 例我们行荷包缝合,本想滤器取出后收紧荷包止血,因为缝线干扰抓捕器套取滤器钩,最终放弃荷包缝合。根据经验,长3~5 mm 的下腔静脉切口不会发生大出血)。滤器取出后,如果术野出血稍多,可适当增加气腹压,缝合1~2 针即可,即使不缝合,局部用可吸收止血纱布压迫,也不会出现大出血。
对于滤器头位于下腔静脉后外侧壁的滤器,如果采用经腹腔入路,因滤器头位于下腔静脉后方,很难看到,特别是肾静脉型滤器,因肾静脉的阻挡,不可能看到下腔静脉后壁,肾静脉后方即是肾动脉,操作也很困难,反复翻找滤器头,容易损伤肾静脉致大出血,一旦出血,缝合也很困难。对于肾静脉上型滤器,经腹腔入路亦很困难,因有肾上腺的阻挡,且肾上腺中央静脉直接注入下腔静脉,手术经腹腔入路操作很困难,而腹膜后入路则毫无遮挡。因为滤器钩位置较高,高于肋缘下trocar 的位置,因此回收滤器需要技巧:①先将抓捕器通过肋缘下腋前线或腋后线trocar 置入术野,腋前线和腋后线trocar 最好使用一次性trocar,以保证抓捕器和血管钳同时置入一个trocar 时无明显漏气;②因抓捕器血管鞘柔韧性较好,腔镜下用两把钳子将血管鞘弯曲,将其近端正好置于滤器钩上方,一旦套住滤器钩,保持此位置不动,直接将滤器拉出。特别是对于既往有手术史者,腹腔常有肠粘连,操作费时,而经腹膜后入路则不受影响。需要注意的是:①后腹腔镜取滤器只能采用右侧腹膜后入路,因为下腔静脉位于腹正中线右侧;②腹膜后入路仅适合滤器头位于第三象限者,如果不在此象限,可以采用经腹腔入路。
总之,经腹膜后入路解决了一部分经腹腔入路难以操作、无法取出滤器的问题,手术难度不大,易于掌握,不干扰胃肠道。

