快速鉴定草莓枯萎病的LAMP检测技术
韩富庆,史芳芳
快速鉴定草莓枯萎病的LAMP检测技术
韩富庆,史芳芳*
(新疆生产建设兵团第十二师农业科学研究所,新疆 乌鲁木齐 830063)
【目的】建立草莓枯萎病的镰刀菌快速检测方法。【方法】利用环介导等温扩增技术(LAMP)针对镰刀菌保守区域ITS设计一套LAMP扩增引物,利用Bst DNA聚合酶完成LAMP扩增反应,对7种常见病原菌进行检测,分析LAMP引物的特异性;比较LAMP与传统PCR方法的敏感性。【结果】建立的LAMP法能够特异性的检测尖孢镰刀菌和腐皮镰刀菌,并且检测灵敏度为1.0×10-4ng/μL,是普通PCR检测灵敏度的1 000倍。【意义】试验所建立的草莓枯萎病快速LAMP检测方法,具有灵敏度高、快速及简便的优点,可以向基层单位推广使用。
环介导等温扩增;镰刀菌;炭疽菌
【研究意义】草莓(Duch.)属蔷薇科草莓属多年生草本植物,果肉鲜美多汁,堪称“水果皇后”。近年来,草莓种植面积逐年增大,品种不断更新,频繁地调种、引种以及连作,导致草莓病害发生较为普遍。目前,影响草莓生产的主要病害是草莓枯萎病[1-2],鉴定和检测草莓病害的主要方法是形态学观察和分子生物学PCR扩增法,这两种方法中,形态学鉴定方法耗时长,需要具备专业知识,且有时对于不常见病原菌会判定不准确,而分子生物学检测方法需要昂贵的仪器设备,且对检测产物需要测序才能判定为是何种病原菌感染[3],因此,亟需一种能够在发病初期或者土壤中进行早期快速检测的技术,以便及时采用有针对性的有效防治措施来控制病害的发生和传播。【前人研究进展】LAMP(环介导等温扩增技术)作为一种新的核酸扩增方法,具有检测速度快、操作简单和灵敏度高等优点[4]。该项技术是在60~65 ℃恒温下扩增,只要恒温水浴锅即可,无需特殊仪器,所以操作方便,对设备要求低;且可用肉眼即可观察实验结果,检测周期非常短,适合于基层农业单位对田间草莓病害进行快速鉴定。目前,国内仅有对草莓炭疽病鉴定的LAMP检测技术的研究[5]。【本研究切入点】传统的病原菌检测技术、免疫学检测技术已经很难明确地鉴定病原菌且耗时长、灵敏度低,而目前大多数分子生物学检测技术费时、费力、准确性低,且不能在病害潜伏期和初期作出诊断,很难对病害发生进行及时的监测和有效控制[6-7]。【拟解决的关键问题】本文首次对镰刀菌引起的草莓枯萎病病害进行LAMP快速检测。
1 材料与方法
1.1 材料与仪器
1.1.1 供试菌株 本研究供试菌株为茶树炭疽、胶孢炭疽、草莓专化型尖孢镰刀菌、马铃薯链格孢菌、尖孢镰刀菌、腐皮镰刀菌、恶疫霉菌。种名、来源及数量见表1。

表1 试验所用菌株及来源
1.1.2 仪器与试剂 Bst DNA聚合酶、DNA提取试剂盒和恒温水浴锅均购自上海生工生物公司;SYBR荧光显色剂购自索莱宝生物公司;PCR扩增仪和凝胶成像系统购自美国伯乐仪器;电泳仪购自北京市六一仪器厂。
1.2 试验方法
1.2.1 病原菌基因组DNA的提取 挑取平板培养的适量病原菌菌丝,采用DNA-EA Reagents V ALL-DNA-FAST-Out裂解液(上海生工生物)提取病原真菌基因组DNA,-20 ℃保存备用。
1.2.2 土壤基因组DNA 提取采用马铃薯葡萄糖液体培养基培养病原真菌,在摇床上震荡5 d后产生孢子,利用血球计数板进行计数,使其达到1×107个分生孢子后与2 g左右灭菌营养土充分混合,采用土壤真菌基因组DNA快速抽提试剂盒(上海生工生物)提取含病原菌分生孢子的土壤基因组DNA,未接真菌病原菌孢子的灭菌营养土提取的DNA作为空白对照。
1.2.3 患病草莓植株组织DNA的提取 将消毒后质量约1 g左右的草莓病株根茎部,置于液氮预冷的研钵中,将其迅速研磨成粉末状后转移至1.5 mL的灭菌离心管中,用(上海生工生物)植物基因组DNA提取试剂盒提取患病植株真菌基因组DNA,同时提取健康草莓植株组织DNA作为空白对照,以接种胶孢炭疽菌和茶树炭疽菌引起的炭疽病草莓病株作为阴性对照。
1.2.4 镰刀菌属特异性LAMP引物设计及扩增 在GenBank中将镰刀菌ITS区域与炭疽菌进行比对,选择具有特异性的区域,采用在线的PrimerExplorer V5 LAMP引物专用设计软件,针对镰刀菌ITS基因片段设计一套特异性LAMP引物,如表2所示。
1.2.5 LAMP扩增反应体系的建立及反应条件的优化 LAMP反应体系(25 μL)包括:内引物FIP和BIP、外引物F3和B3、环引物Loop、dNTPs、MgSO4、Betain、10×Buffer缓冲液、DNA聚合酶、DNA模板、灭菌水补足体系。选择对LAMP体系中的关键因素进行优化,包括镁离子浓度(4,6,8,10 mmol/L)、dNTP浓度(1.0,1.2,1.4,1.6 mmol/L)、环引物浓度比(0.4,0.8,1.2,1.6 μmol/L)、甜菜碱浓度(0.4,0.8,1.2,1.6 mol/L)、Bst DNA聚合酶(4,6,8,12 U/μL),根据反应后的条带有无和染料颜色变化选择最合适的条件,建立最佳的LAMP反应扩增体系。

表2 镰刀菌ITS基因LAMP引物序列
建立最佳LAMP扩增反应体系后,将该体系分别在60~68 ℃条件下进行梯度PCR扩增反应,确定其最适反应温度,并在筛选出的最适反应温度下,进行 LAMP扩增反应,扩增时间分别为15,30,45,60 min 4个时间,反应完后加入SYBR荧光染料,观察颜色变化,同时用10 g/L琼脂糖凝胶电泳检测反应产物,确定LAMP反应的最优反应条件。
1.2.6 LAMP检测镰刀菌属特异性 按照1.2中不同真菌DNA提取方法,提取待测菌株的DNA,分别作为LAMP等温扩增反应的模板,筛选出最佳DNA模板的浓度,将其扩增产物加入荧光染料进行显色反应,显色完后进行10 g/L琼脂糖凝胶电泳分析,观察其实验结果。
1.2.7 LAMP及PCR扩增方法检测镰刀菌灵敏度的比较 将病原菌DNA进行10倍梯度逐级稀释,分别获得DNA原液、10-1、10-2、10-3、10-4、10-5、10-6不同浓度稀释液作为模板,利用所建立的LAMP反应体系和条件进行PCR扩增和LAMP扩增灵敏度对比。分别取5 μL反应产物进行10 g/L琼脂糖凝胶电泳,观察实验结果。
建立PCR法检测镰刀菌的反应体系为25 μL:PCR Master混合物12.5 μL,上下游引物(ITS1/ITS4引物)各1 μL,1.0 μL模板DNA,用灭菌水补足体系至25 μL。反应条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,35个循环,72 ℃延伸10 min。取10 μL PCR扩增反应产物,在10 g/L琼脂糖凝胶上电泳,凝胶成像系统观察扩增条带大小。
2 结果与分析
2.1 草莓植株枯萎病患病症状
枯萎病在草莓植株上的主要表现症状为:早期草莓侧枝及老叶呈现萎焉状态,中心叶片无变化,根及根茎维管束内部为褐色;而地上部分明显呈现矮化萎缩状,并出现大小叶不对称,有的叶柄变红色,叶片边缘变的焦黄或萎焉,逐渐发展到后期整个植株倒在栽培垄上,最终整株萎焉而枯死。
2.2 LAMP反应体系的建立及反应条件的优化
不同方法提取的DNA均可以作为反应模板,通过优化LAMP反应体系,确立了最终LAMP反应体系为:F3及B3的浓度分别为0.2 μmol/L,FIP和BIP的浓度分别为1.6 μmol/L,环引物Loop的浓度为0.8 μmol/L,MgSO4的浓度为8 mmol/L,dNTPs的浓度为1.4 mmol/L,Betain的浓度为0.8 mol/L,DNA聚合酶(8U)的浓度为1.0 μL,10×Buffer的浓度为2.5 μL及1 μL的DNA模板。最优反应条件为:在65 ℃恒温水浴条件下,采用优化的LAMP体系扩增45 min。
采用上述最优反应体系进行最适反应温度的筛选,其结果表明,在68.0,67.6,67.0,66.1,65.5,65.0,64.1和63.0 ℃ 8个不同的反应温度下进行扩增,当加入荧光染色剂SYBR后反应液由橙色变为荧光绿色,且产物经10 g/L琼脂糖凝胶电泳检测后,只有在65 ℃条件下可见瀑布状梯形条带,故确定LAMP反应温度为65 ℃(图1)。在上述最优反应体系下,进行最适扩增时间的筛选,结果表明,当反应45 min时,产物溶液呈现明显的荧光绿色,对应的凝胶电泳条带呈现瀑布状条带,故确定LAMP反应时间为45 min(图2)。
A:基于SYBR Green I 显色的不同温度LAMP产物检测;B:LAMP产物的琼脂糖凝胶电泳1~8:68.0 ℃,67.6 ℃,67.0 ℃,66.1℃,65.5℃,65.0 ℃,64.1 ℃,63.0 ℃

A:基于SYBR Green I显色的LAMP产物检测;B:LAMP产物的琼脂糖凝胶电泳1:15 min;2:30 min;3:45 min;4:60 min
2.3 LAMP检测镰刀菌的特异性
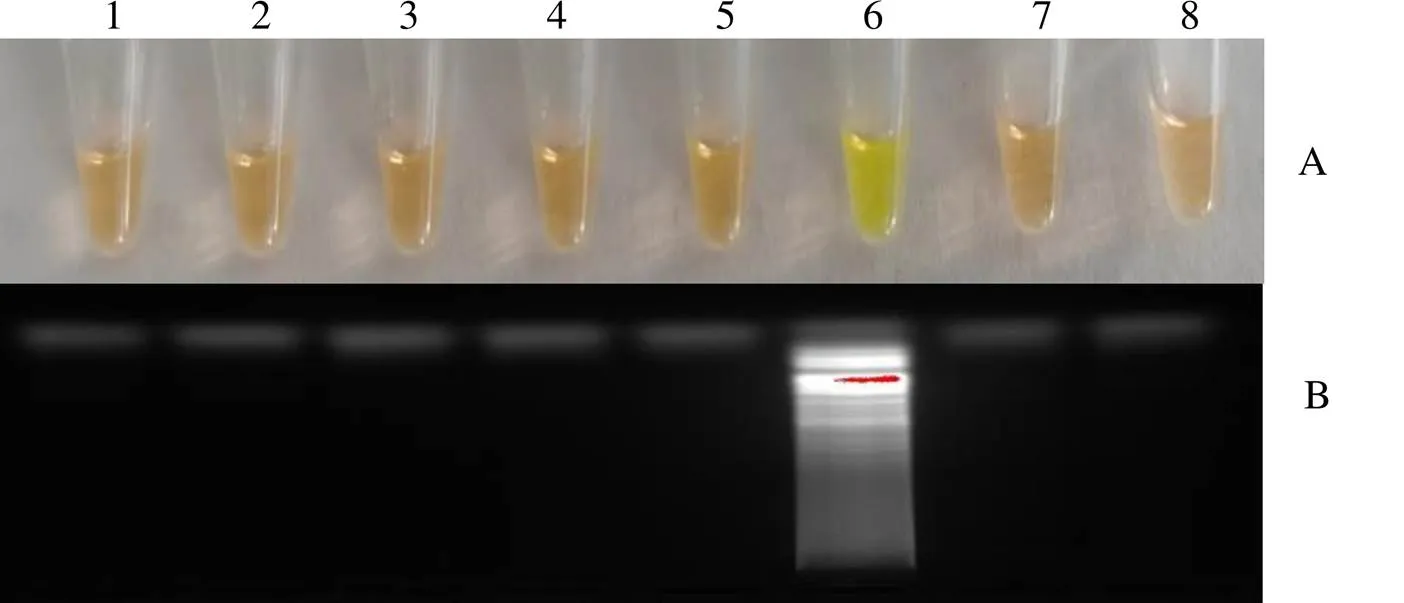
尖孢镰刀菌、草莓专化型尖孢镰刀菌和腐皮镰刀菌为模板的待测病原菌呈现出LAMP产物所特有的荧光绿色(图3)和梯型条带(图4),以灭菌水为模板的空白组以及其它病原菌阴性组,则未出现梯型条带且颜色反应呈橙黄色。

1~8分别为链格孢菌、恶疫霉菌、草莓专化型尖孢镰刀菌、尖孢镰刀菌、茶树炭疽菌、腐皮镰刀菌、胶孢炭疽菌、空白对照显色结果
2.4 LAMP及PCR法检测镰刀菌灵敏度的比较
将DNA原液(10 ng/μL)、不同DNA浓度稀释液进行PCR和LAMP扩增反应后,其中DNA原液,10-1和10-2稀释液3个浓度进行PCR反应后,可以检测到清晰的目的条带,10-3和10-4稀释液PCR产物为非特异性条带,10-5和10-6则没有扩增出条带(图5A)。DNA原液、10-1、10-2、10-3、10-4和10-5稀释液6个浓度作为LAMP反应模板时,均可以看到明显的荧光绿色,只有10-6稀释液作为DNA模板的LAMP产物的显色反应呈现橙色(图5B)。因此,LAMP检测草莓样本中镰刀菌灵敏度可以达到皮克(pg)级以上,非常有利于草莓枯萎病的快速检测应用。

M:DNA marker;1~7分别为链格孢菌、恶疫霉菌、草莓专化型尖孢镰刀菌、尖孢镰刀菌、茶树炭疽菌、腐皮镰刀菌、胶孢炭疽菌LAMP扩增结果

A:M,DNA marker;1~7,原液稀释液106、105、104、103、102、101、DNA原液;B:1~7,原液稀释液106、105、104、103、102、101、DNA原液
3 讨 论
3.1 LAMP检测灵敏度高
环介导等温扩增法(LAMP)[8-12]所需DNA模板浓度比普通PCR方法所需DNA模板浓度还要低,相比PCR扩增方法,本研究对于培养病原菌基因组DNA采用5 min快速提取法,获得的DNA浓度低于10 ng/uL,微量分光光度计对于浓度低于10 ng/uL的DNA不能检测出其浓度,但利用该方法提取的DNA稀释至10×10-5ng/μL浓度(即达到0.1 pg级)进行LAMP技术扩增,其产物在凝胶电泳中呈现清晰的梯状条带;但是普通PCR最低检测浓度为10×10-2ng/μL。近几年有关于实时荧光LAMP技术检测病原菌的报道,该技术是对LAMP技术的改良,通过实时荧光检测系统记录荧光信号,监测整个反应进度,进而分析反应结果。但是该技术需要昂贵的科研仪器和试剂,不适用于基层单位开展科研工作,其优势只在于可以定量实时监测整个反应过程,且灵敏度只是普通LAMP技术的10倍,灵敏度上的优势不明显。本研究中添加荧光染料,实现了观测结果的可视化,便于基层人员对结果进行判读,操作简单方便[13]。
3.2 检测模板范围广
有研究显示,利用3种模板,即发病植株组织、分离培养物菌丝、含有病原菌土壤分别提取DNA进行LAMP扩增,均获得良好效果[14]。不同科研单位可根据条件选择不同模板进行扩增,基层单位的实验条件有限,可以直接从发病植株根际土壤和发病植株中提取的病原菌DNA进行LAMP扩增鉴定,对于草莓病原菌实时监测和前期预警具有重要作用。本研究直接鉴定草莓植株不同部位的镰刀菌,鉴定周期不超过1 h,非专业人员均可操作,鉴定方法适应性强;其中DNA快速检测试剂盒价格低廉、方法简单,平均提取单个样品DNA大约需要花费2元左右,适合向基层推广。
3.3 首次利用LAMP技术检测草莓枯萎病菌
传统病原菌形态学鉴定耗时费力,近年来的分子生物学技术为病原菌检测和鉴定提供了新的方法,但是需要专业技术人员和昂贵的科研仪器。目前在检测草莓病害和病毒方面采用的大多数是分子生物学PCR扩增法,用到LAMP扩增技术的较少[5,7,15],尖孢镰刀菌和腐皮镰刀菌是草莓种植过程中常见导致枯萎病的病原菌,本研究利用基于ITS基因设计的LAMP引物,可快速、特异检测镰刀菌属病原真菌在草莓植株体内是否存在,含有镰刀菌的菌株呈现可视化的绿色荧光,属内其他菌则显示橘黄色。本文首次利用LAMP技术检测草莓枯萎病,可为草莓病害检测领域的科研工作者和基层技术人员提供简便、快速的检测方法。已有研究报道尖孢镰刀菌的LAMP检测技术,但均为其它作物的专化型尖孢镰刀菌检测,引起枯萎病的不只有尖孢镰刀菌,还有镰刀菌属的其它镰刀菌种,因此,本文的研究扩大了检测范围。
4 结 论
本研究以SYBR GreenⅠ为指示剂,根据草莓镰刀菌特异的ITS序列设计了1组LAMP引物,并对反应体系和反应条件进行了优化;特异性实验证实该体系仅对镰刀菌呈现阳性反应,灵敏度实验显示最低检测限为10×10-5ng/uL。本研究所建立的草莓枯萎病LAMP可视化快速检测方法,具有特异性强、耗时短、灵敏度高的特点,为在生产上早期快速诊断草莓枯萎病提供技术支持。
[1] 于红梅, 赵密珍, 王静, 等. 草莓枯萎病菌的分离、鉴定及生物学特性[J]. 江苏农业科学, 2013, 41(11): 124-127.
[2] 宁志怨, 董玲, 廖华俊, 等. 草莓枯萎病的遗传与育种研究进展[J]. 分子植物育种, 2015, 13(1): 235-240.
[3] 张如胜, 魏泉德. LAMP技术在病原微生物检测中的应用[J]. 华南预防医学, 2007, 33(5): 45-49.
[4] 初亚男, 封利颖, 张婕妤, 等. 环介导等温扩增技术改进的研究进展[J]. 微生物学通报, 2015, 42(4): 729-735.
[5] 胡晓然. 草莓主要抗药性病害的环介导等温扩增(LAMP)检测[D]. 杭州: 浙江农林大学, 2018.
[6] 赵玥明, 满朝新, 曲艳艳, 等. 环介导等温扩增技术快速检测肉中金黄色葡萄球菌[J]. 中国食物与营养, 2016, 22(1): 57-61.
[7] 陈柳, 尚巧霞, 陈笑瑜, 等. 草莓轻型黄边病毒RT-LAMP检测方法的建立[J]. 中国农业科学, 2015, 48(3): 613-620.
[8] 杨帆, 胡章薇, 严浩浩, 等. 青稞黑穗病菌LAMP检测体系的建立[J]. 西北农林科技大学学报, 2021(9): 1-10.
[9] 崔林开, 和志华, 康业斌, 等. 环介导等温扩增技术快速检测麦根腐平脐蠕孢[J]. 植物病理学报, 2021, 49(9): 1-9.
[10] 刘旺, 靳晶豪, 陈孝仁. 环介导等温扩增技术的应用进展[J]. 生物技术进展, 2021, 11(2): 128-135.
[11] 田瑶, 李佳昕, 杨莹, 等. 猪圆环病毒I型LAMP检测方法的建立及初步应用[J]. 山东农业科学, 2021, 53(3): 1-9.
[12] 龚建森, 徐敬潇, 付立霞, 等. 印第安纳沙门菌环介导等温扩增检测方法的建立[J]. 畜牧兽医学报, 2021, 52(2): 1-8.
[13] 许苗, 叶文武, 王淑琛, 等. 快速检测马铃薯干腐病病原接骨木镰孢的环介导等温扩增技术[J]. 植物病理学报, 2018, 48(1): 55-60.
[14] 伍文宪, 刘勇, 黄小琴, 等. 尖孢镰刀菌分子检测技术的建立与应用[J]. 草叶学报, 2016, 25(5): 109-115.
[15] 张吉红, 余澍琼, 徐瑛, 等. 逆转录环介导等温扩增技术检测草莓潜隐环斑病毒的研究[J]. 植物保护, 2013, 39(6): 74-77.
Rapid Identification ofWilt in Strawberries Using LAMP Detection Technique
HAN Fuqing, SHI Fangfang*
(The Institute of Agricultural Sciences of the 12th Division, Xinjiang Production and Construction Corps, Urumchi 830063, China)
A rapid detection method forwilt in strawberries was established.A set of LAMP amplification primers were designed for the conserved region of ITS inspp. to detect seven common pathogens by using loop-mediated isothermal amplification (LAMP), and LAMP amplification reaction was completed by using Bst DNA polymerase. Also, the specificity of LAMP primer was analyzed, and the sensitivity between LAMP and PCR was compared.The results showed that LAMP method could detectand, with the detection sensitivity of 1.0×10-4ng/μL, which was 1 000 times that of conventional PCR.The rapid detection method LAMP forwilt in strawberries developed in this experiment had the advantages of high sensitivity, rapidity and simplicity, and could be popularized to grass-root units.
loop-mediated isothermal amplification;;
S668.4
A
2095-3704(2021)02-0153-06
2021-04-27
2021-06-03
兵团中青年科技创新领军人才计划项目(2018CB030)
韩富庆(1974—),男,农艺师,主要从事植物栽培研究;*通信作者:史芳芳,高级农艺师,451784039@qq.com。
韩富庆, 史芳芳. 快速鉴定草莓枯萎病的LAMP检测技术[J]. 生物灾害科学, 2021, 44(2): 153-158.

