哲罗鲑和细鳞鲑种质鉴定标记的筛选
佟广香,杨笑星,2,董乐,2,张永泉,尹家胜,匡友谊
(1.中国水产科学研究院黑龙江水产研究所,黑龙江省冷水性鱼类种质资源及增养殖重点开放实验室,黑龙江 哈尔滨 150070;2.上海海洋大学水产与生命学院,上海 201306)
哲罗鲑Hucho taimen(Pallas)和细鳞鲑Brachymystax lenok(Pallas)肉质细嫩,味道鲜美,营养丰富,富含不饱和脂肪酸,是我国鲑形目Salmoniformes 鲑科Salmonidae 哲罗鲑属Hucho 和细鳞鲑属Brachymystax 珍稀、名贵的冷水性鱼类[1-3]。近年来二者资源量不断下降,为了保护和开发利用这两种名贵鱼类,研究人员相继攻克人工繁殖和苗种培育技术,成功进行了苗种规模化培育以及商品鱼养殖,丰富了我国水产养殖的品种[4-7]。为了恢复野生资源,在部分哲罗鲑和细鳞鲑的原栖息地进行了增殖放流[8]。哲罗鲑和细鳞鲑是近缘物种,分布区域相近,生活环境相似[9,10],成鱼根据外形易于区分,但幼鱼形态学特征不明显,无法依据形态学特征对二者鉴别。另外哲罗鲑和细鳞鲑均是人们喜爱的优质鱼类,为名贵的水产品[11],但进一步加工后,失去了原有的外部形态特征,使得它们之间更加难于鉴别,因此亟需一种快捷方便、准确可靠的方法鉴别二者。
核糖体ITS1(internal transcribed spacer 1)位于编码基因18S 与5.8S 之间,虽然18S 与5.8S 均十分保守,但its1 基因却在属、种及种下水平进化速率快、多态性高且信息量丰富,同时还具有长度适中、引物设计简单和易于扩增等特点,目前已经被广泛应用于属、种水平,甚至科水平的系统演化分析[12-16]。武宝生等[17]用its1 分析了鲈形目的5 科11种鱼类,包括尖吻鲈科、军曹鱼科、射水鱼科、剑鱼科及科,以鮣为外类群,发现its1 能够很好地区分该类群物种;Huyse 等[18]用its1 将虎鱼2 个属(Pomatoschistus 和Gobiusculus)的不同鱼类区分开,其结果与线粒体的12S 和16S 的分类结果一致。龚理等[19]用its1 研究鳎科4 属5 种鱼类时发现,its1 不但能够将这些鱼类在物种和属级水平区分开,同时还能反映各鱼类之间的亲缘关系。本研究用its1 序列分析哲罗鲑和细鳞鲑,旨在建立一种简单易行的DNA 分子标记方法鉴定种质,以期为哲罗鲑和细鳞鲑幼鱼鉴定、加工品鉴定、种质资源管理和保护提供有效的工具。
1 材料和方法
1.1 样本采集及DNA 提取
本研究收集黑龙江虎头、逊克、抚远等地的野生哲罗鲑和细鳞鲑成鱼各60 尾,根据形态鉴定种类后采集鳍条,阴干保存。用100 μL 裂解液在PCR 板内裂解消化样本。裂解液成分为0.5 mg/mL 蛋白酶K、10 mmol/LTris(pH 8.0)、50 mmol/LKCl、0.3%Tween20、0.3%NP40;裂解程序为55℃4 h,98℃10 min[20]。样本裂解后用Vortex 混匀仪混匀,1 000~2 000 r/min离心1~2 min,取上清液备用。
1.2 引物设计
在NCBI 上查找哲罗鲑its1 序列(序列登录号:AY125130),用primer3 在线设计特异性引物2 对,同时对比哲罗鲑和细鳞鲑线粒体12S rRNA 序列,找出二者完全相同序列,设计12S rRNA 参照引物1对。为了能够用琼脂糖凝胶有效的检测PCR 扩增产物,选择12S rRNA 参照引物扩增片段大小与特异性引物片段相差50 bp 以上。引物序列见表1。引物由金唯智生物科技有限公司合成。
1.3 PCR 扩增
PCR 反应体系为20 μL,各成分为:2×Dream Taq PCR mater mix(Thermo Fisher,USA)10 μL、DNA粗提液2 μL、10 μmol/L上下游引物各0.1~1 μL(表1),超纯水补足20 μL 进行PCR 扩增。PCR 反应程序为95℃3 min,32 个循环,每个循环设置为95℃30 s,64.5℃30 s,72℃30 s,之后72℃5 min。PCR产物用2.0%琼脂糖凝胶检测,120 V 电泳30 min,扫描成像。

表1 PCR 引物列表Tab.1 PCR primers list
1.4 参照引物浓度优化
为了避免DNA 降解、操作失误和PCR 扩增失败等原因造成的条带缺失,影响判定结果,本实验引入线粒体12S rRNA 作为参照进行双重PCR 扩增,以消除上述因素的影响。由于不同引物扩增效率存不同,因此对浓度为10 μmol/L特异性引物和12S rRNA 参照引物的比例进行了优化,设置4 个梯度,1-its1 特异性上下游引物固定为1 μL,12S rRNA 参照上下游引物分别为1 μL、0.5 μL、0.25 μL和0.1 μL。
2 结果与分析
2.1 its 1 标记筛选
分别用4 尾哲罗鲑和细鳞鲑初步筛选its1 和12S rRNA 引物,筛选结果见图1。由图1 可知:1-its1 引物在哲罗鲑中能够扩增出334 bp 条带,细鳞鲑中未能扩增出条带;2-its1 在哲罗鲑和细鳞鲑中均能够扩增出119 bp 条带;12S rRNA 引物在哲罗鲑和细鳞鲑中均能够扩增出251 bp 条带。当12S rRNA 参照引物和特异性引物1-its1 均不能扩增出条带时,说明PCR 扩增存在问题,如操作失误,DNA降解等;当12S rRNA 参照引物在样本中能够扩增出条带,而1-its1 引物不能扩增出条带时,说明条带缺失是样本基因组DNA 差异所致。本研究中细鳞鲑12S rRNA 参照引物能够扩增出条带,而1-its1引物却不能扩增出条带,说明细鳞鲑的基因组DNA不能与1-its1 引物有效匹配,造成了条带的缺失,表明1-its1 可能为哲罗鲑特异性序列,可用于鉴别哲罗鲑和细鳞鲑种质,但需要进一步群体验证。
2.2 12S rRNA 引物浓度优化
不同引物的扩增效率存在差异,因此在双重PCR 扩增时有必要优化引物浓度。由图1 可知:同一个体相同条件下12S rRNA 扩增条带明显比1-its1 扩增条带亮,说明12S rRNA 的扩增效率高于1-its1。本研究中,20 μL 扩增体系内10 μmol/L 的1-its1 特异性上下游引物固定为1 μL。12S rRNA 参照上下游引物体积分别设置为1 μL、0.5 μL、0.25 μL 和0.1 μL,扩增图谱见图2。由图2 可知,当1-its1 引物和12S rRNA 参照引物体积均为1 μL时,特异性引物未能扩增出条带,仅12S rRNA 参照引物能够扩增出251 bp 条带(图2-A)。随着12S rRNA 引物浓度的减小,12S rRNA 引物的条带逐渐减弱,哲罗鲑1-its1 特异性引物条带变亮,细鳞鲑无1-its1 特异引物扩增条带。在20 μL 扩增体系内,特异性引物1-its1 和12S rRNA 参照引物分别为1 μL、0.25 μL 时(图2-C),二者达到一种平衡,哲罗鲑能扩增出清晰的334 bp 的1-its1 特异性条带和251 bp 的12S rRNA 参照引物条带;细鳞鲑样本仅有251 bp 的12S rRNA 参照引物条带。

图1 3 对引物PCR 产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of PCR products of the 3 pairs of primers
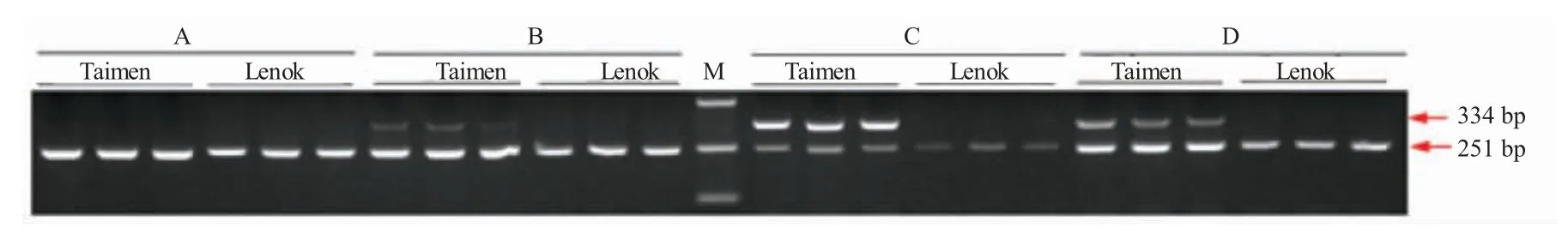
图2 引物1-its1 和12S rRNA 组合扩增结果Fig.2 Electrophoresis of 2-plex amplification with 1-its1 and 12S rRNA primers
2.3 种质鉴定
为了进一步验证1-its1 引物的有效性,用优化的1-its1 和12S rRNA 引物组合扩增野生哲罗鲑和细鳞鲑成鱼各60 尾,扩增图谱见图3。由图3 可知,哲罗鲑均能扩增出334 bp 的1-its1 特异性条带和251 bp 的12S rRNA 参照条带;细鳞鲑仅有251 bp的12S rRNA 参照条带,可见1-its1 引物能够有效鉴定哲罗鲑和细鳞鲑种质,准确率达到100%。

图3 哲罗鲑和细鳞鲑样品1-its1 和12S rRNA 扩增产物电泳检测结果Fig.3 Electrophoresis of 1-its1 and 12S rRNA in taimen and lenok population
3 讨论
本研究开发了一对能区分哲罗鲑和细鳞鲑种质的DNA 分子标记。DNA 分子标记是通过分析生物体之间具有遗传差异的DNA 片段,揭示生物内在基因的分布规律及其各种表型性状所表现的规律。DNA 分子标记具有鉴定速度快、特异性强、灵敏度高、准确可靠等优点,且不受生物体生长发育阶段、试验条件及供试部位等因素的影响,已广泛应用于生物体的基因组研究、起源进化、遗传育种和种质鉴定等多个领域[21]。已有用DNA 分子标记鉴定近源物种的报道。巩高端等[22]用DNA 分子标记鉴定了黄颡鱼Pelteobagrus fulvidraco、瓦氏黄颡鱼Pelteobagrus vachelli 及其杂交种,发现瓦氏黄颡鱼的inad-like 基因比黄颡鱼缺失1 178 bp;周露等[23]建立了双重实时荧光PCR 法鉴别同属于鲑科鱼类的大西洋鲑Salmo salar 和虹鳟Oncorhynchus mykiss,根据扩增曲线对二者进行鉴定;衣洁菡等[24]用SNP 标记鉴定阿根廷滑柔鱼Illex argentinus 和科氏滑柔鱼Illex coindetii,建立了多重PCR 反应体系,其中阿根廷滑柔鱼扩增条带为516 bp,科氏滑柔鱼扩增条带为419 bp。目前区分哲罗鲑和细鳞鲑的DNA 分子标记还没有报道,本研究是国内外首次基于分子生物学技术原理建立的一种哲罗鲑和细鳞鲑种质鉴别方法。它利用its1 基因的多态性和12S rRNA 基因的保守片段,以12S rRNA 基因为参照,避免了由于DNA 降解、加样失误及PCR 扩增失败等原因造成的结果误判。本方法仅需一次PCR 反应,扩增产物经琼脂糖凝胶电泳,根据1-its1 引物扩增条带的有无就能够将二者区分开,哲罗鲑扩增条带为双带,一条是251 bp 的12S rRNA 参照条带,另外一条是334 bp 的1-its1 特异性条带;细鳞鲑仅为单带,是251 bp 的12S rRNA 参照条带,无1-its1的特异性条带。本方法无需依赖专业的分类学背景,也不需要具有长期从事鱼类鉴别的丰富经验,不仅可以区分哲罗鲑和细鳞鲑完整个体,还可以鉴别其加工产品,具有快捷准确、客观公正、经济实用的特点。本方法还可以用于鱼卵、刚孵出苗种的鉴定,能够研究群落结构、产卵位置及扩散途径,了解早期生活史,评估哲罗鲑和细鳞鲑种质资源,鉴别商品苗种及淡水产品市场上存在的标识错误等问题,为哲罗鲑和细鳞鲑幼鱼鉴定、加工品鉴定、种质资源收集、保存、管理和保护提供有效的工具[25]。

