氮源对甲烷氧化混合菌群甲烷氧化和氧化亚氮排放的影响
范玉婧,姚惠娇,高志岭,刘春敬,谢建治,刘臻岳,武新宇
(1. 河北农业大学 资源与环境科学学院/河北省农田生态环境重点实验室,河北 保定 071000;2. 河北省畜牧总站,河北 石家庄 050000)
近年来,我国集约化畜禽养殖规模不断扩大,因此也带来一系列的水污染和大气污染问题[1],其中温室气体甲烷排放是其中之一。Wolf 等用修正的模型估算了全球畜禽养殖CH4排放量,为119.1±18.2 Tg[2]。我国京津冀地区2017 年养殖业CH4排放量占人为源排放量的20%[3]。因此,重点开展畜禽养殖业CH4废气排放控制研究,对于我国实现“碳达峰”“碳中和”目标要求,促进畜禽养殖业绿色发展具有重要意义。
基于甲烷氧化菌氧化转化甲烷是大气中CH4排放控制的重要途径,由于好氧甲烷氧化菌具有生长速率快、容易培养等优点,其被广泛应用到乏风瓦斯[4]、垃圾填埋场[5]、畜禽养殖[6]、污水处理[7]等场所的甲烷控制技术研究中。氮源是影响好氧甲烷氧化菌甲烷氧化效率的一个关键因素,首先,氮源缺乏会抑制甲烷氧化菌生长,进而降低CH4氧化效率[8]。此外,甲烷氧化菌的甲烷氧化酶和氨氧化菌的氨氧化酶较为相似,两者可能存在底物竞争关系。研究发现,NH4+作为营养元素对生物除CH4过程的启动具有促进作用,然而,当NH4+浓度从0.1 g/L增加到0.5 g/L 时,生物法除CH4氧化效率由70%下降至13%[9]。Nikiema[10]等发现,NaNO3质量浓度从0.14 g/L 增加到0.75 g/L 时,生物过滤器的甲烷去除负荷增加了5 倍,而当浓度继续增加时,则会对甲烷去除产生负效应。此外,NO2-也会对甲烷氧化菌氧化甲烷产生抑制作用[11]。上述研究重点关注了氮源种类和浓度对甲烷去除效率的影响,忽略了氮源供给会引起另一温室气体N2O 排放的潜在风险。氮源供给使得处理甲烷生物反应器中会发生由硝化细菌和反硝化细菌参与的氮转化过程,而硝化[12]、反硝化[13]、甲烷氧化[14]、硝化细菌反硝化[15]等都是N2O 的潜在生成途径,目前关于氮源对甲烷氧化过程N2O 排放及生成途径的研究较少,尚需开展进一步研究。Webster[16]采用乙炔抑制法研究了硝化过程的N2O 生成途径,这为研究甲烷氧化过程的N2O 产生途径提供了研究思路。因此,本研究开展了不同氮源种类和氮源浓度对甲烷氧化混合菌群的甲烷氧化效率和N2O 生成规律的影响研究,并采用乙炔抑制法进一步探索了甲烷氧化过程中N2O 的生成途径,结果可为甲烷氧化菌在畜禽养殖业温室气体减排领域的应用提供理论依据和数据支持。
1 材料与方法
1.1 样品采集
甲烷氧化混合菌群富集培养所需土壤样品取自保定市垃圾卫生填埋场矿化垃圾。取土时,首先除去覆盖层表层1 cm 左右的覆盖土,再取上层20 cm的覆盖土,置于无菌袋中密封运回实验室。土壤样品除去草根等杂物并过2 mm 筛后于-20 ℃冰箱冷冻备用[17]。
1.2 NMS 培养基
甲烷氧化混合菌群的富集培养采用甲烷氧化菌通用硝酸盐无机培养基(NMS 培养基)[18],配制好后置于灭菌锅中121 ℃灭菌30 min 备用。
1.3 甲烷氧化混合菌群的富集培养
首先,称取5 g 土壤样品置于装有50 mL NMS培养基的250 mL 血清瓶中,瓶口用异丁基胶塞密封,用无菌注射器注入2 mL 10%甲烷气体,使甲烷浓度维持在350 ~400 mg/m3,置于30 ℃ 150 r/min摇床中恒温培养,每隔24 h 采集血清瓶顶空气体,用气相色谱法测定血清瓶顶空的CH4和N2O 浓度,为消除培养基对甲烷吸收的影响,试验同时设置不加菌液的空白对照。富集培养过程每7 d 为1 个周期,按10%(v/v)比例将富集培养液接种到新鲜培养基,待甲烷去除效率不再增长且保持稳定后,即标志着甲烷氧化混合菌群富集培养完成。
1.4 试验设计
氮源对甲烷氧化混合菌群甲烷氧化和氧化亚氮排放影响试验采用完全试验设计。试验因素分别为氮源种类和氮源浓度,氮源种类分别为NH4Cl、KNO3、NaNO2,氮源浓度分别设置低(10 mg/L)、中(30 mg/L)、高(50 mg/L)3 个水平梯度,并设置加菌不加氮源的空白对照(0 mg/L),共计10个处理,3 次重复。试验过程同甲烷氧化菌的富集培养,按10%接种比例将富集培养好的甲烷氧化混合菌群接种到装有50 mL NMS 培养基的血清瓶(250 mL)中,于30 ℃,150 r/min 摇床培养每隔24 h 后测定CH4和N2O 浓度。
甲烷氧化混合菌群的N2O 产生途径试验主要通过改变顶空气体组分实现,共设置5 个处理,如表1所示,3次重复,试验过程同甲烷氧化菌富集培养过程,按10%接种比例将富集培养好的甲烷氧化混合菌群接种到装有50 mL NMS 培养基的血清瓶(250 mL)中,置于30 ℃,150 r/min 摇床培养,分别在培养的1、3、5、7、8 d 测定顶空N2O 和CH4浓度。
1.5 不同生成途径N2O 贡献的计算方法
硝化作用(Ni)=(处理3-处理4)-(处理1-处理5),反硝化作用(De)=处理2-处理4,非生物作用(CO)=处理4,甲烷氧化菌羟胺氧化(Me)=处理1-处理5,硝化细菌反硝化作用(ND)=处理1-Ni-De-CO-Me 。
1.6 测试指标及方法
本研究测试指标主要为血清瓶顶空CH4和N2O浓度,测定方法[19]:气相色谱为Agilent 6820,检测器分别为火焰离子化检测器(FID)和电子捕获检测器(ECD),检测温度分别为250 ℃和330 ℃,2 种气体的测定均采用高纯氮气(99.999%)作载气,载气流量为30 mL/min,色谱柱均为Porapak Q,规格分别是60/80 目和80/100 目。
2 结果与分析
2.1 甲烷氧化混合菌群的富集培养和气体排放规律
2.1.1 甲烷氧化混合菌群的富集培养 以垃圾填埋场覆土为菌源,进行了以7 d 为1 个周期,为期49 d的甲烷氧化混合菌群的富集培养。由图1 可以看出,随着富集培养过程的进行,富集培养物的甲烷氧化能力逐渐提高。富集培养物在第7 d 的甲烷氧化效率为60%,到第42 d 提高到接近100%,随后甲烷氧化效率基本保持稳定,这标志着甲烷氧化富集培养过程的完成,后续的氮源影响试验和N2O 生成途径试验均采用该富集培养物开展。
2.1.2 甲烷氧化混合菌群的甲烷氧化和N2O 排放特征 以富集培养7 个周期的甲烷氧化混合菌群为供试对象,测定分析甲烷氧化混合菌群在12 d 中的CH4和N2O 浓度变化规律。由图2 可见,甲烷氧化过程中伴有N2O 的产生,在一个培养周期内,血清瓶顶空的CH4浓度逐渐降低,由最初的349.3 mg/m3降低至6.6 mg/m3,但同时气相顶空中的N2O 逐渐升高,由0.7 mg/m3升高至5.9 mg/m3,相关性分析结果表明:甲烷消耗量和氧化亚氮生成量呈负相关,相关系数为0.556 8。
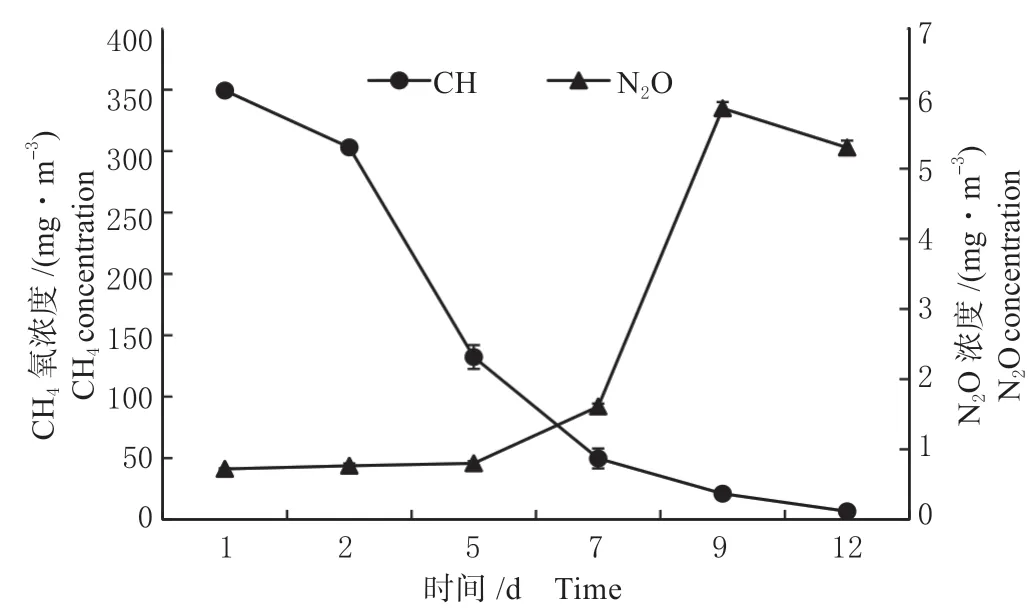
图2 甲烷氧化混合菌群培养过程的CH4 氧化效率和N2O 排放Fig.2 CH4 oxidation and N2O emissions during the cultivation process of the mixed methane oxidation bacteria
2.2 氮源对甲烷氧化混合菌群甲烷氧化和N2O 排放的影响
2.2.1 氮源类型对甲烷氧化混合菌群甲烷氧化和N2O 排放的影响
(1)甲烷氧化 氮源类型对甲烷氧化混合菌群甲烷氧化效率的影响如图3 所示。当氮源浓度为10 mg/L 时, 分别以NH4+-N、NO3--N 和NO2--N 为氮源,甲烷氧化混合菌群的甲烷氧化效率均在90.0%左右,无明显差异(图3a)。当液相氮源浓度为30 mg/L 时,以NO3--N 为氮源时甲烷氧化效率最高,可达90.0%,NH4+-N 为氮源的甲烷氧化效率次之,为86.3%,NO2--N 为氮源的甲烷氧化效率最低为77.9%(图3b)。液相氮源浓度为50 mg/L 时,同样是以NO3--N 为氮源的甲烷氧化效率最高可达90.1%,但以NH4+-N 为氮源的甲烷氧化效率最低为78.9%(图3c)。综上可知,从保证较高的甲烷氧化效率的角度考虑,NO3--N 适宜作为甲烷氧化混合菌群培养的氮源。
(2)N2O 排放 由图4 可知,氮源类型对甲烷氧化混合菌群培养过程N2O 的排放有明显的影响,尤其是在中、高浓度氮源供给时,以NH4+-N 作为氮源时的N2O 的排放量最高,为5.1 ~17.8 mg/m3,以N 为氮源的N2O 排放量次之,范围在2.1 ~3.3 mg/m3,氮源为N 时的N2O 排放量最低约为1.0 mg/m3左右。因此,从N2O 排放的角度考虑,以-N 为氮源较为适宜。

图3 氮源类型对甲烷氧化混合菌群CH4 氧化效率的影响(a. 10 mg/L;b. 30 mg/L;c. 50 mg/L)Fig.3 The effects of nitrogen source type on CH4 oxidation efficiency of the mixed methane oxidation bacteria(a. 10 mg/L;b. 30 mg/L;c. 50 mg/L)
2.2.2 氮源浓度对甲烷氧化混合菌群甲烷氧化和N2O 排放的影响
(1)甲烷氧化 图5 为氮源浓度对甲烷氧化混合菌群甲烷氧化效率的影响,当以NH4+-N 为氮源时,高浓度NH4+-N 会降低CH4氧化效率,浓度为10 mg/L 时甲烷氧化效率最高,为92.0%,而N 浓度为50 mg/L 时甲烷氧化效率仅为78.9%(图5a)。当以NO3--N 为氮源时,氮源浓度对甲烷氧化效率影响不大均处于90.0%左右(图5b)。当以-N 为氮源时,NO2--N 浓度为10 mg/L 时甲烷氧化效率最高,为93.0%,30 mg/L 和50 mg/L时甲烷氧化效率均处于90.0%以下(图5(b))。综上可得,从保证较高甲烷氧化效率的角度考虑,不论是选用NH4+-N、NO3--N、还是NO2--N,以10 mg/L 的氮源浓度较为适宜。
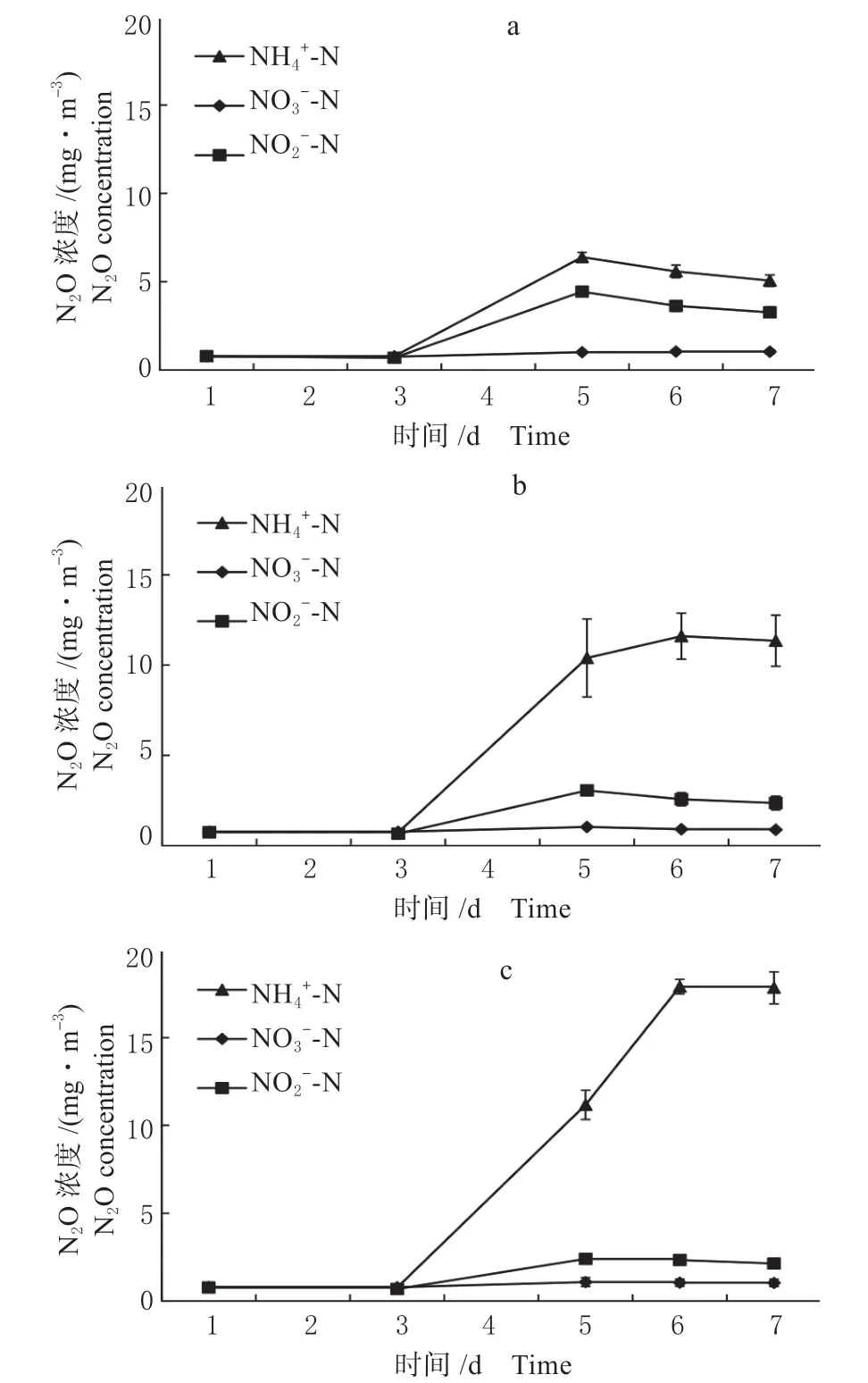
图4 氮源类型对甲烷氧化混合菌群培养过程N2O 排放的影响(a. 10 mg/L;b. 30 mg/L;c. 50 mg/L)Fig.4 The effects of nitrogen source type on N2O emissions of the mixed methane oxidation bacteria(a. 10 mg/L;b. 30 mg/L;c. 50 mg/L)



图5 氮源浓度对甲烷氧化混合菌群CH4 氧化效率的影响(a. NH4+-N;b. NO3--N;c. NO2--N)Fig.5 The effects of nitrogen source concentration on CH4 oxidation efficiency of the mixed methane oxidation bacteria (a. NH4+-N; b. NO3--N; c. NO2--N)
基于以上试验结果可知,以低浓度NO3--N 为氮源培养甲烷氧化混合菌群,不仅具有较高的甲烷氧化效率,且生成的氧化亚氮浓度较低,因此,宜采用低浓度的NO3--N 作为氮源,但培养过程仍有少量N2O 生成。
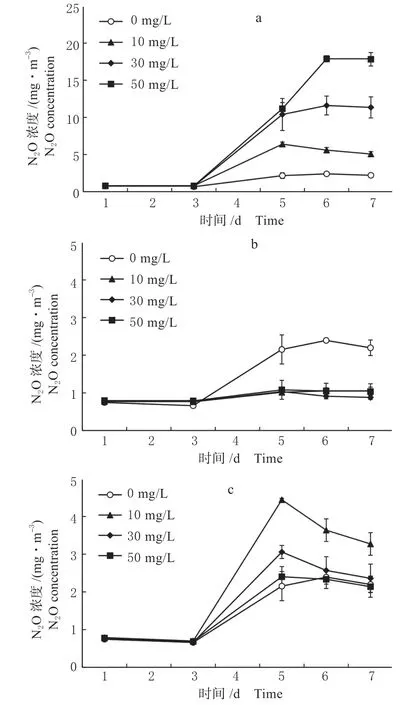
图6 氮源浓度对甲烷氧化混合菌群培养过程N2O 排放的影响(a. NH4+-N;b. NO3--N;c. NO2--N)Fig.6 The effects of nitrogen source concentration on N2O emissions of the mixed methane oxidation bacteria(a. NH4+-N; b. NO3--N; c. NO2--N)
2.3 甲烷氧化混合菌群氧化甲烷过程的N2O 生成途径变化规律
如图7 所示,在甲烷氧化混合菌群培养过程的第1 天,培养体系中的N2O 主要是非生物作用产生的,其贡献约占79%,其次为甲烷氧化菌羟胺化作用,约占15%;随着甲烷氧化过程的进行,硝化细菌反硝化作用的贡献逐渐增大,从培养第1 天的6%增加到第5 天的61%。而非生物作用随着培养过程的进行,则逐渐降低,到第8 天其贡献下降至22%。整个培养过程甲烷氧化菌羟胺氧化作用的贡献一直稳定在15%~28%,而硝化作用和反硝化作用对甲烷氧化混合菌群的氧化亚氮排放贡献较低。基于以上研究结果可以推断,甲烷氧化混合菌群氧化甲烷过程的氧化亚氮主要来源是硝化细菌反硝化作用。
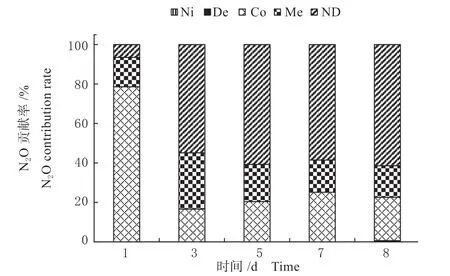
图7 甲烷氧化混合菌群甲烷氧化过程N2O 生成途径变化规律Fig.7 The variation of N2O production pathways of the mixed methane oxidation bacteria during methane oxidation process
3 讨论
3.1 氮源类型对甲烷氧化混合菌群的影响
氮源类型对甲烷氧化混合菌群氧化甲烷具有明显影响,以NO3--N 为氮源时,甲烷氧化混合菌群的甲烷氧化效率最高,而高浓度的含铵态氮的无机盐对菌体甲烷代谢具有抑制作用。魏文平等[20]也得出相同的结论,原因是NH4+作为甲烷的结构类似物,会与甲烷竞争性地结合MMO 酶的甲烷结合活性位点,起到抑制CH4氧化的作用[21]。此外,氮源类型对甲烷氧化混合菌群N2O 排放有明显影响,以NH4+-N 为主要氮源时,N2O 的排放量最高,何志龙等也在试验中得出NH4+-N 浓度越高,N2O 排放越多的结论,以NO3--N 为氮源的N2O 的排放均明显低于以NH4+-N 和NO2--N 为氮源[22]。
3.2 氮源浓度对甲烷氧化混合菌群的影响
在本实验中,以NH4+-N 为氮源时,高浓度的 NH4+-N 对甲烷氧化产生抑制作用。而以NO3--N 为氮源时,氮源浓度对甲烷氧化效率的影响不大,甲烷氧化效率均处于90.0%左右。Dam 等[23]同样发现甲烷氧化菌Methylocustissp strain SC2的甲烷氧化效率随着NH4+-N 浓度提高而下降。Willison[24]等在草地试验中也证明了上述结论,草地在长期施用(NH4)2SO4可完全抑制CH4氧化,然而长期施用等量NaNO3并未导致CH4氧化能力下降,表明NO3--N 对甲烷氧化无抑制作用。
高浓度NH4+-N 对N2O 排放有促进作用。而氮源为NO3--N 时,浓度变化对N2O 排放量无明显影响。N 为氮源时,浓度升高对N2O 的排放有抑制作用,Law 等[25]同样发现,亚硝化系统中极高浓度的亚硝酸盐会降低N2O 的产生速率,Peng 等[26]研究却认为N2O 的产生速率和释放因子随亚硝酸盐浓度的增大而增大。高浓度NO2--N 导致N2O 积累显著差异的原因可能是由于不同脱氮系统内部微生物种类的不同[27]。
3.3 甲烷氧化过程的N2O 产生途径
甲烷氧化混合菌群在氧化甲烷过程会伴有N2O的产生,其浓度与培养体系中的氮源类型和氮源浓度有关。由于CH4的气体全球变暖潜能值(GWP)为25,而N2O 的GWP 值高达298[28],这使得甲烷氧化过程的温室气体减排效应大大降低。甲烷氧化混合菌群氧化甲烷过程中产生的N2O,在培养初期以非生物作用贡献最多。随着氧化过程的进行,非生物作用贡献逐渐降低,而硝化细菌反硝化作用对N2O 的贡献则不断增加。原因是培养过程中甲烷氧化混合菌群氧化甲烷消耗了大量氧气,低氧的环境更适合硝化细菌反硝化作用[29]。Kool 等[30]在试验中得出相同结论,硝化细菌反硝化作用占纯培养物中N2O 排放量的30%~66%。
4 结论
以甲烷氧化混合菌群为供试对象,开展了不同氮源类型和氮源浓度对其甲烷氧化混合菌群甲烷氧化能力和N2O 排放的影响,并采用乙炔抑制试验,研究了甲烷氧化混合菌群培养过程的N2O 生成途径,主要结论如下:
(1)甲烷氧化混合菌群的甲烷氧化过程会伴有N2O 的生成,培养体系的CH4浓度与N2O 浓度呈负相关关系。
(2)氮源类型和浓度对甲烷氧化混合菌群的甲烷氧化效率和N2O 生成有显著影响,以NO3--N 为氮源的甲烷氧化能力最高,且N2O 排放低。高浓度的N 对甲烷氧化有抑制作用,且会导致高浓度的N2O 生成。
(3)甲烷氧化混合菌群氧化甲烷过程的N2O,主要产生途径为硝化细菌反硝化作用。

