一株侵染黄桃果实的葡萄座腔菌菌株鉴定
虞凡霜,强 遥,秦双林,张凯东,刘 冰,熊桂红,蒋军喜*
(1.江西农业大学 农学院,江西 南昌 330045;2.上海市崇明区长兴镇农业技术服务中心,上海 201913)
【研究意义】“锦绣”黄桃是我国南方鲜食与加工兼用的晚熟桃品种,因其品质优良、香甜可口、外观美丽而深受广大消费者的喜爱[1-3]。近年来,江西省井冈山市大力推进“锦绣”黄桃种植,但在种植过程中出现严重的果实腐烂现象,使当地果农种植黄桃积极性受到严重影响。2020 年7 月下旬,笔者对当地腐烂病果进行病菌分离,分离到疑似葡萄座腔菌的菌落。本文拟对该分离菌株进行系统鉴定和致病性测定,以明确葡萄座腔菌对桃果实的致病作用,这对促进桃侵染性流胶病研究和有效防治桃果实腐烂具有重要的理论和实际意义。【前人研究进展】葡萄座腔菌是桃侵染性流胶病的主要病原,长期以来人们仅研究其对桃枝干的为害,而很少关注其对桃果实的为害。Britton[4]研究表明,引起美国佐治亚地区桃枝干流胶病的葡萄座腔菌有Botryosphaeria dothidea,B.obtuse和B.rhodina,以B.dothidea为主要致病菌。有关国内桃枝干流胶病菌,广东、江苏、山东、重庆的为B.dothidea[5-9],湖北的主要为B.dothidea,极少数为B.obtuse和B.rhodina[10],有B.dothidea和B.obtuse2 种[11]。然而,对葡萄座腔菌在桃果实上的为害情况并不了解。【本研究切入点】研究拟从分离获得的葡萄座腔菌中选择一个菌株,对其进行培养性状和形态特征观察以及多基因序列分析,同时对其致病性进行测定。【拟解决的关键问题】研究不仅旨在明确该菌株的种类归属,而且表明葡萄座腔菌在为害桃枝干的同时,也能为害桃果实而导致桃果实发病。
1 材料与方法
1.1 供试病果
2020 年7 月从江西省井冈山市拿山乡罗仚“锦绣”黄桃种植基地采后预藏的果实中采集病果,病果采回后立即进行病菌分离。
1.2 病原菌的分离纯化
参照文献[12]对桃病果进行病菌分离。将桃果实病斑表面用75%酒精擦洗后经火焰灼烧灭菌,用无菌镊子撕去病斑表皮后,将内部果肉移入PDA 平板上,并置于30 ℃恒温箱中培养,待菌落长到适宜大小后挑取菌落边缘菌丝体进行纯化,获得的菌株用PDA斜面保存备用。
1.3 病菌的培养特性及形态学观察
将供试菌株接种于PDA 平板中央,30 ℃培养,逐日观察菌落形态特征,7 d后用十字交叉法[13]测量菌落直径大小,计算菌落生长速率。鉴于该菌在人工培养基上不易产生子实体,将该菌接种桃枝干于24 ℃、12 h 光照/12 h 黑暗交替的培养箱中培养20 d,促其产生子实体,在光学显微镜下观察分生孢子器和分生孢子的形态特征,并随机测量50个分生孢子器和100个分生孢子大小。根据实验结果,参照相关文献,对病原菌种类归属进行形态学鉴定。
1.4 分子生物学鉴定
1.4.1 病菌基因组DNA 提取 将供试菌株接种于PDB 液体培养基中,26 ℃、160 r/min 摇床培养3 d,收集菌丝体,在液氮中迅速研磨呈粉末状。采用Ezup 柱式真菌基因组DNA 提取试剂盒提取其基因组DNA,用0.8%琼脂糖凝胶电泳检测DNA提取质量。
1.4.2 病菌rDNA-ITS、EF-1 和β-tubulin 基因序列分析 以提取的基因组DNA 为模板,用引物对ITS1(5'-TCCGTAGGTGAACCTGCGG-3')/ITS4(5'-TCCTCCGCTTATTGATATGC-3')、EF1-728F(5'-CATCGAGAAGTTCGAGAAGG-3')/EF1-986R(5'-TACTTGAAGGAACCCTTACC-3')和T1(5'-AACATGCGTGAGATTGTAAGT-3')/BT2b(5'-ACCCTCAGTGTAGTGACCCTTGGC-3')[14-17]分别对rDNA-ITS、EF-1 和β-tubulin 基因进行PCR 扩增。PCR 扩增反应总体系25 μL,包含ddH2O 8.5 μL、2×TaqPCR Master Mix 12.5 μL、正反向引物各1 μL(10 μmol/L)和模板DNA 2 μL。反应程序为94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35 个循环;最后一次循环结束后,72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳检测后,委托生工生物工程(上海)有限公司进行序列测定。
1.4.3 序列比对与系统发育树构建 将测得的原始序列用DNA Star(Madison Wisconsin,USA)分析软件进行数据处理,并将获得的序列递交至GenBank获得序列登录号。在NCBI中使用BLAST程序搜索同源性序列,并下载相关序列,利用MEGA 5.2软件中的邻位加入法(neighbor-joining,NJ)构建系统发育树,根据序列同源性大小及系统发育树中的亲缘关系,对待鉴定菌株进行分子鉴定。
1.5 病菌致病性测定
选取健康的黄桃成熟期果实和一年生枝条,经75%酒精擦拭消毒后,在待接种处用灭菌针头刺伤,随即将刚打取的直径5 mm 菌饼的菌丝面紧贴伤口进行接种,以接种空白PDA 培养基块作对照,每处理重复6次。接种处用无菌湿棉球保湿,被接种的果实和枝条置于30 ℃恒温箱中保湿培养,逐日观察发病情况,待发病后对接种病斑进行病菌再分离,以完成柯赫氏证病律。
2 结果与分析
2.1 病果症状
2020 年,江西省井冈山市拿山乡多个种植基地的“锦绣”黄桃发生一种新的果实病害。该病主要发生于7、8月黄桃果实成熟及贮藏期,果实出现淡褐色圆形或不规则形病斑,病健交界不明显,病斑果皮较完好,果肉变软腐烂(图1a)。
2.2 病菌培养性状及形态特征
从各病果中分离到形态特征一致的菌落,随机挑选一株菌株(JGT01)进行培养性状和形态特征观察,该菌株在PDA 平板上菌落圆形,初期白色,培养3 d 后菌落开始转变为灰绿色,菌落背面为墨绿色,菌落生长速度为35.5 mm/d,具有发达的气生菌丝(图1b,图1c,图1d)。在PDA 平板上培养30 d,未产生子实体。将病菌转接桃树一年生枝条,枝条发病后病部可产生分生孢子器,分生孢子器球形,平均大小为221.2(214.2~244.8)μm×225.9(204~255)μm(图1e),内部着生分生孢子,分生孢子呈长梭形、无色、单胞、薄壁、外壁光滑、偶有1~2 个隔膜,平均大小为22.6(18.7~28.6)μm×5.1(3.9~5.2)μm(图1f)。经查阅文献,以上形态特征与Slippers 等[17]描述的“七叶树壳梭孢(Fusicoccum aesculiCorda)”形态特征相一致。

图1 “锦绣”黄桃果实腐烂病症状及菌株JGT01的形态特征Fig.1 Symptoms of fruit rot disease on“Jingxiu”yellow peach and morphology of strain JGT01
2.3 分子生物学鉴定
以供试菌株JGT01 的基因组DNA 为模板,对其rDNA-ITS、EF-1 和β-tubulin 基因进行PCR 扩增,均获得符合预期大小的DNA 条带(图2),经测序,其条带大小依次为583,297,681 bp。将序列提交至Gen-Bank,获得的基因登录号分别为MW202368、MW202401 和MW 202404;通过BLAST 搜索,发现这3 个序列与GenBank 中葡萄座腔菌(Botryosphaeria dothidea)对应序列有最高的同源性,均为100%。将本菌株JGT01 的3 个序列按rDNA-ITS、EF-1 和β-tubulin 顺序拼接成一个大的串联序列,同时在GenBank 中下载相关菌株的对应序列(表1)并进行拼接,构建系统发育树。结果显示,JGT01与B.dothidea的各菌株聚类成一个分支,而其他种类的菌株各构成独立的分支(图3)。依据同源性大小和系统发生关系,将菌株JGT01鉴定为葡萄座腔菌(B.dothidea)。
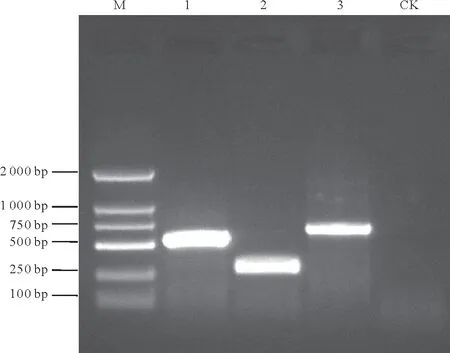
图2 菌株JGT01的不同基因PCR扩增产物电泳图Fig.2 Electrophoresis of PCR products amplified from different genes of strain JGT01

图3 基于rDNA-ITS、EF-1和β-tubulin基因串联序列构建的葡萄座腔菌属真菌的系统发育树Fig.3 Phylogenetic tree of fungi in Botryosphaeria based on the concatenated sequences of genes ITS,EF-1 and β-tubulin

表1 从GenBank中下载的葡萄座腔菌属内各种真菌的基因序列信息Tab.1 Gene sequence information of various fungi in the genus Botryosphaeria downloaded from GenBank
2.4 病菌致病性测定
将供试菌株JGT01 分别接种健康黄桃果实及枝条,结果接种部位均发病。果实接种后36 h 出现明显症状(图4a),接种后48 h病斑显著扩大,呈褐色圆形,病健交界不明显(图4b),其症状与自然发病症状相同,接种后60 h病斑进一步扩大,病斑表面产生白色稠密的菌丝体(图4c)。枝条接种后第3天开始发病,产生褐色椭圆形凹陷的病斑(图5a),随后病斑进一步扩展(图5b)。接种5~7 d 病斑处逐渐溢出黄色透明的粘液(图5c),粘液逐渐变为黑色胶体(图5d),接种后21 d 病斑表面密生黑色小点(图5e)。用纯PDA 接种,无论是接种果实(见果实的右半部)还是接种枝条(图5f)均未发病。对接种病斑进行病菌再分离,再分离的病菌与原接种菌的培养性状及形态特征一致,完成了柯赫氏证病律。

图4 菌株JGT01在黄桃果实上的致病性测定Fig.4 Pathogenicity test of the strain JGT01 on fruits of yellow peach

图5 菌株JGT01在桃枝上的致病性测定结果Fig.5 Pathogenicity test of the strain JGT01 on trunks of yellow peach
3 结论与讨论
本文对一株分离自井冈山市黄桃病果的真菌进行了培养性状观察、形态和分子生物学测定,其菌落形态特征和菌落生长速率符合对葡萄座腔菌(B.dothidea)的描述,分生孢子器和分生孢子形态大小与葡萄座腔菌的无性态七叶树壳梭孢(Fusicoccum aesculi)的分生孢子器和分生孢子形态大小相吻合,测定的rDNA-ITS、EF-1 和β-tubulin 3 个基因序列与葡萄座腔菌对应序列具有最高的同源性,在构建的系统发育上与葡萄座腔菌也聚于一个分支,基于以上结果,本文将该菌株的种类鉴定为葡萄座腔菌(B.dothidea)。
B.dothidea是葡萄座腔菌属中最常见的种类,其寄主范围广,可使20 科34 属50 余种植物致病,苹果、梨、桃、葡萄、猕猴桃等多种果树常遭受B.dothidea的侵染而分别发生苹果和梨轮纹病、桃侵染性流胶病、葡萄溃疡病、猕猴桃果实熟腐病等病害[18-21]。B.dothidea属于弱寄生菌,主要为害寄主植物的枝干和成熟果实,并具有潜伏侵染特性。苹果、梨轮纹病和葡萄溃疡病对枝干和果实的危害并重,造成枝干斑痕累累、树势衰弱直至枯死和果实贮藏期间的严重腐烂[22-24];猕猴桃果实熟腐病主要为害猕猴桃近成熟和贮藏期果实,并且是猕猴桃贮藏期腐烂病害的主要病原,但在猕猴桃枝干上发生较少,仅在枝条剪口处发生为害[25]。B.dothidea一直被认为是桃树枝干的重要病原菌,而很少有人去关注其对果实的为害,本文则清楚地表明B.dothidea对桃果实的为害,未来笔者拟对“锦绣”黄桃烂果进行大样本病原鉴定,以明确B.dothidea是否是造成其烂果的重要原因。

