花生硫氧还蛋白AhTRXh基因的克隆及表达分析
李霞 潘春柳 苏桂军 詹洁 王爱勤 肖冬 何龙飞

摘 要:h型硫氧还蛋白(TRX h)是最多的一类硫氧还蛋白,在种子萌发、氧化还原、信号传递以及响应生物和非生物胁迫等多种途径中起重要作用。以花生铝敏感品种‘中花2号和耐铝品种‘99-1507为材料,对h型硫氧还蛋白亚族成员AhTRX h进行克隆和表达分析。结果表明:该基因包含长为429 bp的完整开放阅读框,编码142个氨基酸;进化树分析表明,花生TRX h与鹰嘴豆TRX h、拟南芥TH9亲缘关系较近,且含有保守活性位点WCGPC;亚细胞定位显示,AhTRX h定位于叶绿体;构建原核表达重组质粒pGEX-6p-1-AhTRX h,转化大肠杆菌Rosetta菌种,在上清和沉淀均有表达,纯化获得可溶的具活性的重组蛋白,体外检测重组蛋白没有明显的发生亚硝基化的趋势。酵母双杂显示,AhTRX h蛋白没有自激活性,筛选花生文库获得互作蛋白——钙网蛋白和金属硫蛋白。该结果表明AhTRX h可能通过与钙网蛋白和金属硫蛋白相互作用,参与花生对铝胁迫响应。
关键词:花生;硫氧还蛋白;铝胁迫;基因克隆
中图分类号:S565.2 文献标识码:A
Abstract: Thioredoxin plays an important role in seed germination, redox homeostasis, signal transduction and res-ponses to biotic and abiotic stresses. In this study, AhTRX h, a member of h-thioredoxin subfamily, was cloned from peanut varieties ZH2 (Al-sensitive) and 99-1507 (Al-tolerant). Sequence analysis showed that AhTRX h contained an open reading frame (ORF) of 429 bp encoding 142 amino acids with a conservative active site-WCGPC. Phylogenetic analysis showed that AhTRX h was closely related to TRX h in Cicer arietinum and Th9 in Arabidopsis. AhTRX h was located in chloroplast. The recombinant plasmid pGEX-6p-1-AhTRX h was transformed into Escherichia coli (Rosetta), recombinant proteins induced by IPTG were founded in supernatant and precipitate. Soluble recombinant proteins with activity were purified, and had no obvious trend of S-nitrosylation in vitro. The results of yeast two hybrid showed that potentially interactional proteins were calreticulin and metallothionein. The results indicate that AhTRX h play an important role in response to Al toxicity by likely interacting with calreticulin and metallothionein.
Keywords: Arachis hypogaea; thioredoxin; aluminum stress; gene cloning
DOI: 10.3969/j.issn.1000-2561.2021.05.008
活性氧(ROS)為细胞正常代谢过程的一种代谢产物,以极低的含量存在,但在逆境胁迫条件下ROS含量迸发,影响植物代谢,对植物产生胁迫等,如在干旱、高温、强光等逆境胁迫条件下,植物会产生大量ROS[1]。ROS含量受到众多调控因子的调节,氧化还原系统是主要的调控因子之一。硫氧还蛋白(thioredoxin,TRX)是一类普遍存在的二硫化物还原酶,在保守基序WC[G/P]PC中存在2个活性半胱氨酸位点,是氧化还原系统中重要的成员之一。依据序列特征以及亚细胞定位,植物硫氧还蛋白可分为f、m、o、h、y和x型等不同类型,可以通过半胱氨酸残基上的硫醇基团翻译后修饰,如S-谷胱甘肽化和S-亚硝基化等[2],参与氧化还原状态调控,参与不同的细胞进程。如f和m型主要分布在叶绿体中,通过对f1f2双缺突变体拟南芥短日照下生长缓慢的现象研究证明f型是卡尔文循环酶快速还原的关键[3];如果缺失4类m型TRX,拟南芥光系统II则会明显受损[4],故目前普遍认为f和m型可能在光合代谢途径中有一定的作用。而o型主要分布在线粒体中,在对烟草o型TRX研究中发现TRX o1与GSH共同为DNA的复制提供一个有利的还原环境保护DNA,影响细胞增殖和细胞周期[5]。x和y型则主要在质体中分布,对y2拟南芥突变体研究则发现y2型TRX在光合器官中充当质体甲硫氨酸亚砜还原酶(MSR)的电子受体起修复蛋白功能[6];而x突变体表型与野生型拟南芥并无明显差异,推测可能与其他类型TRX功能有重叠,可以弥补x型TRX的缺失[7]。
h型硫氧还蛋白在植物中存在种类最多,功能广泛,可在种子萌发中起作用,减少小麦种子贮藏蛋白,促进发芽[8];Liu等[9]在玉米中发现一个不具硫氧还蛋白通用活性位点半胱氨酸的蛋白ZmTrx h,其在抗甘蔗花叶病毒(sugarcane mosaic virus,SCMV)病毒中起作用,与水杨酸与茉莉酸相关的防御信号路径没有明显联系,而且不同等位基因存在差异,可能与基因上游不同转座子的插入有关;AtTrx h9被发现可在不同细胞之间流动,推测其可能在细胞间信号传递发挥作用[10];AtTrx h3不仅具有氧化还原功能,还可以作为分子伴侣提高过表达拟南芥耐热性[11],h型硫氧还蛋白还可在水稻韧皮部通过胞间连丝实现细胞之间穿梭,激活RipAY,促进GSH降低,进而抑制植物抗病害的免疫反应[12];过表达Trxs基因的(该基因与h型TRX同源性达94%)大麦会增加APX、CAT、GSH-PX等抗氧化酶活性,缓解根系蛋白质和膜脂的氧化损伤,提高对铝胁迫的抗性[13],但是h型硫氧还蛋白在铝胁迫中的作用及机制尚不清楚。
花生(Arachis hypogaea)属油料作物和经济作物,在中国油料作物的种植规模方面仅次于油菜[14],是我国重要的食用植物油来源。保障花生生产对我国植物油安全供给、满足国内外市场需求具有重要意义。我国南北种植环境差异较大,形成南北不同的花生生产格局,南方土壤多以粘稠红、黄壤为主,雨水较多,生态条件复杂,土壤贫瘠,多呈酸性,铝(Al)在酸性条件下主要以Al3+形式存在,对作物产生毒害,毒害症状主要表现为植株矮小、叶片黄化、卷曲,出现类似缺乏营养元素的症状,抑制根的生长,引起细胞程序性死亡[15-16],ROS大量积累,引起膜脂过氧化等[17],影响花生等作物的生长发育、产量及品质。铝胁迫导致的ROS积累、细胞程序性死亡是否受到TRX的调控需要进行研究。
我们在前期铝处理转录组数据中发现,铝处理下硫氧还蛋白基因表达水平会发生明显变化,不同h硫氧还蛋白之间也存在差异(待发表),也说明花生TRX与铝胁迫响应有关。因此,本研究以铝敏感性不同的2个花生品种为材料,克隆硫氧还蛋白基因,并进行生物信息学分析,解析不同铝处理时间下基因表达模式及亚细胞定位,诱导并测定其重组蛋白活性及修饰方式,筛选互作基因,为深入探讨AhTRX h在花生铝胁迫中的作用机制提供参考。
1 材料与方法
1.1 材料与处理
试验材料为实验室前期筛选获得的铝敏感品种‘中花2号(‘ZH2号)、铝耐性品种‘99- 1507[15, 18]。材料的培养方法参考詹洁等[19]的方法,当幼苗长出第3片叶时,用0.1 mmol/L CaCl2溶液(pH 4.2)预处理24 h后,再用0.1 mmol/L AlCl3溶液(含0.1 mmol/L CaCl2,pH 4.2)分别处理0、4、8、12、24 h;取根尖(约1 cm)速冻后置于-80 ℃冰箱保存备用。
试验所用克隆载体为pMD19T(TaKaRa),酵母双杂载体为PGBKT7和PGADT(TaKaRa);原核表达载体pGEX-6P-1和亚细胞定位载体pSAT6-EYFP-N1为实验室保存,感受态细胞自行制备保存。
1.2 RNA提取及基因克隆
RNA提取及cDNA的合成参照Liu等[20]的方法进行。利用花生转录组数据筛选获得目的基因,并在NCBI(https://www.ncbi.nlm.nih.gov/)查找获得基因的CDS序列,利用Primer 5软件设计引物(表1,小写字母代表同源臂)。分别以‘中花2号和‘99-1507的cDNA为模板进行PCR扩增,扩增体系包含1 ?L LA Tap、10 ?L 10×LA Tap Buffer II、16 ?L 2.5 mmol/L dNTP mixture、4 ?L Forward primer、4 ?L Reverse primer、4 ?L Tem-plate DNA,加水補到100 ?L。反应程序为94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,共30个循环;72 ℃延伸7 min。扩增后的PCR产物电泳检测,并用DNA回收试剂盒(TIANGEN)回收目的片段;将目的片段连接至pMD19T,并转化DH5α,挑选阳性克隆送测(北京奥科鼎盛生物科技有限公司),保存测序正确菌液,完成克隆。
1.3 生物信息学分析
利用NCBI-BLAST (https://blast.ncbi.nlm.nih. gov/Blast.cgi)查找与花生AhTRX h相似的序列,利用MEGA5软件构建进化树,通过DNAMAN软件分析保守序列,通过在线网站http://ca.expasy. org/tools/myristoylator和http://csspalm.biocuckoo. org分别预测AhTRX h氨基酸是否发生豆蔻酰化和棕榈酰化。
1.4 亚细胞定位
亚细胞定位所用载体为带黄绿色荧光蛋白的pSAT6-EYFP-N1质粒,根据AhTRX h基因的全长,以及载体序列,最终确定Xhol和Sal I两个酶切位点,由CE Design V1设计引物(表1),利用ClonExpress Ⅱ One Step Cloning Kit(南京诺唯赞生物科技有限公司)重组,得到AhTRX h-EYFP融合表达质粒。
1.5 原生质体的提取与瞬时转化
参考Yoo等[21]方法提取原生质体并瞬时转化。
1.6 AhTRX h蛋白的原核表达及活性测定
1.6.1 诱导表达 构建原核表达所用的载体为pGEX-6P-1,重组方法如1.4,将重组质粒转化至感受态细胞Rosetta,37 ℃培养至OD600=0.6~0.8,加入IPTG至0.1 mmol/L,在18 ℃条件下诱导蛋白,12 h后离心收集菌体,PBS重悬后超声破碎,收集上清和沉淀,经SDS-PAGE分离后,用考马斯来亮蓝染色40 min,脱色拍照,确定重组蛋白的表达形式。
1.6.2 蛋白纯化与Western Blot验证 根据亲和层析原理,参考GE公司Glutathione Sepharose 4B 填料说明手册,进行上清蛋白的镍柱纯化,并用抗GST标签鼠单克隆抗体和山羊抗小鼠IgG(H+L)验证。
1.6.3 重组蛋白的亚硝基化检测 参考Aimé等[22]的实验步骤及试剂配制方法对重组蛋白进行体外亚硝基化验证。
1.7 AhTRX h自激活鉴定与酵母筛库
根据AhTRX h基因的全长,以及PGBKT7载体图谱设计引物(表1),重组方法如1.4,最终将AhTRX h连接到PGBKT7载体。采用LiAC法转化酵母感受态细胞Y2HGold,以Y2H Gold [pGBKT7-53]和Y187[pGADT7-T] 为阳性对照,以Y2H Gold[pGBKT7-Lam]和Y187[pGADT7-T]做阴性对照,验证AhTRX h-BD自激活性:转化好的酵母细胞涂布到SD/-Trp (SDO)、SD/-Trp+ X-α-gal (SDO+X)、SD/-Trp+X-α-gal+AbA(SDO+ X+A),观察酵母的生长情况,如果酵母在SDO或SDO+X上生长,但是在SDO+X+A没有生长,则代表此基因没有自主激活的活性。利用‘ZH2号根尖构建cDNA文库(TaKaRa),按Clontech酵母操作说明筛选AhTRX h-BD可能的互作蛋白。
2 结果与分析
2.1 AhTRX h基因克隆和生物信息学分析
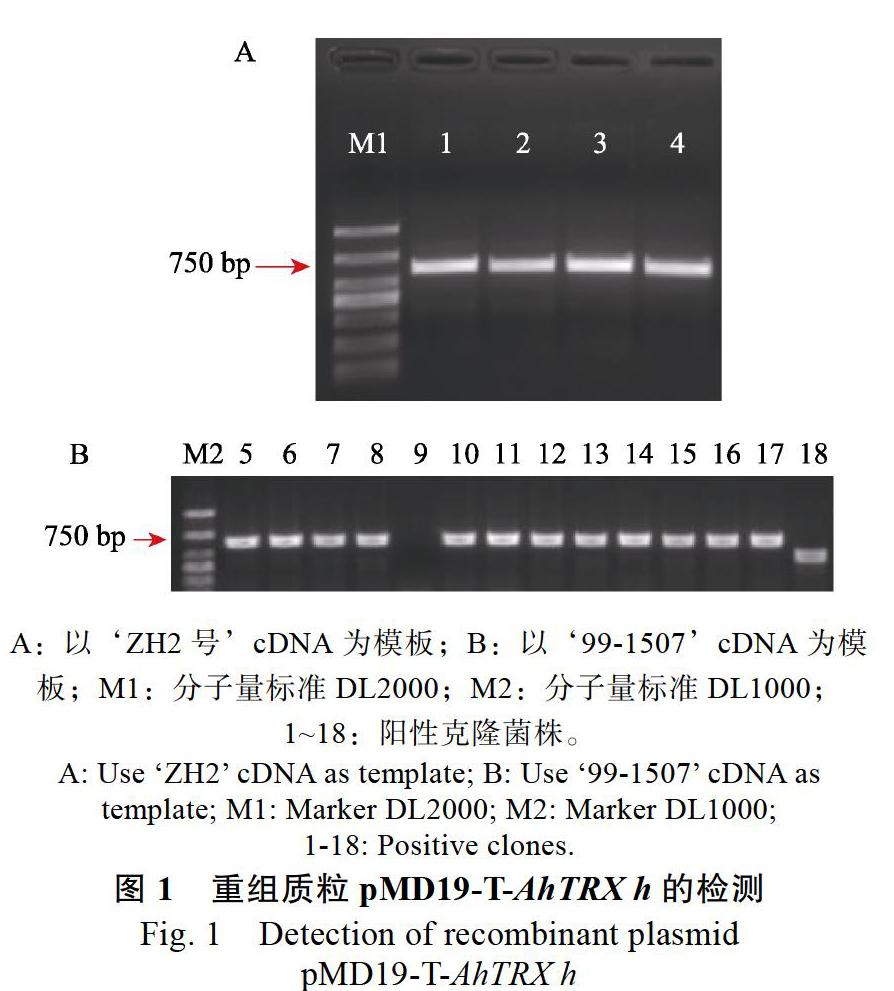
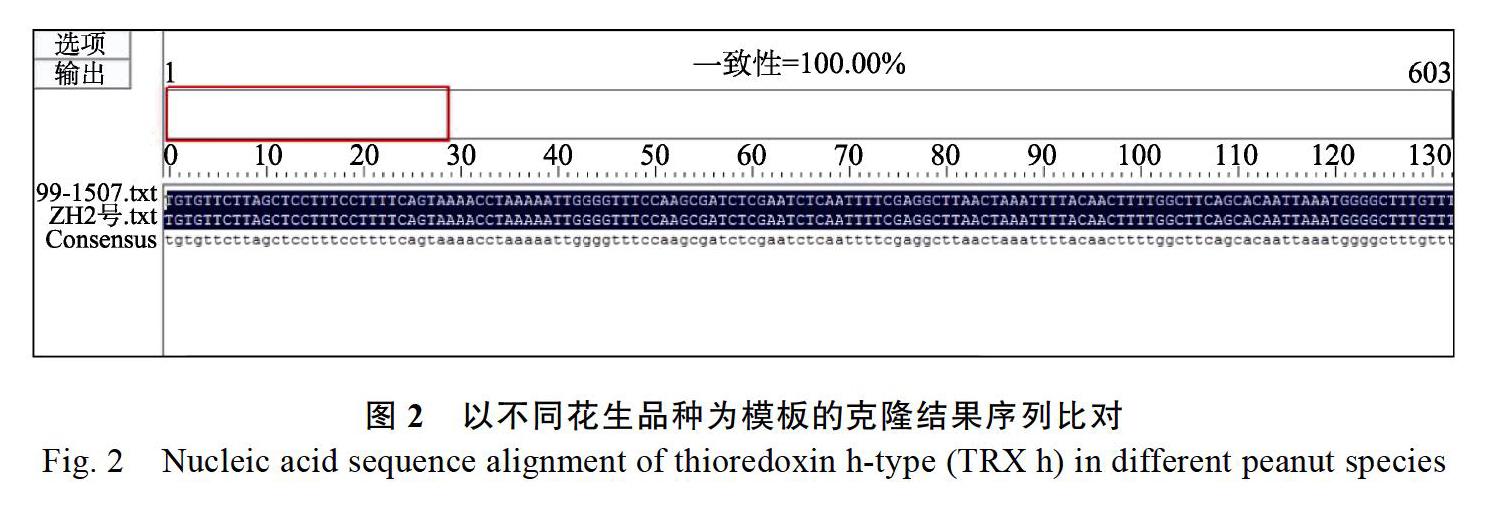
以ZH2号cDNA为模板,扩增获得603 bp,连接pMD19-T,转化并进行PCR检测(图1A),以‘99-1507cDNA为模板扩增得到的检测结果见图1B,位置与‘ZH2号的结果一致,挑阳性克隆送测,比对测序结果发现,从2个花生品种中获得的序列完全一致(图2),并且该序列含硫氧还蛋白保守结构域(图3)。在NCBI上进行比对,其与XM_025785254同源性高达100%,故将其命名为AhTRX h。为进一步探究AhTRX h与其他物种h型硫氧还蛋白的进化关系,利用MEGA5软件对拟南芥、水稻、烟草、大豆、鹰嘴豆的核酸序列进行进化树分析。结果显示(图4),AhTRX h与AtTH9、CaTRX h在同一进化支上,说明蝶形花亚科亲缘关系较近,且AhTRX h与拟南芥TH9可能具有相近的基因功能。进一步通过DNAMAN对上述物种的h型硫氧还蛋白进行保守序列分析,发现AhTRX h与其他物种一致,含TRX家族保守的WCGPC活性中心五肽序列(图3)。
2.2 AhTRX h基因在不同铝处理时间下的表达
利用定量PCR检测AhTRX h基因在不同抗铝花生中的表达。由图5可知,随着铝处理时间延长,AhTRX h基因的表达量在2个品种中均呈先增加后降低再增加的趋势,在0.1 mmol/L Al处理24 h后,AhTRX h表达量在2个品种中均达到最高。与无Al处理相比,‘ZH2号在Al处理24 h后AhTRX h表达量高达4倍之多;在同一Al时间下,与‘99-1507相比,AhTRX h在‘ZH2号中表达量变化更显著。表明AhTRX h在花生响应铝胁迫中发挥作用。
2.3 AhTRX h蛋白定位
拟南芥原生质体经瞬时转化,在激光共聚焦显微镜下观察AhTRX h蛋白的定位,结果显示,AhTRX h-pSAT6-EYFP-N1的融合蛋白在拟南芥只在叶绿体能观察到强烈的绿色荧光信号,在叶绿体激发光下观察发现信号重叠(图6),表明AhTRX h蛋白定位在叶绿体中。
2.4 AhTRX h的蛋白活性
将AhTRX h全长基因序列连接到pGEX-6P-1质粒,经测序验证,表明获得序列与原始序列一致,原核表达重组质粒构建成功。将重组质粒转化大肠杆菌菌株Rosetta,经IPTG诱导后,取样检测,结果如图7所示,没有经IPTG诱导,没有目的大小的蛋白表达,但是经12 h低温、低速以及IPTG诱导表达后,在43~55 kDa之间的位置出现一条特异条带,由于GST标签大小约为29 kDa,所以AhTRX h蛋白的实际大小为43 kDa,与理论预测的AhTRX h蛋白大小一致,并且诱导得到的重组蛋白主要是以可溶性的形式存在于上清中。
為进一步测定重组蛋白的活性,对目的蛋白进行纯化,结果显示,经谷胱甘肽洗脱后可得到条带清晰的蛋白条带(图8),且经GST抗体检测有单一的特异性条带,且位置正确(图9),故得到AhTRX h的纯化蛋白。将纯化蛋白经胰岛素孵育测定活性,结果如图10显示,AhTRX h重组蛋白在650 nm处有吸收峰,并随着时间发生变化,证明AhTRX h重组蛋白在体外有活性,但是在体外亚硝基化检测中,发现AhTRX h重组蛋白并没有明显的亚硝基化趋势(图11)。
2.5 AhTRX h互作蛋白的筛选
为了验证AhTRX h蛋白在酵母中是否具自激活性,利用LiAc法将AhTRX h-BD转化酵母细胞,如图13所示,转化AhTRX h-BD的酵母细胞在SDO培养基上能生长(图12A),在SDO/X培养基上长浅蓝色菌落(图12B),但是不能在SDO/X/ A中生长(图12C),阳性对照在SDO/X/A生长,阴性对照在SDO/X/A不生长相比较,表明AhTRX h蛋白没有自主激活活性。
为研究AhTRX h蛋白参与的信号通路,利用LiAc转化酵母的方法对AhTRX h-PGBKT7基因进行筛库,通过PCR验证阳性菌株(图13),并测序比对,获得目的基因:calreticulin(LOC112775527)和metallothionein-like protein 2(LOC112716772),表明2个基因在花生响应铝胁迫中起重要作用。
A:转AhTRX h-BD质粒的Y2HGold在SD-Trp(SDO)的生长情况;B:转AhTRX h-BD质粒的Y2HGold在SDO/X的生长情况;C:转AhTRX h-BD质粒的Y2HGold在SDO/X/A的生长情况。
3 讨论
通过NCBI比对,克隆到的AhTRX h与XM_025785254的同源性高达100%,表明属于h型硫氧还蛋白。在进化树分析中,AhTRX h与AtTH9、CaTRX h在同一进化支上,说明蝶形花亚科亲缘关系较近,且AhTRX h与拟南芥TH9可能具有相近的基因功能。
硫氧还蛋白依赖于保守活性位点催化硫醇-二硫化物发生氧化还原反应,可调控多个代谢途径,在维持细胞氧化还原状态中发挥重要作用[23],胁迫条件下植物通常会产生大量H2O2以及其他活性氧来保护自身免受氧化胁迫造成的伤害[24],花生经0.1 mmol/L铝处理后会导致O2-和H2O2大量积累[17],铝处理也会刺激AhTRX h表达水平显著增加,表明AhTRX h在铝胁迫下通过提高转录水平来作出响应,推测其可能通过控制硫氧还蛋白含量以及通过不同修饰方式调控靶蛋白参与调控ROS水平等来缓解铝胁迫下受到的氧化胁迫,响应铝胁迫。同时,AhTRX h重组蛋白在体外测定具有活性,推测其在花生体内可通过活性位点来发挥作用,是有活性的一类h型硫氧还蛋白。由于在对AhTRX h重组蛋白体外亚硝基化检测中发现没有明显的发生亚硝基化趋势,那么亚硝基化应不是AhTRX h主要的翻译后修饰方式,但是在对Trx h5功能的探究中,发现其可以调控一些转录激活因子的亚硝基化水平,如使NPR1去亚硝基化生成单体形式影响植物的免疫反应[25]。Trx h1还可减少鸟苷酸环化酶半胱氨酸亚硝基化,进而降低氧化或亚硝基化胁迫[26]。所以,尽管没有检测到AhTRX h发生亚硝基化,那么其是否也有可能以去亚硝基化或转亚硝基化方式在胁迫中起作用?同时Meng等[10]发现,AtTH9在N端具保守的位点WGS(/L/G)C,其中甘氨酸位点可能发生豆蔻酰基化,还预测靠近N端的半胱氨酸位点也可能发生棕榈酰化等翻译后修饰,考虑到相近的亲缘关系,分析AhTRX h氨基酸序列,发现AhTRX h的N端同样具G和C两个保守位点,经在线网站(http://ca.expasy.org/tools/myristoylator)预测其可能发生豆蔻酰基化的分值高达0.955,在CSS-PALM(http://csspalm.biocuckoo.org)预测棕榈酰化发生的分值高达41.84,故AhTRX h虽不发生亚硝基化,那么是否也极有可能发生豆蔻酰基化和棕榈酰化来参与代谢途径。但需要进一步研究。
不同類型及不同物种中的h型硫氧还蛋白在细胞内分布不同,OsTrx h1多分布在细胞质和细胞核[27],但也有报道OsTrx h1分布在水稻的质外体中[28],OsTrx h4多分布在细胞质和内质网[27],ZmTrx h分布在细胞质[29],而AhTRX h定位于叶绿体,也许会影响光系统发挥作用。这也证实h型种类繁多,可位于不同细胞器发挥作用,参与不同细胞作用途径。
钙网蛋白(CRT)是一类内质网钙结合蛋白,存在于藻类到高等植物中。钙网蛋白依据其氨基酸序列多数可分为含信号肽的N端结构域、富含脯氨酸的P结构域、富含酸性氨基酸的C端结构域[30]3个结构域,过表达小麦CRT基因的烟草植株对干旱抗性增强,并且C端区域在抗旱中发挥主要作用,含更多的抗氧化酶[31]。植物CRTs同样具有结合Ca2+的能力,调控细胞内钙离子水平,对冷害和干旱胁迫等逆境作出响应[32-33]。金属硫蛋白与生物体重金属胁迫密切相关[34],是一类富含半胱氨酸热稳定的小分子蛋白,不仅在基本金属元素的过量清除和非必需金属元素清除中起作用[35],也被认为在抗氧化过程和清除自由基的进程中起作用[36],所以AhTRX h也可能通过与钙网蛋白和金属硫蛋白相互作用,提高花生铝毒的抗氧化水平,减少铝毒产生的氧化胁迫。
4 结论
本研究从花生栽培种中克隆到硫氧还蛋白家族的一个成员AhTRX h,其氨基酸富含WCGPC活性中心,是一类定位于叶绿体且有活性的蛋白质。在铝胁迫下,AhTRX h转录水平明显提高,可能与钙网蛋白、金属硫蛋白互作,一方面调控铝胁迫下的抗氧化水平,另一方面激活花生体内铝解毒系统;尽管体外验证亚硝基化不是其翻译后修饰方式,但其可能发生棕榈酰化和豆蔻酰化,在花生铝胁迫中发挥作用。
参考文献
[1] Suzuki N, Koussevitzky S, Mittler R, et al. Invited review ROS and redox signalling in the response of plants to abiotic stress[J]. Plant Cell and Environment, 2012, 35: 259-270.
[2] Zaffagnini M, Fermani S, Marchand C H, et al. Redox ho-meostasis in photosynthetic organisms: novel and established thiol-based molecular mechanisms[J]. Antioxid Redox Signal, 2019, 31(3): 155-210.
[3] Naranjo B, Diaz-Espejo A, Lindahl M, et al. Type-f thiore-doxins have a role in the short-term activation of carbon metabolism and their loss affects growth under short-day conditions in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2016, 67(6): 1951-1964.
[4] Wang P, Liu J, Liu B, et al. Evidence for a role of chlorop-lastic m-type thioredoxins in the biogenesis of photosystem II in Arabidopsis[J]. Plant Physiology, 2013, 163(4): 1710-1728.
[5] Calderóna A, Ortiz-Espína A, Iglesias-Fernándezb R, et al. Thioredoxin (TRXo1) interacts with proliferating cell nuc-lear antigen (PCNA) and its overexpression affects the growth of tobacco cell culture[J]. Redox Biology, 2017, 11: 688-700.
[6] Laugier E, Tarrago L, Courteille A, et al. Involvement of thioredoxin y2 in the preservation of leaf methionine sulfoxide reductase capacity and growth under high light[J]. Plant Cell and Environment, 2012, 36(3): 670-682.
[7] Pulido P, Spínola M C, Kirchsteiger K, et al. Functional analysis of the pathways for 2-Cys peroxiredoxin reduction in Arabidopsis thaliana chloroplasts[J]. Journal of Experi-mental Botany, 2010, 61(14): 4043-4054.
[8] Kobrehel K, Wong J H, Balogh A, et al. Specific reduction of wheat storage proteins by thioredoxin H[J]. Plant Physiology, 1992, 99(3): 919-924.
[9] Liu Q Q, Liu H H, Gong Y Q, et al. An atypical thioredoxin imparts early resistance to sugarcane mosaic virus in ma-ize[J]. Molecular Plant, 2017, 10(3): 483-497.
[10] Meng L, Wong J H, Feldman L J, et al. A mem-brane-associated thioredoxin required for plant growth moves from cell to cell, suggestive of a role in intercellular communication[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(8): 3900-3905.
[11] Park S K, Jung Y J, Lee J R, et al. Heat-shock and re-dox-dependent functional switching of an h-type Arabidopsis thioredoxin from a disulfide reductase to a molecular chaperone[J]. Plant Physiology, 2009, 150(2): 552-561.
[12] Ishiwatari Y, Fujiwara T, Mcfarland K C, et al. Rice phloem thioredoxin h has the capacity to mediate its own cell-to-cell transport through plasmodesmata[J]. Planta, 1998, 205(1): 12-22.
[13] 李巧云, 牛洪斌, 王孟本, 等. 过量表达Trxs对铝胁迫下转基因大麦幼苗根系抗氧化酶系的影响[J]. 麦类作物学报, 2007, 27(6): 1111-1116.
[14] 鲁 清, 李少雄, 陈小平, 等. 我国南方产区花生育种现状、存在问题及育种建议[J]. 中国油料作物学报, 2017, 39(4): 556-566.
[15] Huang W J, Oo T L, He H Y, et al. Aluminum induces rapidly mitochondria-dependent programmed cell death in Al-sensitive peanut root tips[J]. Botanical Studies, 2014, 55(1): 67.
[16] He H, Huang W, Oo T L, et al. Nitric oxide inhibits alumi-num-induced programmed cell death in peanut (Arachis hy-poganea L.) root tips[J]. Journal of Hazardous Materials, 2017, 333: 285-292.
[17] Pan C L, Yao S C, Xiong W J, et al. Nitric oxide inhibits Al-induced programmed cell death in root tips of peanut (Arachis hypogaea L.) by affecting physiological properties of antioxidants systems and cell wall[J]. Frontiers in Physi-ology, 2017, 8: 1037.
[18] Zhan J, He H Y, Wang T J, et al. Aluminum-induced pro-grammed cell death promoted by AhSAG, a senes-cence-associated gene in Arachis hypoganea L.[J]. Plant Science, 2013, 210: 108-117.
[19] 詹 洁, 寇瑞杰, 何龙飞. 铝对花生根尖细胞形态结构的影响[J]. 中国油料作物學报, 2008, 30(1): 79-83.
[20] Liu D, Gong Q Q, Ma Y Y, et al. cpSecA, a thylakoid pro-tein translocase subunit, is essential for photosynthetic development in Arabidopsis[J]. Journal of Experimental Botany, 2010, 61(6): 1655-1669.
[21] Yoo S D, Cho Y H, Sheen J. Arabidopsis mesophyll protop-lasts: a versatile cell system for transient gene expression analysis[J]. Nature Protocols, 2007, 2(7): 1565-1572.
[22] Aimé S, Hichami S, Wendehenne D, et al. Analysis of re-combinant protein S-nitrosylation using the biotin-switch technique[J]. Methods in Molecular Biology, 2018, 1747: 131-141.
[23] Potters G, Horemans N, Jansen M A. The cellular redox state in plant stress biology: a charging concept[J]. Plant Physiology & Biochemistry, 2010, 48(5): 292-300.
[24] Blokhina O, Fagerstedt K V. Reactive oxygen species and nitric oxide in plant mitochondria: origin and redundant regulatory systems[J]. Physiologia Plantarum, 2010, 138(4): 447-462.
[25] Kneeshaw S, Gelineau S, Tada Y, et al. Selective protein denitrosylation activity of thioredoxin-h 5 modulates plant immunity[J]. Molecular Cell, 2014, 56(1): 153-162.
[26] Huang C, Alapa M, Shu P, et al. Guanylyl cyclase sensitiv-ity to nitric oxide is protected by a thiol oxidation-driven interaction with thioredoxin-1[J]. Journal of Biological Chemistry, 2017, 292(35): 14362-14370.
[27] Ying Y H, Yue W H, Wang S D, et al. Two h-type thioredox-ins interact with the E2 ubiquitin conjugase PHO2 to fine-tune phosphate homeostasis in rice[J]. Plant Physiology, 2017, 173(1): 812-824.
[28] Zhang C J, Zhao B C, Ge W N, et al. An apoplastic h-type thioredoxin is involved in the stress response through regulation of the apoplastic reactive oxygen species in rice[J]. Plant Physiology, 2012, 157(4):1884-1899.
[29] Sun L J, Ren H Y, Liu R X, et al. An h-type thioredoxin functions in tobacco defense responses to two species of viruses and an abiotic oxidative stress[J]. Molecular Plant-Microbe Interactions, 2010, 23(11): 1470-1485.
[30] Joshi R, Paul M, Kumar A, et al. Role of calreticulin in biotic and abiotic stress signalling and tolerance mechanisms in plants[J]. Gene, 2019, 714: 144004.
[31] Xiang Y, Lu Y H, Song M, et al. Overexpression of a Triti-cum aestivum calreticulin gene (TaCRT1) improves salinity tolerance in tobacco[J]. PLoS One, 2015, 10(10): e0140591.
[32] Saijo Y, Tintor N, Lu X, et al. Receptor quality control in the endoplasmic Reticulum for plant innate immunity[J]. EMBO Journal, 2009, 28(21): 3439-3449.
[33] Jia X Y, Xu C Y, Jing R L, et al. Molecular cloning and characterization of wheat calreticulin (CRT) gene involved in drought-stressed responses[J]. Journal of Experimental Botany, 2008, 59(4): 739-751.
[34] Machreki-Ajmi M, Ketata I, Ladhar-Chaabouni R, et al. The effect of in situ cadmium contamination on some bio-markers in Cerastoderma glaucum[J]. Ecotoxicology, 2008, 17(1): 1-11.
[35] Vasák M. Advances in metallothionein structure and func-tions[J]. Journal of Trace Elements in Medicine and Biology, 2005, 19(1): 13-17.
[36] Viarengo A, Lowe D, Bolognesi C, et al. The use of bio-markers in biomonitoring: a 2-tier approach assessing the level of pollutant-induced stress syndrome in sentinel organisms[J]. Comparative Biochemistry and Physiology, 2007, 146(3): 281-300.
責任编辑:黄东杰

