番茄采后病菌鉴定及肉桂精油的抑菌分析
蔡锦玲,蓝波妙,陈品品,姚 文,林 涛
(泉州市农业科学研究所,福建 泉州 362200)
番茄(Solanum lycopersicum)是全球重要的蔬菜作物,营养价值和经济效益高,具有皮薄、肉嫩和汁多等特点,但其物理抗挤压性差,采后呼吸作用强,在采后运输及储藏中极易发生腐烂,致使其商品品质下降和经济效益降低[1—3]。番茄采后腐烂受到生理性、物理性和病理性因素的综合影响,其中由病原菌侵染产生的病理性病害是番茄采后腐烂的主要原因[4—7],主要的病害(病原菌)包括:灰霉病(灰葡萄孢霉Botrytis cinerea,适宜温度20~23 ℃,相对湿度90%以上)、黑霉病(黑霉菌链格孢Alternaria alternata,适宜温度20~30 ℃,相对湿度90%以上)、青霉果腐病(扩展青霉,Penicillium expansum,适宜温度18~28 ℃,相对湿度95%~98%)、早疫病(茄链格孢菌Alternaria solani,适宜温度26~28 ℃,相对湿度70%~80%)、晚疫病(致病疫霉菌,Phytophthora infestans,适宜温度23~25 ℃,相对湿度95%~100%)和红粉病(粉红聚端孢霉菌Trichothecium roseum,适宜温度25~30 ℃,相对湿度85%~95%)等[6—14]。腐烂后的番茄容易积累棒曲霉素和桔霉素等具有致癌作用的真菌毒素[15—16]。福建省泉州市地处亚热带地区,温湿度较为适宜采后病原菌生长,导致番茄采后更容易感染各种病原菌。
肉桂(Cinnamomum cassia)系樟科樟属植物,其活性成分具有抗癌、清热和止痛等药用功效,在食品保鲜和驱虫杀菌方面也具有较大经济价值[17]。吴建挺等[18]研究表明,肉桂具有极强的抑菌作用,对供试的瓜果腐霉、终极腐霉、尖镰孢菌等均表现出完全的抑制性。肉桂精油在大肠杆菌、黑曲霉、枯草芽孢杆菌和其他霉菌上也表现出较强的抑菌活性[19—21]。目前国内外有关肉桂精油的研究主要集中在不同产地、组织和提取方法的化学成分差异分析和抑菌活性[17]等方面,而在果蔬保鲜上的研究较少。随着对绿色健康食品的要求不断提高,近年来,具有较强抑菌活性和防腐性的肉桂精油被应用于天然安全食品保鲜剂[22]。杨莹等[23]报道,肉桂精油能够保持救心菜(Coral dealbatus)质量,使其货架期延长。蒋梦䂀等[24]研究认为,肉桂精油与抗菌肽 Iturin A的复合配方可延长樱桃番茄(Solanum lycopersicum var.cerasiforme)的保鲜期。但目前尚未见肉桂精油对番茄采后病原菌抑菌效果的报道。本研究以番茄采后分离出的病原菌作为供试菌株,研究肉桂精油对番茄采后病原菌的抑菌效果,旨在为肉桂精油用于番茄采后病害控制和安全保鲜提供技术指导。
1 材料与方法
1.1 材料与仪器
樱桃番茄千禧品种由泉州市农业科学研究所国家农业科技园区种植,于果实商业成熟期采收,选择外观饱满圆润、表面无物理损伤和病害的果实;肉桂精油采购于多特瑞公司;马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA)培养基和马铃薯葡萄糖肉汤(Potato Dextrose Broth,PDB)培养基购于杭州百思生物技术有限公司;真菌DNA提取试剂盒、2×Taq PCR Master Mix、MarkerⅡ、6×Loading Buffer(溴酚蓝)、琼脂、核酸染料、吐温 20等购于北京索莱宝科技公司;通用引物ITS-1和ITS-4由生工生物工程(上海)股份有限公司合成。
Agilent 7890B/5977 GCMSD气质联用仪(安捷伦科技有限公司);立式压力蒸汽灭菌器HVE-50(广州华粤行仪器有限公司);SW-CJ-2D双人单面垂直送风净化工作台(苏州博莱尔净化设备有限公司);生化培养箱 SPX-150BE[邦西仪器科技(上海)有限公司]。
1.2 病原菌分离纯化及保存
挑选发病的番茄果实,将其表面用无菌水冲洗3次,在病斑交界处用接种针挑取菌落划线接入PDA平板培养基上,4 d 后从平板上分离单菌落至新的培养基。继续重复接种4至5代,待菌落表现均匀一致视为纯化完成。将纯化后的菌种接入PDA斜面培养基,长满斜面后于4 ℃冰箱保存。3个月左右转接一次。
1.3 病原菌rDNA-ITS扩增及测序
病原菌经液体培养7 d后,参照陈南泉等[25]和Fungal DNAkit真菌基因组DNA提取试剂盒说明书提取总 DNA,采用真菌通用引物 ITS-1(5′-TCCGTAGGTGAACCTGCGG-3′) 和 ITS-4(5′-TCCTCCGCTTATTGATATGC-3′)进行 PCR 扩增。反应体系及扩增条件参考姜雨萌等[26]的方法。PCR扩增产物经 1%琼脂糖凝胶电泳检测后送生工生物工程(上海)股份公司测序。
1.4 抑菌效果
1.4.1 体外抑菌试验
参考陈倩茹[27]的方法,于PDA固体培养基斜板培养7 d后的菌中挑取适量孢子,于无菌水中形成浓度约105个·mL-1孢子悬浮液,取100 μL于PDA培养基上涂布均匀,封口膜密封后放入28 ℃培养箱中培养7 d,形成病原菌平板。
将肉桂精油溶于0.2%乳化剂中,充分乳化后,加入培养基充分混匀,并设置7个浓度水平,分别为0.05、0.10、0.15、0.20、0.25和0.30 μL·mL-1。以0.2%吐温溶液作为对照,将各处理倒平板,用无菌打孔器从病原菌平板取直径6 mm菌斑,转移至平板中央,封口密闭后于28 ℃生化培养箱中培养,4 d后测量菌斑直径,计算抑菌率[9]。每处理3次重复。
1.4.2 抑菌圈测定
取100 μL悬浮液于PDA培养基上涂布均匀,倒置,采用纸片扩散法,将一片6 mm无菌滤纸放于培养皿盖中央,用移液枪吸取3、6和9 μL肉桂精油滴于滤纸上,以无添加肉桂精油的无菌水为对照,封口后于28 ℃培养箱中培养,于4 d后测量抑菌圈直径。每处理3次重复。
1.5 GC-MS分析
色谱条件:色谱柱 HP-5MS (30 m × 250 μm ×0.25 μm)进样口温度 230 ℃;载气为高纯氦气(99.999%)。恒流模式:流速 0.8 mL·min-1;分流比50:1;进样量1.0 μL。程序升温条件:初始温度45 ℃,持续 3 min,速率 3 ℃·min-1升至 280 ℃,持续 5 min。
质谱条件:电轰击电离(EI);电子能量 70 eV;离子源温度 250 ℃;接口温度 260 ℃;溶剂延迟4.0 min;扫描范围50~600 m/z。
采集模式为SCAN扫描,各峰经质谱数据系统检索及NIST 2014标准质谱图数据库比对,通过波峰面积归一化法进行定量分析,计算各成分的相对百分含量。
1.6 数据分析
测得 rDNA-ITS序列提交 GenBank,利用BLAST进行同源性比对,提取同源性最高的相关物种rDNA-ITS序列,确定病原菌种类,并利用MEGA6软件进行多序列比对,构建邻接树[11,25,28]。采用SPSS 16.0软件对肉桂精油在不同病原菌上的抑菌浓度和抑菌圈进行统计分析,采用邓肯多重比较分析差异显著性(P<0.05)。
2 结果与分析
2.1 病原菌rDNA-ITS序列分析
2.1.1 基因组rDNA-ITS序列扩增
对分离出不同形态的病原真菌进行 rDNA-ITS扩增,产物经1%琼脂糖凝胶电泳和紫外检测。结果表明,不同菌株序列长度存在差异,片段长度500~900 bp (图 1)。
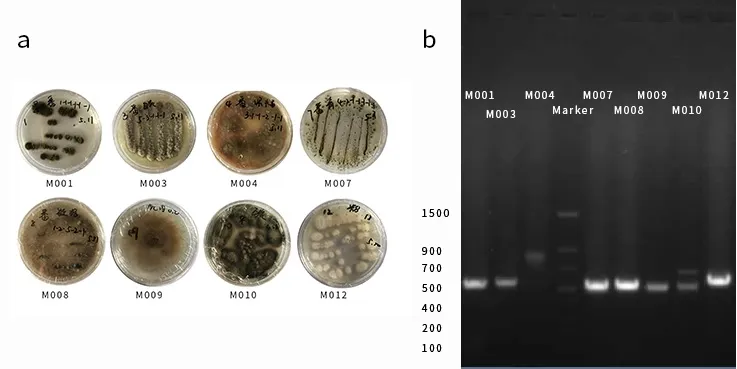
图1 病原菌的平板培养和rDNA-ITS PCR扩增Fig.1 The colonial morphology and rDNA-ITS PCR amplification of the eight pathogenic fungi
2.1.2 基于ITS序列的聚类分析
通过多序列比对,构建进化树,设置Bootstraps值为 1000,计算菌株所在进化树各分枝的置信度,按置信度超过95%以上归为一类,可将8株病原真菌分为5类(图2),每类各选取一个菌株进行BLAST对比及后续抑菌试验。BLAST比对结果表明,M001比对为枝孢属芽枝状枝孢菌(Cladosporium cladosporioides),M007为青霉属扩展青霉菌(Penicillium expansum),M008为链格孢属链格孢菌(Alternaria brassicae),M009为灰葡萄孢属灰葡萄孢菌(Botrytis cinerea)和M012为聚端孢属粉红单端孢菌(Trichothecium roseum)。

图2 8个病原菌的rDNA-ITS序列聚类分析Fig.2 Cluster analysis for rDNA-ITS domain sequences of the eight pathogenic fungi
2.2 肉桂精油对番茄5种病原菌的抑菌效果
2.2.1 最低抑菌浓度
比较肉桂精油对5种番茄病原菌(链格孢菌、灰葡萄孢菌、扩展青霉菌、粉红单端孢菌和芽枝状枝孢菌)的抑菌效果。结果表明,不同浓度肉桂精油对不同病原菌具有不同程度的抑制作用,且伴随着肉桂精油浓度的提高,抑制效果呈逐渐增强的趋势(图3)。当肉桂精油浓度为0.15 μL·mL-1及以上时,其抑制率显著高于 0.10 μL·mL-1及以下浓度处理(P<0.05)。肉桂精油浓度达 0.10 μL·mL-1时,对扩展青霉菌的抑制率达70%以上;升至0.25 μL·mL-1时,对扩展青霉菌的抑制率达100%,为该菌肉桂精油的最小抑菌浓度(MIC);在0.15 μL·mL-1时,对粉红单端孢菌的抑制率达100%;在0.2 μL·mL-1时,对链格孢菌的抑制率达100%,为该菌肉桂精油的最小抑菌浓度;在肉桂精油浓度为0.25 μL·mL-1时,对芽枝状枝孢菌的抑制率达100%,且对灰葡萄孢菌的抑制率均达到 70%以上;当浓度上升至 0.30 μL·mL-1时,对灰葡萄孢菌的抑制率达100%,为该菌的最小抑菌浓度。
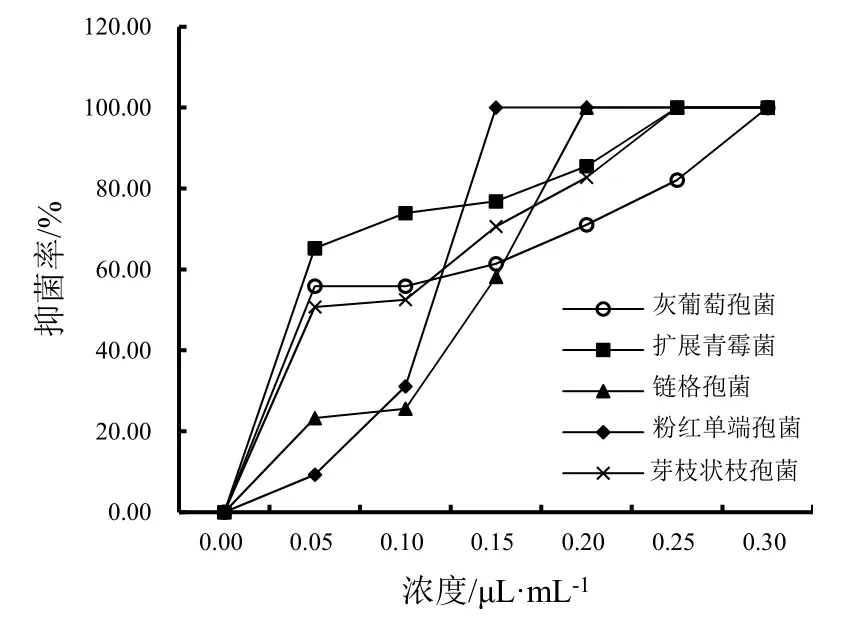
图3 不同浓度肉桂精油对番茄5种病原菌的体外抑菌效果Fig.3 The inhibition effects of different concentrations of cinnamon essential oil on 5 tomato pathogens in vitro
2.2.2 肉桂精油对不同病原菌的抑菌圈比较
利用抑菌圈测定供试菌种对精油抑菌效果的敏感程度。如图4所示,随着肉桂精油浓度的增加,敏感程度增加,表明抑菌效果逐渐增大。通过肉桂精油对不同菌种抑制程度的比较(表1),抑制效果最佳的是粉红单端孢菌;其次为灰葡萄孢菌、链格孢菌、扩展青霉菌,抑制效果最弱的为芽枝状枝孢菌;9 μL精油用量时抑菌圈未达50 mm。
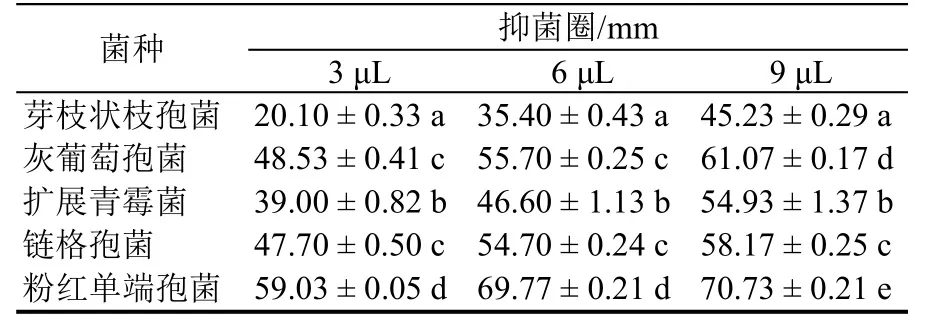
表1 肉桂精油对番茄5种病原菌的抑菌圈Table 1 The inhibition zone of cinnamon essential oil on the five tomato pathogenic fungi
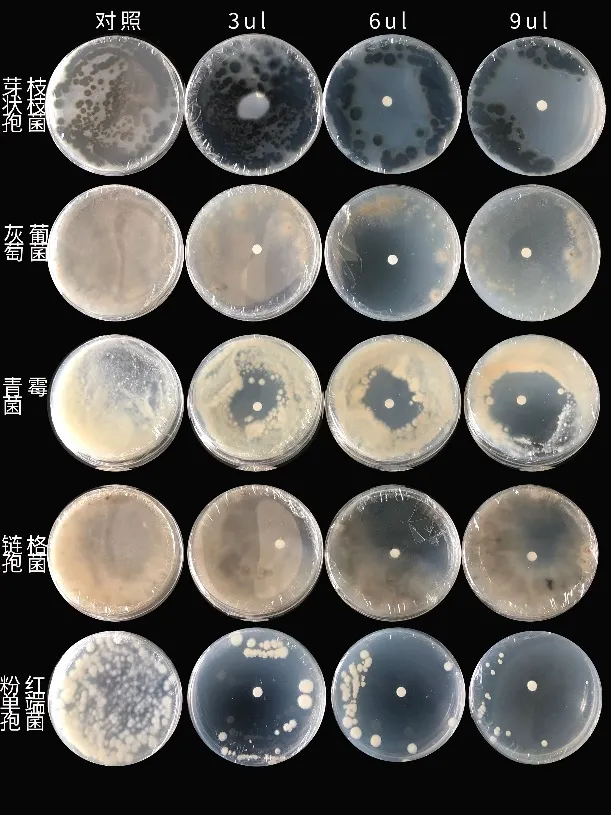
图4 肉桂精油对番茄5种病原菌的抑菌圈Fig.4 The inhibition zone of cinnamon essential oil on the five tomato pathogenic fungi
2.3 肉桂精油GC-MS分析
分析肉桂精油成分,得到肉桂精油总离子流图,共分离出53个峰(图5),确认主要色谱峰,共分析鉴定出29种化合物,其相对百分含量占色谱总流出峰的92.56%(表2)。其中,芳香族醛类占58.90%、烯烃类占10.59%、酚醇类占13.56%、羧酸及酯类占7.08%,其他占2.43%。已鉴别出的29种化合物中,已报道具有抗菌作用的成分主要有反式肉桂醛(相对含量 58.34%,下同);其次为丁香酚(8.76%)、芳樟醇(3.57%)。具有抗菌活性的成分占已鉴别出的化学成分总含量的76.35%。其他成分的功能主要有镇痛和抗炎等作用。
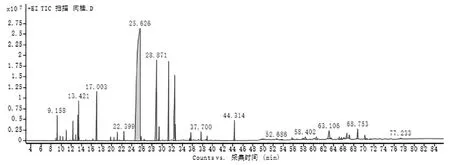
图5 肉桂精油化学成分总离子流图Fig.5 Total ion flow map of cinnamon essential oil chemical composition
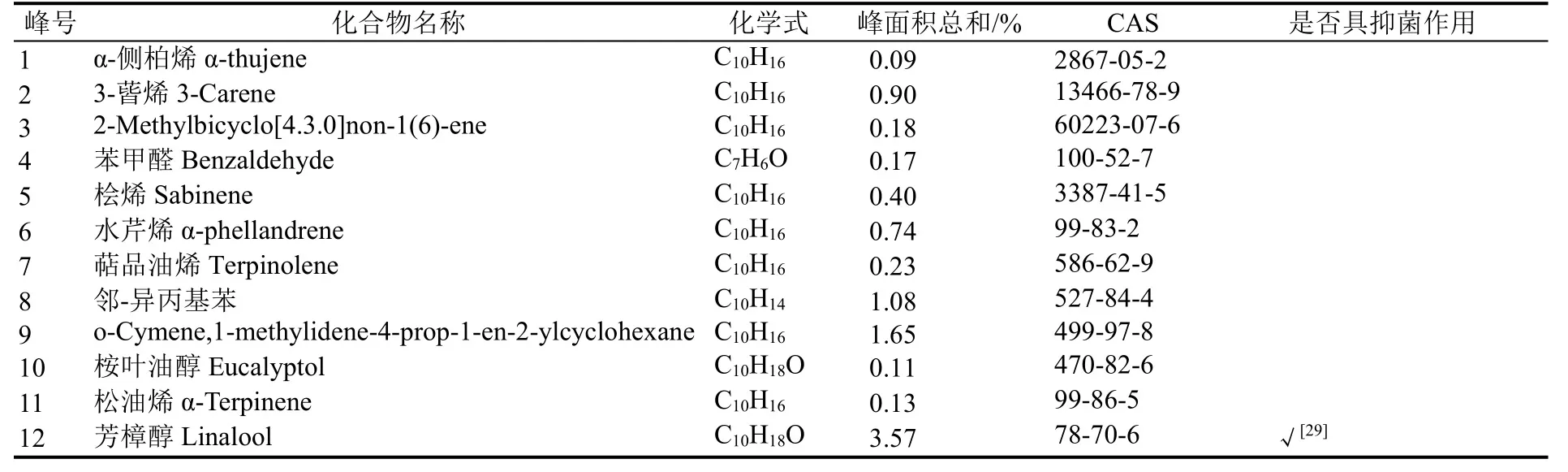
表2 肉桂精油化学成分Table 2 The chemical composition of cinnamon essential oil

(续表)
3 讨论
番茄采后病害有灰霉病、黑霉病、青霉果腐病、早疫病、晚疫病和粉红病等,分别由灰葡萄菌、黑霉菌链格孢、扩展青霉菌、茄链格孢菌、致病疫霉菌和粉红单端孢菌等引起[6—14]。本次实验以种植推广面积大和经济价值高的樱桃番茄品种千禧番茄为供试材料,利用 rDNA-ITS测序鉴定出灰葡萄菌、链格孢菌、扩展青霉菌、芽枝状枝孢菌和粉红单端孢菌5种不同类型的病原菌,与前人研究结果基本一致。随着 Genbank数据库的不断丰富,利用rDNA-ITS测序鉴定菌种是一种快速和经济有效的方式,可应用于不同作物的病原菌快速鉴定。
利用GC-MS联用仪对肉桂精油进行成分分析,共鉴定出肉桂精油中的29种组分,分别为醚、烯、醇和酯类等化合物。其中抗菌成分占总成分的80%以上,包括反式肉桂醛(相对含量占 58.34%)、丁香酚(8.76%)、乙酸桂酯(5.91%)和芳樟醇(3.57%)等成分。肉桂精油对分离出的5种番茄病原菌株均有较好的抑菌效果,尤其对粉红单端孢菌具有显著的抑菌效果,最小抑菌浓度为0.15 μL·mL-1,抑菌圈可达70 mm以上;当肉桂精油浓度达到0.2 μL·mL-1时,对5种番茄病原菌的抑制率均可达到70%以上。体外直接接触抑菌试验结果显示,肉桂精油对番茄病原菌抑制效果由强到弱依次为粉红单端孢菌、链格孢菌、扩展青霉菌、芽枝状枝孢菌、灰葡萄孢菌。进行抑菌圈实验时,9 μL肉桂精油对5种番茄病原菌的抑菌圈大小均可达40 mm以上,抑制效果最佳的是粉红单端孢菌,对芽枝状枝孢菌效果较差。肉桂精油的抑菌成分含量非常高,是其具有广谱抑菌的基础。
综上,肉桂精油对多种番茄病原菌的抑制效果好,且在肉桂精油用量较低时也具有一定的抑制作用。因此,肉桂精油作为天然、安全的保鲜剂,可用于番茄采后病害控制,为番茄采后安全保鲜、延长其保鲜期提供技术指导。

