性激素检测在不孕症诊断中的应用价值
张欣,王明,刘志敏
北京市平谷区中医医院检验科,北京 101200
不孕症是指夫妻在未采取避孕且正常性生活情况下1~2年尚未生育或成功受孕的患者,临床症状主要为少精、稀发月经、痛经和闭经等,并导致附件增厚、肿物、压痛及阴道分泌物增多,少数患者出现分泌及毛发分布异常[1]。有研究报道,全球范围内约有0.8~1.0亿的不孕症患者,且不孕症发生与性传播、晚婚晚育、生理疾病、内分泌紊乱及人工流产等因素有关[2]。目前临床诊断不孕的方法主要包括:超声、CT、核磁共振等,但该类方法鉴别诊断原发性和继发性不孕症的效果不尽理想。随着近几年不孕症临床研究的深入,不孕症与女性内分泌失调关系密切,其发病可能因机体内性激素水平紊乱所致[3]。有研究证实,不孕症患者中性激素水平均有不同程度紊乱,通过检测有助于评估病情及指导治疗[4]。鉴于此,该研究比较2020年1—12月该院收治的60例不孕症与60名体检者催乳素(PRL)、睾酮(T)、孕酮(P)、雌二醇(E2)、黄体生成素(LH)和促卵泡生成激素(FSH)等性激素水平,旨在为后续诊治提供参考意见。现报道如下。
1 资料与方法
1.1 一般资料
选取该院收治的60例不孕症患者作为不孕组,不孕者诊断均符合《临床妇科内分泌与不孕》中的诊断标准,配偶均无生育功能异常,经超声及影像学联合检查确诊,未有因子宫内膜异位症、子宫发育不良及先天性生理缺陷所致的不孕症,未合并严重心肝肾等脏器障碍、神经异常及精神障碍[5]。同时选取同期60名常规健康体检者作为对照组,患者诊断前未服用影响机体激素水平的药物,且既往无人工流产病史。不孕组:患者年龄22~40岁,平均年龄(33.47±2.88)岁;不孕病程1~4年,平均病程(2.00±0.14)年。对照组21~39岁,平均年龄(33.37±2.97)岁。两组一般资料比较差异无统计学意义(P>0.05)。该研究患者均签署知情同意书且研究经伦理委员会批准。
1.2 方法
测定前常规予以禁饮禁食,叮嘱被检者测定前一天保证睡眠充足、心态平和及情绪稳定。抽取被检者检测当天清晨空腹状态下肘静脉血约3 mL,离心(3 500 r/min)15 min分离血清,并置于超低温冰箱存储备检。采用全自动化学发光分析仪(雅培i2000SR)对PRL、T、P、E2、LH和FSH等性激素水平进行测定。
1.3 观察指标
比 较 不 孕 组 患 者 和 对 照 组PRL、T、P、E2、LH和FSH等性激素水平。比较两组不同月经周期PRL、T、P、E2、LH和FSH等性激素水平。
1.4 统计方法
采用SPSS 20.0统计学软件分析数据,计量资料均符合正态分布,以()表示,组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组性激素水平比较
两组PRL、T、P、E2、LH等性激素水平比较发现,不孕组患者T、LH、PRL水平显著高于对照组(P<0.05),不孕组患者P、E2水平显著低于对照组(P<0.05),而两组FSH水平比较差异无统计学意义(P>0.05),见表1。
表1 两组6项性激素水平比较()
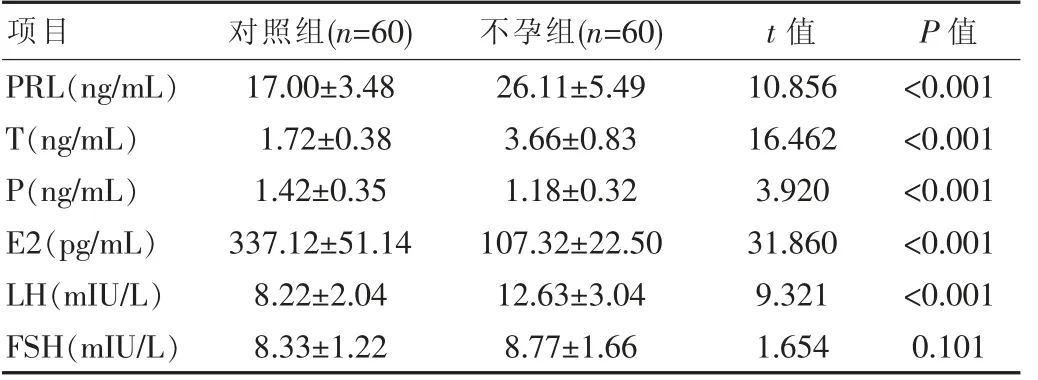
表1 两组6项性激素水平比较()
?
2.2 两组各分期水平6项性激素水平比较
不孕组患者卵泡期LH、PRL、T、P和FSH水平显著低于对照组,而E2水平显著高于对照组(P<0.05)。排卵期时,不孕组患者LH、E2和FSH水平显著高于对照组(P<0.05)。黄体期时,不孕组患者LH、PRL水平显著低于对照组,而P水平显著高于对照组(P<0.05)。见表2。
表2 两组各分期水平6项性激素水平比较()
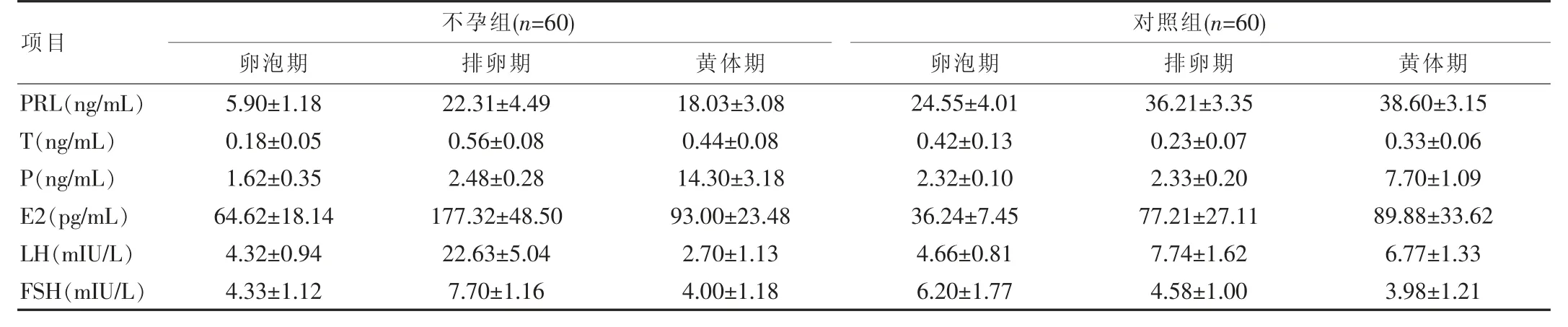
表2 两组各分期水平6项性激素水平比较()
项目 不孕组(n=60) 对照组(n=60)卵泡期排卵期 黄体期 卵泡期 排卵期 黄体期PRL(ng/mL)T(ng/mL)P(ng/mL)E2(pg/mL)LH(mIU/L)FSH(mIU/L)5.90±1.18 0.18±0.05 1.62±0.35 64.62±18.14 4.32±0.94 4.33±1.12 22.31±4.49 0.56±0.08 2.48±0.28 177.32±48.50 22.63±5.04 7.70±1.16 18.03±3.08 0.44±0.08 14.30±3.18 93.00±23.48 2.70±1.13 4.00±1.18 24.55±4.01 0.42±0.13 2.32±0.10 36.24±7.45 4.66±0.81 6.20±1.77 36.21±3.35 0.23±0.07 2.33±0.20 77.21±27.11 7.74±1.62 4.58±1.00 38.60±3.15 0.33±0.06 7.70±1.09 89.88±33.62 6.77±1.33 3.98±1.21
3 讨论
不孕症临床较为多见,是指12个月内性生活正常及未予以任何避孕情况下仍难以成功妊娠[6]。不孕症主要致病因素主要为免疫因素、内分泌失调、排卵障碍、多次刮宫、输卵管因素及子宫内膜容受性异常等[7]。不孕症不仅给患者带来极大心理负担,同时严重影响患者生存质量[8]。大量研究证实,不孕症患者体内多合并性激素失调,约50%不孕患者通常因内分泌失调所导致[9-10]。下丘脑-垂体-卵巢轴是女性人群发育、卵巢功能调节、卵泡成熟及排卵等生理功能的控制轴,与机体内内分泌功能及神经中枢互相调节,一旦调节过程中发生任何差错均会引起性激素紊乱,对正常排卵造成影响,并出现闭经及月经不调等症状,最终引发不孕症[11],因此临床有效检测血清性激素水平对提高女性不孕症具有重要意义。性激素六项指标检测是临床评估人体内分泌情况的重要方式,为分析性激素六项指标在评估或诊治不孕症中的临床价值,该研究选取60例不孕症女性及60名健康体检女性,对两组PRL、T、P、E2、LH和FSH等性激素水平进行比较。垂体前叶均可分泌LH和FSH,在月经周期过程中两者分泌呈脉冲式,时间上有显著差异。FSH一般受下丘脑分泌的黄体激素释放因子影响,且其水平随着P和E2的改变而改变。FSH水平在女性排卵之前会不断增加,并增加至峰值水平。该次研究结果显示:卵泡期对照组与不孕组FSH[(6.20±1.77)ng/mL vs(4.33±1.12)ng/mL]水平比较差异有统计学意义(P<0.05),说明FSH可作为评估卵泡期不孕症患者的重要指标,但并非各个时期的评价指标。LH水平在月经中期达到高峰后,能显著加速排卵,并一定程度预测排卵时间[12]。该次研究显示:不孕症患者卵泡期[(4.32±0.94)ng/mL vs(4.66±0.81)ng/mL]、排卵期[(22.63±5.04)ng/mL vs(7.74±1.62)ng/mL]及黄体期[(2.70±1.13)ng/mL vs (6.77±1.33)ng/mL]LH水平与对照组比较差异有统计学意义(P<0.05),说明LH是诊断不孕症的重要指标之一。PRL是由垂体前叶嗜酸细胞分泌生成,是一种单纯蛋白质激素,通常情况下,乳房受到机械刺激或正常哺乳均会对PRL释放产生影响,同时情绪反应、睡眠及低血糖也会一定程度促进PRL分泌[13-14]。PRL在女性体内作能促进乳腺生长发育,并维持乳汁分泌,同时其与糖皮质激素、P和E2共同发挥临床作用[15]。该研究显示:不孕组排卵期PRL[(22.31±4.49)ng/mL vs(36.21±3.35)ng/mL]与对照组比较差异无统计学意义(P>0.05),其表明PRL作为诊断不孕症的参考性较差。P能使子宫内膜细胞体积得以增加,并提高糖原含量,分泌腺分泌黏液(含有糖原)进入分泌物,从而确保受精卵顺利着床[16]。该研究结果显示:不孕症卵泡期[(1.62±0.35)ng/mL vs(2.32±0.10)ng/mL]、排卵期[(2.48±0.28)ng/mL vs(2.33±0.2)ng/mL]及黄体期[(14.30±3.18)ng/mL vs(7.70±1.09)ng/mL]时P与对照组比较差异有统计学意义(P<0.05),说明P可作为临床诊断不孕症的参考指标。E2能促进阴道、子宫、输卵管、卵巢等器官成熟,当女性在青春期时,机体不断发育,E2分泌受到一定影响,并促进生殖器官发育[17]。若E2分泌过多时,女性会出现早熟,当E2分泌过少时会表现为发育不良[18-19]。研究显示,两组E2水平排卵期时比较差异无统计学意义(P>0.05),故E2作为诊断不孕症临床意义不大。女性机体内T由卵巢、肾上腺皮质分泌及雄烯二酮转化而得,T作用主要是加速阴泵、阴唇和阴蒂发育,并一定程度抵抗E2,并对女性全身代谢带来不利影响。研究结果发现,不孕组患者[(0.18±0.05)ng/mL vs(0.42±0.08)ng/mL]、排卵期[(0.56±0.08)ng/mL vs(0.23±0.07)ng/mL]及黄体期[(0.44±0.08)ng/mL vs (0.33±0.06)ng/mL]T水平与对照组比较差异有统计学意义(P<0.05)。相关等研究报道,不孕症患者其LH[(38.2±4.30)mIU/mL vs(8.21±3.32)mIU/mL]、P[(1.15±0.85)ng/mL vs(381.84±114.15)ng/mL]、E2[(102.15±36.23)pg/mL vs(396.54±57.64)pg/mL]、PRL [(415.15±116.86)ng/mL vs(3.21±1.12)ng/mL]、T[(3.87±0.80)ng/dl vs(1.61±0.90)ng/dl]与对照组比较差异有统计学意义(P<0.05),两组FSH[(8.31±2.92)mIU/mL vs(7.25±2.33)mIU/mL]比较差异无统计学意义(P>0.05),其与该研究上述结果相一致。
综上所述,不孕组女性均具有一定程度的内分泌失调,对性激素指标进行检测有助于评估患者生理和内分泌功能,可为不孕症的临床诊治提供参考意见。

