第二代蛋白酶体抑制剂对类风湿性关节炎模型大鼠的干预效果及作用机制研究
王 平,王华勇,王 浩
枣阳市第一人民医院康复科,湖北枣阳 441200
类风湿性关节炎作为一种自身免疫性疾病,主要临床表现为关节晨僵、肿胀、疼痛等,如果得不到及时治疗,则会导致关节畸形,使关节丧失正常功能[1-2]。类风湿性关节炎主要以关节病变为主,有着较高的发病率和致残率,是一种全身性的疾病,严重影响患者的生活质量[3-4]。该病的发病较为隐匿,通常是从手指的近端关节、手掌关节最先起病,逐渐变为对称性的关节受累。类风湿性关节炎的病因仍未完全明确,目前该病仍未找到治疗的理想药物[5]。卡非佐米作为第二代蛋白酶抑制剂,相较于第一代蛋白酶抑制剂,具有抗多发性骨髓瘤的高效性及低毒性,且能够一定程度地破坏类风湿性关节炎诱导的核因子-κB(NF-κB)活化,抑制破骨细胞的分化和形成,但第二代蛋白酶抑制剂能否用于临床治疗类风湿关节炎目前尚不清楚。所以,本研究使用第二代蛋白酶体抑制剂对类风湿性关节炎模型大鼠进行治疗,旨在探讨第二代蛋白酶体抑制剂对类风湿性关节炎模型大鼠的干预效果及作用机制。
1 资料与方法
1.1一般资料 选取健康SD雄性大鼠(上海杰思捷公司) 30只,体质量165~190 g,平均(177.5±11.87)g,按照随机数字法分为正常组、模型组、抑制剂组,各10只,于23 ℃、45%~55%湿度环境下喂养,饮用水与饲料均进行消毒后供实验大鼠自由进食。
1.2主要试剂 兔源织织NF-κB/p65单克隆抗体(CST公司);兔源核因子-κB抑制蛋白α(IκBα)单克隆抗体(Abcam公司);卡非佐米(艾酶捷科技有限公司);完全弗氏佐剂(北京博蕾德生物科技有限公司)。
1.3方法
1.3.1类风湿性关节炎建模及给药 建模:参照陈璐璐等[6]研究中的方法造模,30只大鼠正常喂养1周后,正常组10只SD大鼠不予处理,对剩余20只大鼠进行建模。对模型组大鼠及抑制剂组大鼠右后足进行消毒后注射完全弗氏佐剂,每只0.1 mL,1周后在模型组、抑制剂组大鼠右后足进行消毒,消毒后注射不完全弗氏佐剂进行强化免疫,造模11 d后,当各组造模大鼠耳部、尾部结节等部位出现全身炎性反应时,视为造模成功。最终建模成功18只,随机分为模型组9只,抑制剂组9只。给药:抑制剂组SD大鼠在建模成功第1天起每隔2天对大鼠腹腔内注射第二代蛋白酶体抑制剂(溶解于0.5 mL DMSO溶剂中的1.5 mL卡非佐米)。
1.3.2关节炎评分标准[7]评分标准:无红肿为0分,小趾关节轻度红肿为1分,小趾关节和足跖肿胀为2分,踝关节下指甲肿胀为3分,所有指甲、关节肿胀为4分。按此标准对大鼠四肢病变程度进行评价并积分,计算关节炎评分。
1.3.3标本制备及染色 实验第28天时,全身麻醉处死各组大鼠,在大鼠股动脉处取15 mL股动脉血,离心取得上清液,于-80 ℃冰箱保存待检,另取得大鼠踝关节及膝关节滑膜组织,置于-80 ℃冰箱保存待检。取大鼠踝关节液氮冷冻后常规脱水、透明、石蜡包埋,3 μm连续切片,将切片烤干后进行脱蜡处理,之后顺序置入不同浓度的乙醇中。使用苏木精染色15 min后清洗3次,使用1% HCL-乙醇分化处理30 s,清洗之后使用1%伊红染色,使用乙醇进行脱水处理后进行脱蜡处理,封片后使用显微镜进行观察。
1.3.4检测方法 采用透射比浊法[8]检测TNF-α、IL-6、IL-10、ALT、AST水平,采用Western blot法检测NF-κB/p65、IκBα蛋白表达情况,采用酶联免疫吸附试验检测SD大鼠IgA、IgM水平。
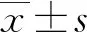
2 结 果
2.1各组大鼠关节滑膜组织病理图 正常组大鼠关节滑膜组织健全,表面较平整光滑,关节滑膜组织中未见充血、水肿、增生的现象,未见炎症细胞的侵入;模型组大鼠关节滑膜组织厚度增加,滑膜组织绒毛状增生,并伴有大量的炎症细胞入侵;抑制剂组大鼠关节滑膜组织细胞增生减少,有着少量的炎症细胞入侵。见图1。
注:A为正常组;B为模型组;C为抑制剂组。
2.2抑制剂组与模型组大鼠不同时间点关节炎评分比较 建模后第7、14、21天,抑制剂组大鼠的关节炎评分较模型组下降,差异有统计学意义(P<0.05)。见表1。

表1 抑制剂组与模型组大鼠不同时间点关节炎评分分]
2.3各组大鼠体内炎症因子水平比较 与正常组相比,模型组大鼠TNF-α、IL-6水平上升,IL-10水平下降,且抑制剂组大鼠TNF-α、IL-10水平下降,IL-6水平上升,差异有统计学意义(P<0.05);与模型组大鼠相比,抑制剂组大鼠TNF-α、IL-6水平下降,IL-10水平上升,差异有统计学意义(P<0.05)。见图2。
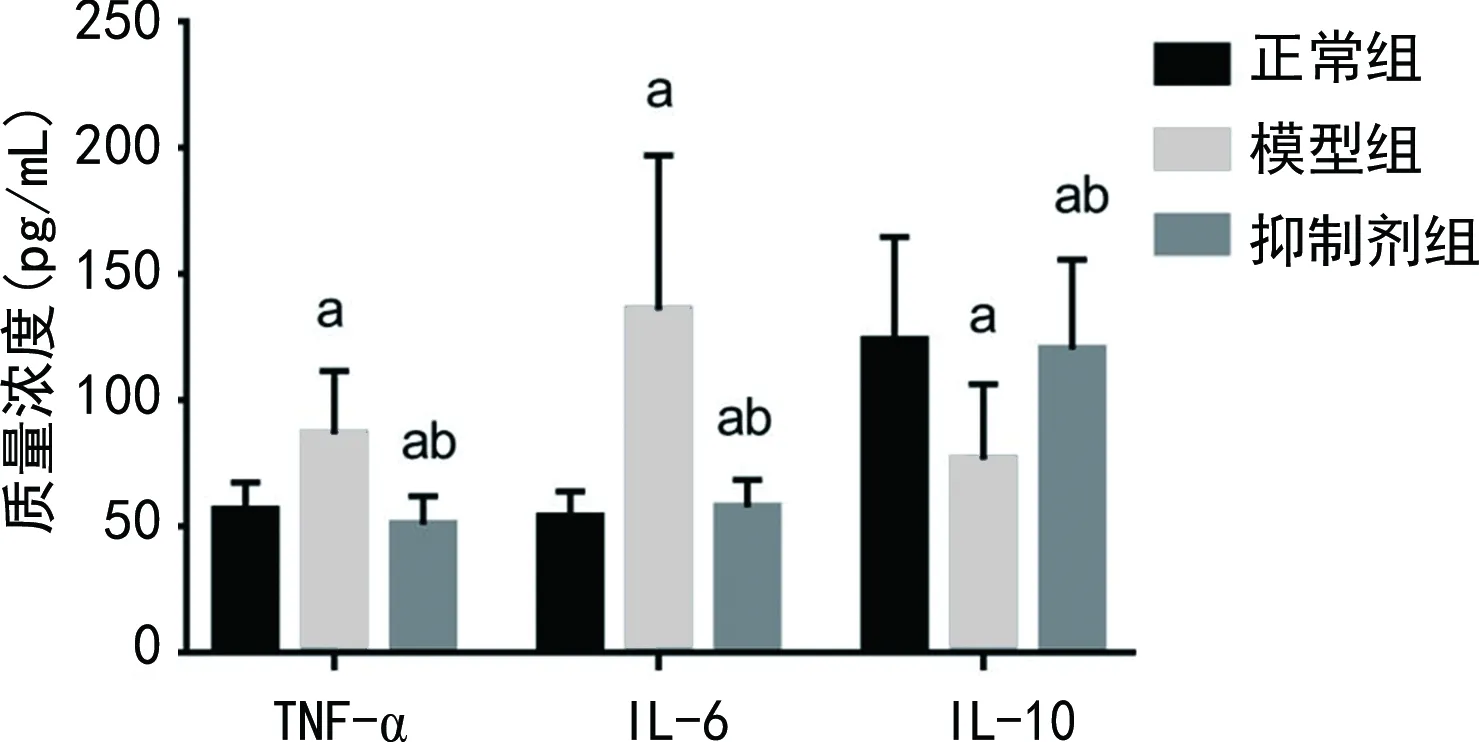
注:与正常组相比,aP<0.05;与模型组相比,bP<0.05。
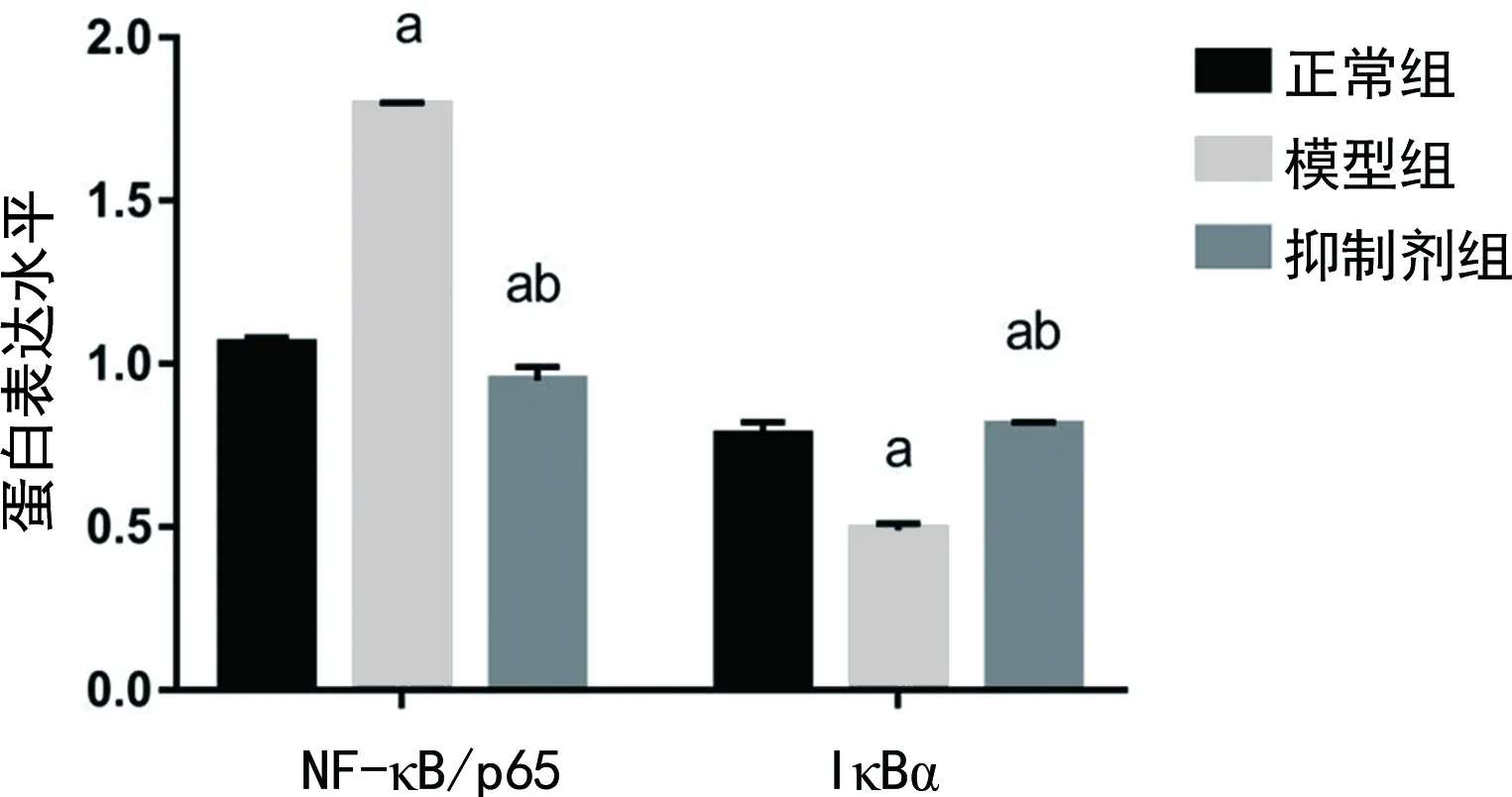
2.4各组大鼠关节滑膜组织NF-κB/p65、IκBα蛋白表达水平比较 与正常组相比,模型组大鼠关节滑膜组织NF-κB/p65水平上升,IκBα水平下降,且抑制剂组大鼠关节滑膜组织NF-κB/p65水平下降,IκBα水平上升,差异有统计学意义(P<0.05);与模型组相比,抑制剂组关节滑膜组织NF-κB/p65水平下降,IκBα水平上升,差异有统计学意义(P<0.05)。见图3、4。

注:A为正常组;B为模型组;C为抑制剂组。
2.5各组大鼠IgA、IgM水平比较 与正常组相比,模型组大鼠IgA、IgM水平上升,且抑制剂组大鼠IgA、IgM水平上升,差异有统计学意义(P<0.05);与模型组相比,抑制剂组大鼠IgA、IgM水平下降,差异有统计学意义(P<0.05)。见图5。
2.6各组大鼠ALT、AST水平比较 与正常组相比,模型组大鼠ALT、AST水平上升,且抑制剂组大鼠ALT水平下降,AST水平上升,差异有统计学意义(P<0.05);与模型组相比,抑制剂组大鼠ALT、AST水平下降,差异有统计学意义(P<0.05)。见图6。
注:与正常组相比,aP<0.05;与模型组相比,bP<0.05。

注:与正常组相比,aP<0.05;与模型组相比,bP<0.05。
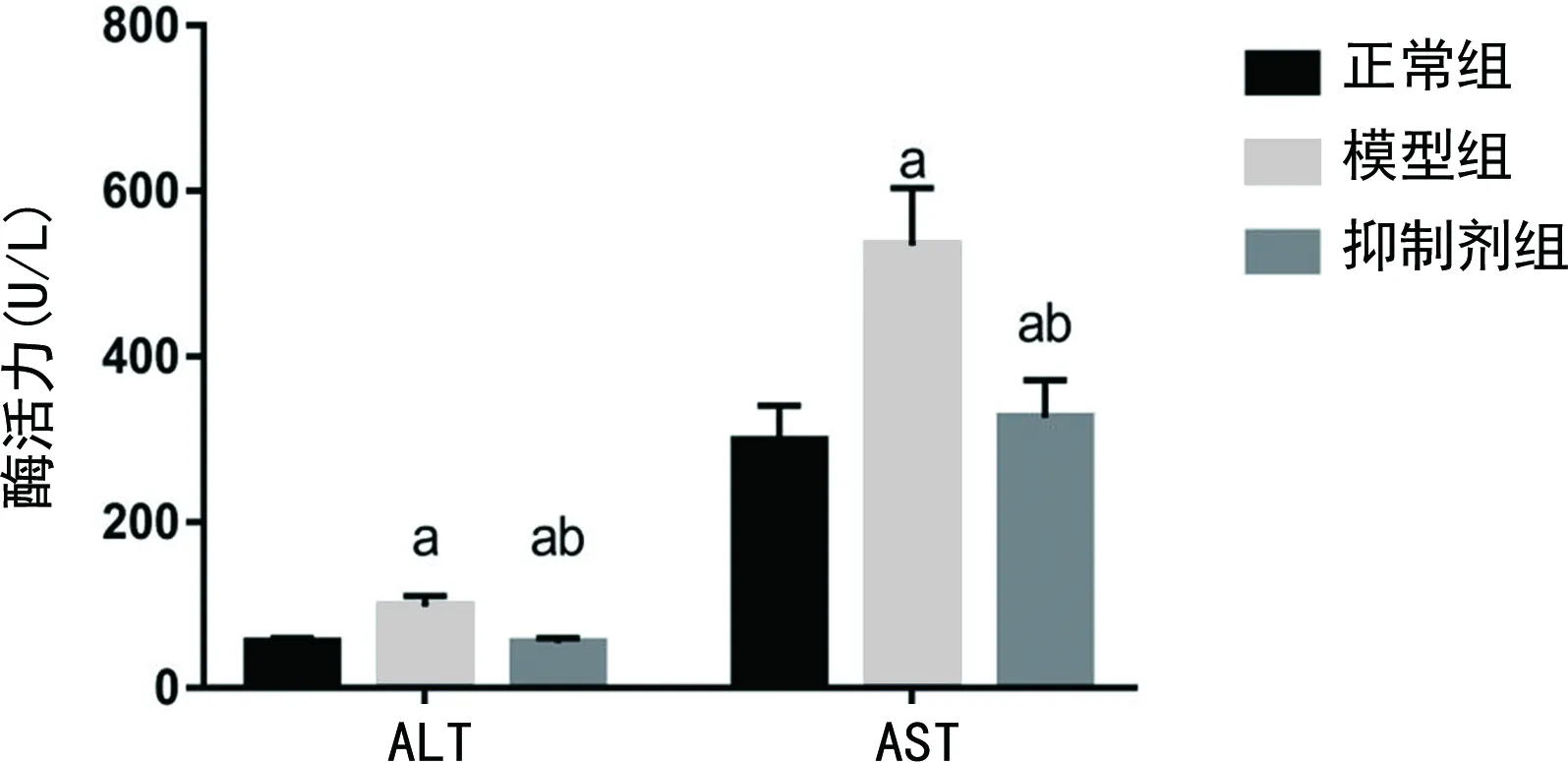
注:与正常组相比,aP<0.05;与模型组相比,bP<0.05。
3 讨 论
类风湿性关节炎是一种以关节病变为主的慢性自身免疫性疾病,该病在任何年龄段均可发病,以20~50岁为主,女性发病率是男性的2~3倍[9]。蛋白酶抑制剂在广义上指的是与蛋白酶分子活性中心上的一些基团的结合,使得蛋白酶活力下降,甚至消失,但不使酶蛋白变性的物质[10]。第二代蛋白酶抑制剂相较于一代蛋白酶抑制剂而言,具有抗多发性骨髓瘤的高效性和低毒性的特点。卡非佐米作为第二代蛋白酶抑制剂,是一种特异性、不可逆的靶向抑制剂,适用于多发性骨髓瘤患者的治疗[11]。
临床研究表明,类风湿性关节炎的发生、发展与机体炎症有着密切关联[12-13]。TNF-α、IL-6、IL-10是临床较为常用的炎症因子,通过检测TNF-α、IL-6、IL-10水平能够较为准确地评价类风湿性关节炎发展情况[14]。当关节滑膜周围的巨噬细胞被激活,产生大量的炎性介质,炎性介质配合促炎因子、生长因子、趋化因子等,能够引发炎症,从而导致关节出现损伤。张传英等[15]的研究显示,类风湿性关节炎大鼠炎性标志物水平出现异常,对类风湿性关节炎大鼠进行有效的治疗,能够调控炎性标志物水平,抑制机体炎性反应。本研究结果显示,采用第二代蛋白酶体抑制剂对类风湿性关节炎模型大鼠进行治疗后,大鼠TNF-α、IL-6水平下降,IL-10水平上升,说明TNF-α、IL-6、IL-10有着密切关系,对TNF-α、IL-6、IL-10进行检测有助于判断类风湿性关节炎的发生、发展情况。
ALT存在于各种细胞内,以肝脏、心脏组织细胞为主,当其发生病变时,ALT水平会急剧增加[16]。AST主要分布在心肌,其次是肝脏、骨骼肌等组织中[17]。肖燕等[18]的研究显示,类风湿性关节炎大鼠ALT、AST水平异常上升,进行有效治疗后,类风湿关节炎大鼠ALT、AST水平降低。本研究结果显示,使用第二代蛋白酶体抑制剂对类风湿性关节炎大鼠进行治疗后,大鼠ALT、AST水平下降,与上述研究一致,说明使用第二代蛋白酶体抑制剂对类风湿性关节炎大鼠的治疗效果较好。
相关资料显示,NF-κB在众多炎症和免疫反应的调节中具有重要作用,也是炎性反应调控机制中的中心环节[19]。NF-κB参与多种细胞因子表达调控,如抗凋亡蛋白、Toll受体、细胞因子受体及诱导型氧化氮合酶的表达。有研究表明,NF-κB的激活、失活与泛素-蛋白酶体通路之间存在密切联系,在免疫细胞炎性反应机制研究中是关注热点[20]。泛素系统通过蛋白酶体降解NF-κB的抑制蛋白IκB,参与调节免疫炎症细胞NF-κB的激活和再循环。NF-κB通常以无活性的形式存在于未受刺激的细胞内,其能够调节免疫、炎性反应、细胞增殖及细胞凋亡[21]。本研究结果发现,使用第二代蛋白酶体抑制剂对类风湿性关节炎大鼠进行治疗,能够激活IκBα,抑制NF-κB/p65通路。
综上所述,利用第二代蛋白酶体抑制剂对类风湿性关节炎模型大鼠进行治疗,能够通过抑制NF-κB/p65通路,调节大鼠体内的炎症因子水平,降低关节炎的严重程度,效果显著。

