MRI对乳腺黏液癌和纤维腺瘤的鉴别诊断价值
陈 艳,崔 利,何江波,吴晓燕,郭宝聪,彭雨彬,詹松华
(1.上海市宝山区中西医结合医院放射科,上海 201900;2.上海中医药大学附属曙光医院放射科,上海 201203)
乳腺黏液癌(mucinous breast carcinoma,BMC)是一种特殊类型的乳腺癌,临床较少见,约占所有原发性浸润性乳腺癌的3.0%[1]。相对其他病理类型的乳腺癌,BMC生长缓慢、转移率低、预后较好,但术前诊断对保证疗效和改善预后尤为重要[2]。BMC在病理学上表现为肿瘤细胞内外大量的细胞外上皮黏液,临床表现缺乏特异性,与纤维腺瘤的超声影像具有相似的形态学特征,鉴别诊断存在一定困难[3]。近年来,MRI检查在乳腺病变的诊断及鉴别诊断中越来越重要[4]。现回顾性分析13例BMC的MRI表现,并与39例纤维腺瘤比较,探讨MRI在BMC诊断及其与纤维腺瘤鉴别诊断中的价值,为术前明确诊断及治疗方案的选择提供参考。
1 资料与方法
1.1 一般资料 收集2017年1月至2019年7月上海市宝山区中西医结合医院收治的13例BMC和39例纤维腺瘤的临床资料,术前均行MRI检查,并经术后病理或穿刺病理证实,均未接受放化疗或其他抗肿瘤治疗。患者均为女性,年龄29~76岁,平均(55.8±5.8)岁。BMC组13例的病理类型均为单纯型,年龄29~79岁,平均(57.1±6.3)岁;病灶位于左侧5例,右侧6例,双侧2例;直径1.8~5.4 cm,平均(2.9±1.3)cm。纤维腺瘤组39例,年龄18~71岁,平均(53.2±4.2)岁;病灶位于左侧10例,右侧9例,双侧20例;直径1.4~5.6 cm,平均(3.1±1.1)cm。
1.2 仪器与方法 采用Siemens Magnetom Verio 3.0 T乳腺专用超导型MRI扫描仪,16通道专用线圈。患者取俯卧位,双乳自然下垂,胸部紧贴线圈。扫描序列与参数:横断面T1WI平扫,层厚1.5 mm,层距0.3 mm,TR 5.1 ms,TE 2.46 ms,矩阵384×384;横断面T2WI平扫,层厚4 mm,层距0.8 mm,TR 3 500 ms,TE 54 ms,矩阵384×384;矢状面T2WI平扫,层厚4 mm,层距0.8 mm,TR 4 200 ms,TE 102 ms,矩阵320×320。动态增强扫描采用3D-FLASH序列,层厚1.5 mm,层距0.3 mm,TR 4.47 ms,TE 1.74 ms,矩阵416×386。第1个时相后,使用高压注射器经手背静脉注入对比剂Gd-DTPA,剂量0.1 mmol/kg体质量,流率2.0 mL/s,之后注入等量生理盐水冲洗,连续扫描6个时相,每个时相58 s。
1.3 MRI图像处理及分析 将所得数据导入Siemens Syngo工作站,依据美国放射学会发布的2013版MRI乳腺影像报告与数据系统(BI-RADS)[5],结合病灶大小、形态、边缘、有无低信号分隔、早期强化方式、内部强化方式等影像学表现,选取强化最明显的ROI,绘制TIC。对于多发病灶,观察最大病灶的MRI表现。由2位从事乳腺MRI诊断的放射科资深医师共同阅片。生成ADC图,并选取ROI测量ADC值,测量3次取平均值。以100~120 s为界根据信号变化将TIC分为3种类型[6]:流入型(Ⅰ型),TIC迅速升高至峰值后呈平稳上升趋势,持续渐进强化;平台型(Ⅱ型),维持于峰值水平;廓清型(Ⅲ型),达到峰值后呈下降趋势。
1.4 统计学方法 应用SPSS 20.0统计软件进行数据分析,计数资料比较行χ2检验,等级资料比较行秩和检验,计量资料比较行成组t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 2组MRI表现比较(表1)2组在单发/多发、形态、出血、早期及晚期强化方式,差异均有统计学意义(均P<0.05)。2组边缘是否清晰、有/无T2WI低信号分隔及ADC 值比较,差异均无统计学意义(均P>0.05)(图1、2)。

图1 女,65岁,乳腺黏液癌,发现左乳肿块1年余 图1a T1WI示左乳肿块,形态规则,边界清晰,病灶大部分呈稍低信号,边缘见环形信号 图1b T2WI示病灶大部分呈高信号,边缘及其内分隔呈相对低信号 图1c 增强扫描早期病灶见边缘不规则环形强化,中央区无强化图1d 增强扫描晚期病灶强化范围增大,强化程度增加,可见其内分隔强化,中央见少许无强化区 图1e 病灶ADC值较高,为2.21×10-3 mm2/s图2 女,33岁,纤维腺瘤,左乳肿块2个月 图2a T1WI示左乳肿块,形态规则,边缘清晰,病灶大部分呈稍低信号,边缘及其内分隔呈等信号 图2b T2WI示病灶大部分呈高信号,边缘及其内分隔呈低或等信号 图2c 增强扫描早期病灶呈不均匀强化,其内分隔强化较弱呈相对低信号 图2d 增强扫描晚期病灶大部分呈明显均匀强化,其内见相对低信号的分隔 图2e 病灶ADC值较高,为1.84×10-3 mm2/s
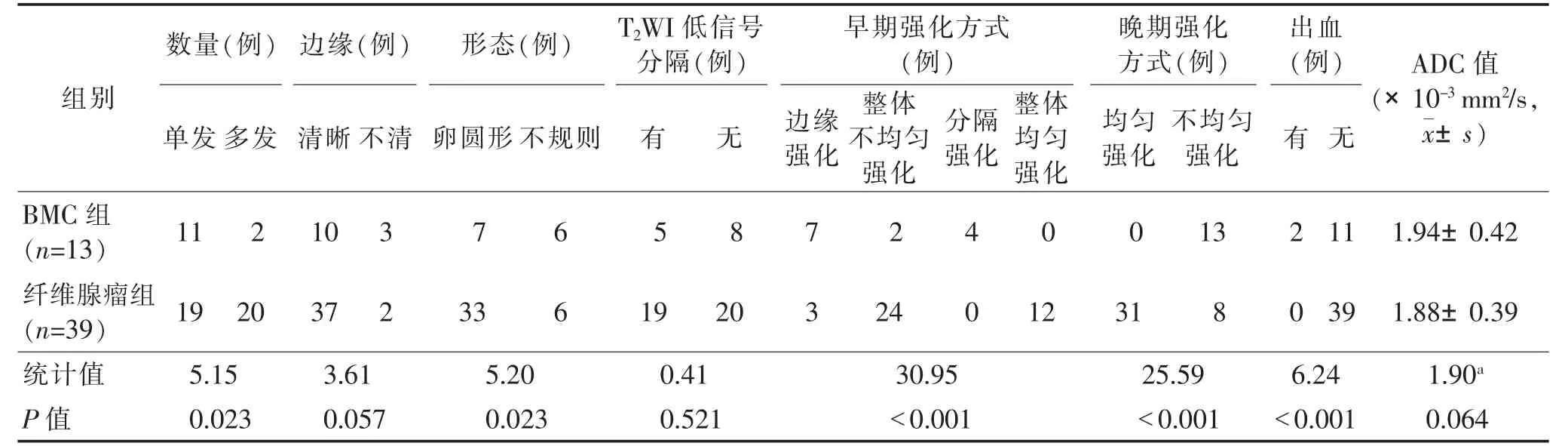
表1 2 组MRI 表现比较
2.2 2组TIC类型比较(表2)BMC患者TIC以Ⅰ型为主,纤维腺瘤以Ⅰ、Ⅱ型多见(82.1%),两者比较,差异有统计学意义(U=3.47,P<0.05)。

表2 2 组TIC 类型比较 例(%)
3 讨论
BMC由于癌细胞内及周围含有大量黏液,其脂肪抑制T2WI图像呈明显高信号,与浸润性乳腺癌存在较大差异,常被误诊为纤维腺瘤等良性病变[7]。乳腺X线、超声难以根据形态学特征对两者进行区分,且MRI平扫、DWI表现亦较一致,临床鉴别诊断困难,但两者的临床处理与预后完全不同。纤维腺瘤通常仅需随诊观察,必要时行手术治疗,而BMC一旦诊断则需手术切除,尤其是直径<3 cm、未侵及皮肤的BMC可采取积极的保乳手术联合前哨淋巴结活检[8-9]。因此,早期诊断对避免纤维腺瘤患者过度治疗,以及预后评估和生活质量的改善具有重要意义。
BMC多见于50岁以上绝经期女性,本研究BMC患者平均(57.1±6.3)岁,仅1例29岁,与曲宁等[10]报道一致。BMC是低度恶性肿瘤,多为单发,而纤维腺瘤的多发病灶更常见,这可能与遗传因素有关,且乳腺局部组织雌激素敏感性升高导致雌孕激素调节失衡也可诱发纤维腺瘤的发生发展[11]。MRI示BMC病灶边缘多较清晰,研究认为BMC边缘表现与肿瘤细胞含量有关,早期肿瘤细胞含量较低时边缘趋于光整[12],且卵圆形肿块与纤维腺瘤的形态学特征存在一定重叠,故仅依靠形态学难以全面准确对BMC和纤维腺瘤进行鉴别诊断。
BMC增强扫描早期多以厚薄不均的边缘强化为主,后强化逐渐向中央区推进,晚期呈不均匀强化,原因是病灶内肿瘤细胞、黏液的含量和空间分布不均衡,癌细胞密集分布区域血供增加,而血管多在肿瘤边缘聚集,导致了病变强化的不均匀性[13]。同时,BMC的TIC均为Ⅰ、Ⅱ型,故增强扫描晚期内部强化特征同样具有意义。反之,均匀强化是纤维腺瘤的主要内部强化特征,其肿瘤内部微血管密度分布均匀,少数早期厚薄均匀的边缘强化可反映内部低血管分布、纤维化、透明样改变等组织病理特征[14],纤维腺瘤TIC以Ⅰ、Ⅱ型多见,且以Ⅱ型居多。
T2WI上的低信号分隔以往被视为是纤维腺瘤诊断的典型征象,也是区分纤维腺瘤与边界清楚乳腺癌的有效表征。但近几年研究发现低信号分隔是由于病灶内部纤维组织过度增生所致的纤维间隔,该病理改变在也可见于BMC[15]。本研究中,BMC和纤维腺瘤T2WI均存在低信号分隔,动态增强扫描纤维腺瘤内分隔无明显强化或晚期轻度强化,而BMC表现为早期强化不明显或轻度强化,晚期呈中度或明显强化,与刘学文等[16]研究结果一致,这可能与黏液阻碍了BMC纤维间隔中大量毛细血管的早期强化有关。这一征象可作为两者重要的鉴别点。以往多数研究认为,由于BMC含有大量由癌细胞产生的黏液成分,基质较少,故ADC值常高于其他类型乳腺癌及乳腺良性肿瘤[17],但本研究未发现BMC与纤维腺瘤ADC值之间的显著差异;若合并出血时MRI信号将更复杂,且ADC值明显下降,呈低信号改变,主要原因是伴出血者多为肿瘤细胞过度聚集所致出现坏死出血、细胞间隙变小、分子运动受限[18]。
综上所述,BMC与纤维腺瘤在MRI表现方面存在一定相似之处,但以下征象可作为两者的主要鉴别点:BMC多为单发、患者年龄相对较大;早期呈边缘厚薄不均匀强化,晚期逐渐趋于整体不均匀强化;TIC以Ⅰ型为主;可合并出血。

