外源褪黑素对干旱胁迫下春大豆品种绥农26形态、光合生理及产量的影响
张明聪 何松榆 秦 彬 王孟雪 金喜军 任春元 吴耀坤 张玉先,*
外源褪黑素对干旱胁迫下春大豆品种绥农26形态、光合生理及产量的影响
张明聪1,**何松榆1,**秦 彬1王孟雪1金喜军1任春元1吴耀坤2张玉先1,*
1黑龙江八一农垦大学农学院, 黑龙江大庆 163319;2黑龙江省农业科学院大庆分院, 黑龙江大庆 163316
苗期干旱是影响东北大豆生长的主要因素之一, 研究外源褪黑素对大豆苗期抗旱的调控效应具有重要意义。试验于2018—2019年进行, 以‘绥农26’为材料, 正常浇灌营养液处理为对照(CK), 研究了干旱胁迫(D)、干旱胁迫+叶面喷施褪黑素(LM)和干旱胁迫+浇灌褪黑素(RM)处理对大豆苗期生理指标和产量的影响。结果表明, 与干旱胁迫(D)处理相比, 施用褪黑素处理(LM和RM)提高干旱胁迫下大豆气体交换参数、苗期各器官干物质积累量、叶片中抗氧化酶活性和可溶性蛋白含量。其中, V2期和V4期的净光合速率、气孔导度以及V4期蒸腾速率、胞间二氧化碳浓度均显著提高(<0.05); RM处理POD和CAT均显著增加(<0.05); V2期和V4期干旱后第8天可溶性蛋白含量增幅显著(<0.05)。与D处理相比, V2和V4期LM处理大豆产量年均增加24.2% (<0.05)和19.1%, RM处理年均增加38.6% (<0.05)和56.3% (<0.05), 其中, 与LM处理相比, RM处理产量年均增加11.6%和31.3% (<0.05)。表明, 应用褪黑素提高干旱胁迫下大豆产量, 其中浇灌褪黑素处理产量高于叶面喷施处理。
干旱胁迫; 褪黑素; 大豆; 生长发育; 产量
大豆苗期生长发育状况对大豆产量的丰欠起决定作用[1]。苗期短期干旱条件下, 大豆自身会应对干旱形成防御机制[2], 产生酶促和非酶促组成的抗氧化防御系统(抗氧化酶和抗氧化剂等)和渗透保护物质(可溶性糖和可溶性蛋白等)等缓解干旱引起的氧化损伤[3-4]; 而随着干旱时间延长, 细胞会积累大量的活性氧自由基(H2O2和O2–), 打破活性氧的代谢平衡系统, 加剧膜脂过氧化作用, 造成细胞内蛋白质和酶等生物大分子失活, 导致细胞膜的结构与功能损伤, 光合能力下降, 碳水化合物合成受阻, 影响作物苗期形态建成[5-7]。因此, 如何在干旱胁迫条件下维持较强的自由基清除能力、光合和同化物质供应能力对于提高大豆苗期抗旱性和稳定性具有重要意义。
褪黑素(melatonin, MT)是内源性的自由基清除剂和抗氧化剂[8], 能够有效清除过量的活性氧物质(reactive oxygen species, ROS)、刺激抗氧化酶活性进行抗氧化调节、增强抗氧化剂的抗氧化能力[9-10]、提高线粒体内部氧化磷酸化进行抗氧化调节, 防止细胞过度氧化, 有效缓解作物逆境胁迫的非生物胁迫损伤[11]。逆境胁迫条件下, 外源褪黑素具有抗氧化作用, 已在大豆[12]、玉米[13]、黄瓜[14]、苹果[15]、小麦[5]等作物中有相关报道。大量研究表明, 外源褪黑素主要通过提高植株抗氧化系统, 提高光系统的电子传递速率, 加强光能向光化学反应方向的分配[16], 缓解逆境胁迫对光合系统的损伤, 清除过量的自由基, 提高渗透调节物质含量[17], 降低丙二醛(malondialdehyde, MDA)含量来保持细胞膜的完整性[10], 缓解干旱胁迫对大豆苗期生长发育的损伤。前人关于褪黑素在大豆应对非生物胁迫的研究已有较多报道, 但研究主要集中在叶面喷施处理[3,12,17-18], 而针对干旱胁迫下褪黑素不同施用方式对大豆苗期生理指标影响的相关研究报道较少。因此, 本试验通过研究在苗期干旱胁迫条件下外源褪黑素对大豆幼苗生长、物质积累、光合特性、抗氧化系统和产量等指标的影响, 探讨外源褪黑素对大豆抗旱性的生理机制, 以期为褪黑素应用于缓解大豆苗期干旱提供理论依据。
1 材料与方法
1.1 试验材料
试验以大豆品种‘绥农26’为材料, 生育期120 d左右, 需≥10℃活动积温2400℃左右, 无限结荚习性, 由黑龙江省农业科学院提供。褪黑素(C13H16N2O2)购自美国Sigma公司, 相对分子质量为232.28, 分子式C13H16N2O2, 纯度为>99%。试验用于模拟干旱胁迫的聚乙二醇(PEG-6000)购于国药集团化学试剂有限公司。
1.2 试验设计
试验于2018年5月至2019年10月在黑龙江省大庆市高新区国家杂粮工程技术研究中心实验基地防雨大棚内进行。采用盆栽试验, 盆高36 cm、直径29 cm, 盆底钻5个直径0.5 cm小孔并垫上纱网, 以1∶1比例的蛭石和珍珠岩混拌作栽培基质, 2年均于5月18日播种, 播种前选取饱满、均匀一致的种子, 用5%次氯酸钠消毒, 每盆播9粒种子, 真叶期间苗, 每盆保留均匀一致的幼苗3株, 待籽粒成熟后收获。
大豆V2和V4期进行干旱胁迫处理, 分别设置4个处理。(1)正常浇灌营养液处理(CK): 全生育期每2 d浇1 L Hoagland营养液培养(盆底部有水渗出); (2) 干旱胁迫处理(D): 在CK基础上 + 15% PEG-6000 (w/v) (营养液渗透势为-0.37 MPa); (3) 干旱胁迫处理+叶喷褪黑素处理(LM): 在D基础上+叶面喷施100 μmol L-1褪黑素(喷施以雾状水汽在叶片表面形成水滴自然落下为止); (4) 干旱胁迫处理+浇灌褪黑素处理(RM): 在D基础上配置含100 μmol L-1褪黑素培养液进行浇灌。每个处理3次重复, 每个重复10盆。
其中, 干旱胁迫处理分别于大豆V2和V4期的第0、3、6天晚上9:00浇灌15% PEG-6000的CK营养液。于最后一次处理结束后第4、8天上午9:00进行取样和相关生理指标的测定, 取样后一部分直接用于形态指标的测定, 另一部分分别置于105℃烘箱和-80℃低温冰箱, 用于测定干物质积累量和相关酶活性。取样后剩余重复当天傍晚用流动清水冲洗残留的PEG直至与CK保持一致, 后期正常浇Hoagland营养液以保证其正常生长发育, 待成熟后收获测产。
1.3 测定项目和方法
参照Zhang等[19]的方法, 用直尺和LF3100C叶面积仪分别测定株高和叶面积; 参照秦斌等[20]的方法测定根系形态指标; LI-6400光合仪(Li-Cor, Hunting)测定叶片气体交换参数[净光合速率(n)、蒸腾速率(r)、气孔导度(s)和胞间CO2浓度(i)]; 参照施海涛[21]的方法, 利用烘干称重法测定干物质积累量, 利用氮蓝四唑(nitro-blue tetrazolium, NBT)法测定超氧化物歧化酶(superoxide dismutase, SOD)活性, 利用愈创木酚法测定过氧化物酶(peroxidase, POD)活性, 利用比色法测定过氧化氢酶(catalase, CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性, 利用硫代巴比妥酸法测定丙二醛(malondialdehyde, MDA)含量, 利用考马斯亮蓝G-250染色法测定可溶性蛋白含量(soluble protein); 参照Chaitanya等[22]的方法测定O2–含量; 参照Mukherjee[23]的方法测定H2O2含量。
1.4 测定项目和方法
用Microsoft Excel 2019处理数据, SPSS 25.0软件做单因素方差分析(ANOVA), 通过LSD检验(<0.05)分析处理间的差异显著性, 用Origin 2018软件作图。
2 结果与分析
2.1 大豆苗期形态指标变化
相同生育期, 在干旱胁迫条件下株高和叶面积均呈显著降低趋势(表1)。与干旱胁迫(D)处理相比, 褪黑素处理(LM和RM)株高和叶面积均有所增加, 其中, 2018年, LM和RM处理V2期干旱后第4天的株高分别增加7.80%和9.41% (<0.05)、第8天分别增加5.92%和7.81% (<0.05); 2018—2019年, LM和RM处理V2期干旱后第4天的叶面积增幅分别为22.2%~24.7% (<0.05)和28.1%~30.0% (<0.05)、第8天的叶面积增幅分别为17.7%~19.8%和25.0%~31.2%; 2019年, LM和RM处理V4期干旱后第4天的叶面积分别增加26.8%和28.7% (<0.05)。
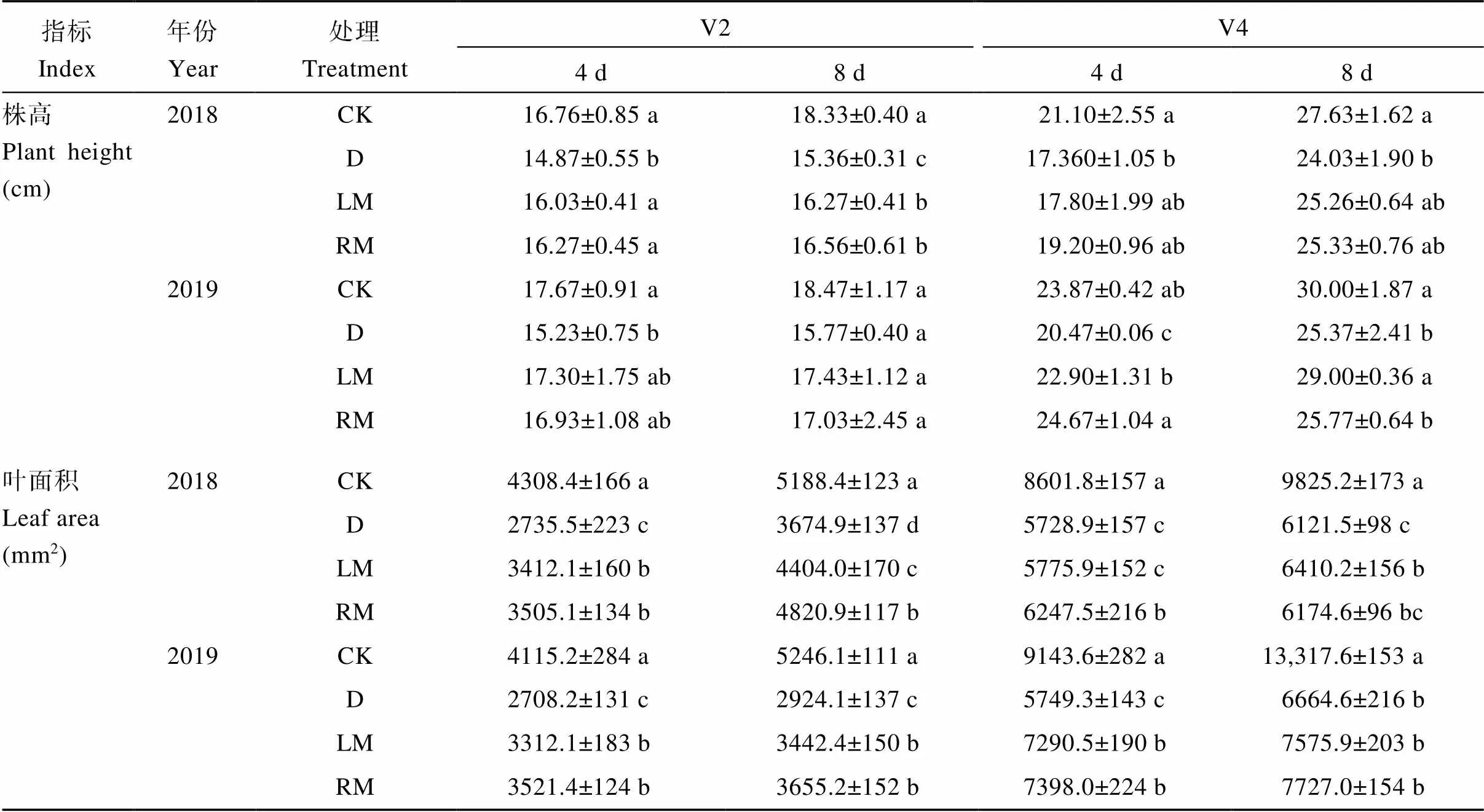
表1 外源褪黑素对干旱胁迫下大豆株高和叶面积的影响
CK: 正常浇灌营养液处理; D: 干旱胁迫处理+15% PEG-6000 (w/v); LM: 干旱胁迫处理+叶喷100 μmol L-1褪黑素处理; RM: 干旱胁迫处理+浇灌100 μmol L-1褪黑素处理。V2: 第二节龄期; V4: 第四节龄期。同列数值后不同小写字母表示处理间在0.05水平差异显著。
CK: the well-watered treatment; D: the drought stress treatment + 15% PEG-6000 (w/v); LM: the drought stress treatment + 100 μmol L-1melatonin by leaf; RM: the drought stress treatment + 100 μmol L-1melatonin by root irrigation. V2: the second trifoliolate; V4: the fourth trifoliolate. Value followed by different lowercase letters in same column indicates significant difference among different treatments at the 0.05 probability level.
与CK相比, D处理根系形态指标均显著降低, 而外源添加褪黑素处理(LM和RM)减缓了根系形态指标的下降趋势(表2)。与D处理相比, 褪黑素处理根长、根体积和根表面积均有所增加, 其中, 2018年, RM处理V2期干旱后第8天的根长增加4.26% (<0.05), V4期干旱后第4、8天的根体积分别增加5.46%和7.45% (<0.05); 2018—2019年, RM处理V2期干旱后第4天的根表面积分别增加13.0%和20.9% (<0.05), V4期干旱后第4天的根表面积分别增加8.86%和7.95% (<0.05)。
2.2 大豆苗期干物质积累的变化
2年试验结果表明, 干旱胁迫降低了大豆苗期各器官干物质积累量(表3); 与D处理相比, 干旱胁迫条件下褪黑素处理各器官干重均有增加, 其中, 2018—2019年, LM和RM处理V2期干旱后第4天叶干重增幅分别为22.2%~29.8% (<0.05)和27.2%~53.2% (<0.05)、根干重增幅分别为5.6%~26.6%和8.0%~35.9%、总干重增幅分别为9.47%~30.20%和13.0%~50.3% (<0.05), 第8天根干重增幅分别为10.5%~21.4% (<0.05)和11.2%~ 23.3% (<0.05)、总干重增幅分别为13.4%~16.6% (<0.05)和15.3%~20.1% (<0.05); RM处理V4期干旱后第4天叶干重和总干重增幅分别为7.54%~ 38.1% (<0.05)和35.4%~29.4%、第8天根干重增幅为33.1%~31.9% (<0.05)。

表2 外源褪黑素对干旱胁迫下大豆根系形态指标的影响
V2: 第二节龄期; V4: 第四节龄期。同列数值后不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. Values followed by different lowercase letters in same column indicate significant differences among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
2.3 大豆苗期气体交换参数的变化
V2期(图1)和V4期(图2)干旱胁迫条件下大豆叶片的气体交换参数均呈降低趋势。与D处理相比, 外源褪黑素处理气体交换参数均有所提高(图1), 其中, V2期, 褪黑素(LM和RM)处理叶片的净光合速率(n)分别提高78.5%和79.4% (<0.05)、气孔导度(s)分别提高44.3%和45.1% (<0.05); 蒸腾速率(r)和胞间二氧化碳浓度(i)分别提高20.3%和28.9%、9.49%和10.9%, 差异不显著。
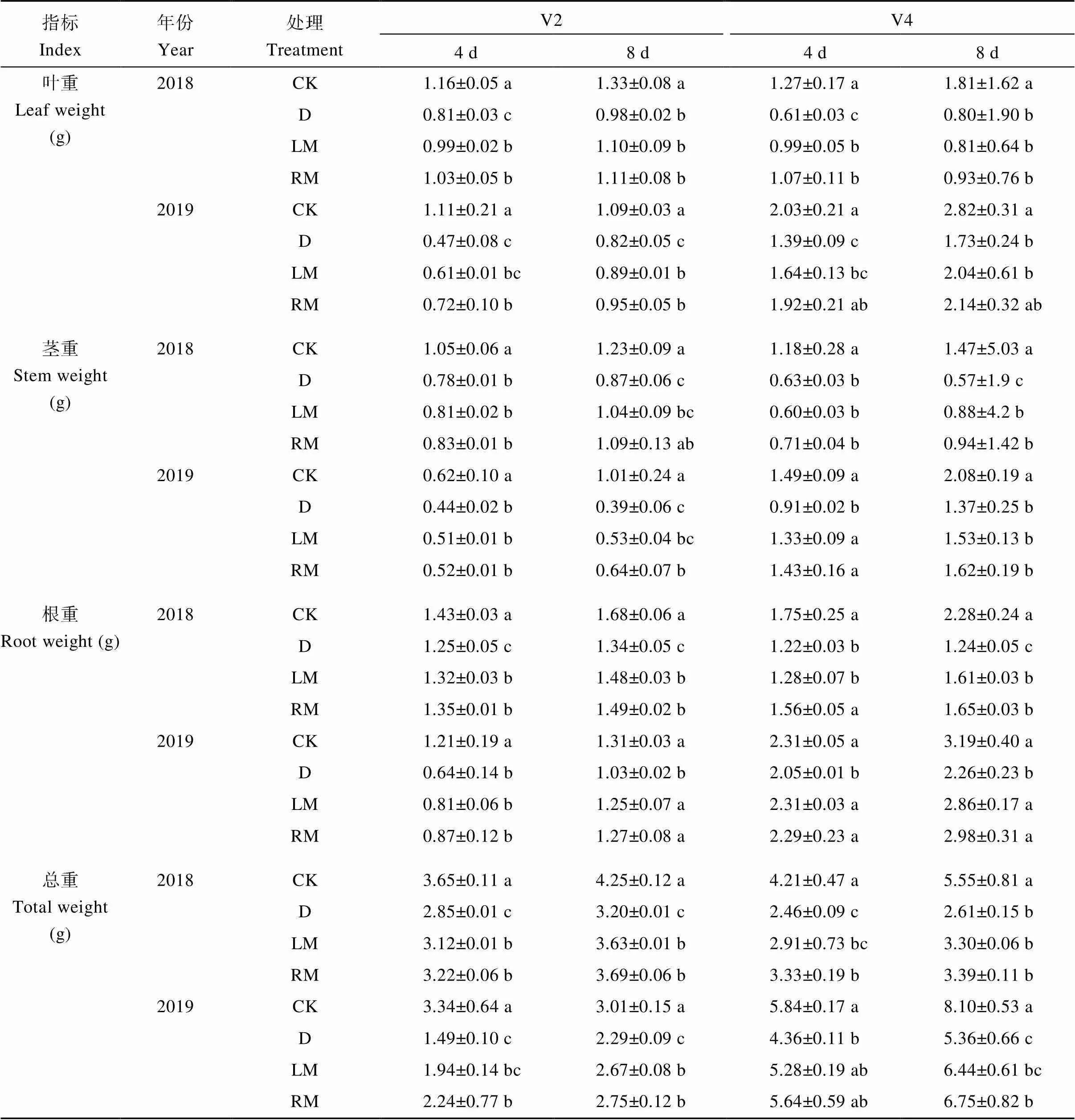
表3 外源褪黑素对干旱胁迫下大豆苗期干物质积累的影响
V2: 第二节龄期; V4: 第四节龄期。同列数值后不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. Values followed by different lowercase letters in same column indicate significant differences among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
V4期, 与D处理相比, 褪黑素处理叶片的n、r、s和i均有所提高(图2), 其中, LM和RM处理n、r、s和i分别提高26.9%和18.7%、8.71%和15.7%、31.1%和57.4%、8.47%和5.36%, 均达到5%的显著水平。表明LM处理对n和i的缓解效果较好, 而RM处理对r和s的缓解效果较明显。
2.4 大豆苗期叶片抗氧化酶活性的变化
2年试验结果表明, 干旱胁迫条件下叶片的SOD活性增加(图3)。与D处理相比, 褪黑素处理SOD活性均有所增加, 其中, 2019年, LM处理V2期干旱后第8天增加29.5% (<0.05), V4期干旱后第4天增加27.3% (<0.05); RM处理V2期干旱后第4、8天分别增加9.28%和43.0% (<0.05), V4期干旱后第4天增加36.1% (<0.05)。
与CK相比, 干旱胁迫条件下大豆叶片的POD活性均显著增加(图4)。2年试验结果表明, 与D处理相比, 褪黑素处理叶片POD活性均有所增加, 其中, 2018年LM和RM处理在V2期干旱后第4天分别增加8.73%和30.3% (<0.05)、第8天分别增加9.86%和8.86% (<0.05), V4期干旱后第4天分别增加23.9%和22.0% (<0.05)、第8天分别增加11.9%和11.1% (<0.05); 2019年与2018年趋势基本相同。
与CK相比, 干旱胁迫条件下大豆体内CAT活性增加(图5)。与D处理相比, 大豆叶片的CAT活性均有所增加, 其中, 2018年, LM和RM处理V2期干旱后第4天分别增加18.1%和10.5% (<0.05)、第8天分别增加12.1%和16.2% (<0.05), V4期干旱第8天分别增加23.1%和19.3% (<0.05)。
随干旱时间的延长, 大豆叶片的APX活性有增加的趋势(图6)。2年试验结果表明, 与D处理相比, 褪黑素处理叶片的APX活性均有所增加, 其中, 2018年, LM和RM处理V2期干旱后第4天分别增加6.89%和20.7% (<0.05)、第8天分别增加11.8%和14.8% (<0.05), V4期干旱后第4天分别增加10.5%和24.2% (<0.05); 2019年, RM处理V2期干旱后第4天显著高于D处理, 其他干旱时间APX活性均有所增加, 但未达差异显著水平。
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
2.5 大豆苗期叶片超氧阴离子和过氧化氢含量的变化
与CK相比, D处理显著提高了叶片中ROS(H2O2和O2܋)含量(图7和图8)。由图7可知, 2年试验结果表明, 与D处理相比, 褪黑素处理大豆叶片O2܋含量均呈下降趋势, 其中, 2018—2019年, LM和RM处理V2期干旱后第4天分别降低14.3%~16.5% (<0.05)和17.9%~26.4% (<0.05)、第8天分别降低20.3%~33.4% (<0.05)和21.4%~32.9% (<0.05); RM处理V4期干旱后第4天分别降低20.8%~51.2% (<0.05)、第8天分别降低19.2%~ 21.4% (<0.05)。表明, 褪黑素在V2期干旱后第8天对大豆叶片的O2܋的清除效果较好, V4期干旱后第4天的清除效果较好, 其中, 2019年V2和V4期第8天均以浇灌(RM)处理的作用效果最显著。
干旱胁迫条件下, 大豆叶片过氧化氢与超氧阴离子含量变化趋势基本相同, 呈增加趋势(图8); 与D处理相比, 干旱胁迫条件下褪黑素处理大豆叶片的H2O2含量呈下降趋势, 其中, 2018—2019年, LM和RM处理V2期干旱后第4天分别降低17.9%~38.2%和19.2%~58.4%, 第8天分别降低35.6%~37.5% (<0.05)和31.9%~44.1% (<0.05); V4期干旱后第4天分别降低20.3%~27.9%和32.9%~34.7% (<0.05)、第8天分别降低23.2%~35.5%和30.5%~32.6% (<0.05)。表明干旱胁迫下褪黑素可以降低叶片中ROS (H2O2和O2–)含量, 缓解叶片中ROS对植物细胞的损伤, 维持植株叶片组织活性氧的平衡。
2.6 大豆叶片丙二醛含量的变化
与D处理相比, 外源褪黑素处理大豆叶片的MDA含量均呈下降趋势(图9), 其中, 2018—2019年, LM和RM处理V4期干旱后第8天分别降低20.6%~27.6% (<0.05)和28.0%~29.2% (<0.05); 2018年, LM和RM处理V2期干旱后第4天分别降低8.79%和11.90%、第8天分别降低7.86%和10.10% (<0.05), V4期干旱后第4天分别降低19.2%和21.7% (<0.05)。
2.7 大豆叶片可溶性蛋白含量的变化
2年试验结果表明(图10), 与D处理相比, 2018年, LM和RM处理V2期干旱后第8天可溶性蛋白含量分别增加20.5%和25.3%、V4期干旱后第8天分别增加17.6%和16.7% (<0.05); 2019年, 褪黑素处理(LM和RM) V2期干旱后第8天分别增加7.48%和5.32%, V4期干旱第8天分别增加2.19%和1.88%, 差异不显著。
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
V2: 第二节龄期; V4: 第四节龄期。柱上标以不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. The bar with different lowercase letters indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
2.8 大豆产量及其构成因素的变化
与D处理相比, 褪黑素处理单株节数、荚数、粒数和百粒重均有所增加(表4), 其中, 2018年, RM处理V4期干旱大豆的节数、单株荚数、单株粒数分别增加7.24%、59.1%和61.7% (<0.05); 2019年, RM处理V2期大豆的单株荚数、粒数分别增加35.9%和31.1% (<0.05)、V4期分别增加33.6%和31.6% (<0.05); 2018—2019年, LM和RM处理V2期干旱单株产量增幅分别为20.7%~27.8%和32.0%~45.5% (<0.05), V4期增幅分别为3.89%~33.80%和35.9%~76.2% (<0.05)。表明, 干旱胁迫降低了大豆植株节数、单株荚数、单株粒数。
3 讨论
苗期干旱影响大豆生长发育[24-25]。随着干旱胁迫时间的延长, 大豆生长受到抑制。褪黑素作为一种广谱生理调节剂, 在干旱胁迫下, 能有效缓解植物损伤[26], 延迟苹果叶片的衰老[27], 增强大豆鼓粒期的耐旱性, 促进植物生长[28]。本研究中, 叶面喷施和浇灌褪黑素均不同程度缓解了干旱胁迫对大豆苗期生长发育状况的影响, 使株高、叶面积和生物量下降幅度减缓, 促进根系生长, 增加根体积及根表面积, 有利于水分的吸收。推测其原因可能是褪黑素具有和生长素相同的前体物质及相似的生理功能, 会诱导生长素的合成来促进植物体内生理代谢活性[28], 促进根系对水分和养分的吸收利用, 抵御干旱胁迫对植株造成的损伤, 进而增加其抗旱能力。光合作用是植物生长发育和产量形成的重要代谢过程, 是植物生长发育的物质和能量的主要来源[29]。干旱通过关闭气孔减少水分蒸腾, 阻滞胞外CO2进入, 降低叶片对光能的吸收和转化效率[30], 过剩的光能超出光合器官的利用范围, 会使光合器官受到损伤, 最终导致植物生长受到限制[31]。本试验结果表明, 干旱胁迫条件下, 通过降低叶片的气孔导度(s)以降低叶片的蒸腾速率(r)和胞间二氧化碳浓度(i), 气孔开合度降低导致光合作用的原料CO2不足而降低净光速率(n)。而应用褪黑素提高了干旱胁迫下大豆叶片光合作用, 减缓光合气体交换参数和叶面积的降低。一方面, 干旱胁迫下, 应用褪黑素可以显著提高叶片s和i, 显著降低CO2从细胞间隙向叶绿体传递阻力, 提高碳同化过程CO2的吸收速率[32], 缓解因干旱引起气孔关闭导致的光合原料不足的问题, 表明应用外源褪黑素可修复因干旱胁迫导致的光合系统损伤, 提高叶片的n, 增强大豆对干旱的耐受性; 另一方面, 干旱条件下, 外源褪黑素提高了叶片对光能的吸收和转化效率, 降低了过多的光能对光合器官的损伤程度[33], 提高了各器官干物质积累量及向籽粒中的分配, 最终促进大豆生长发育和产量提高。
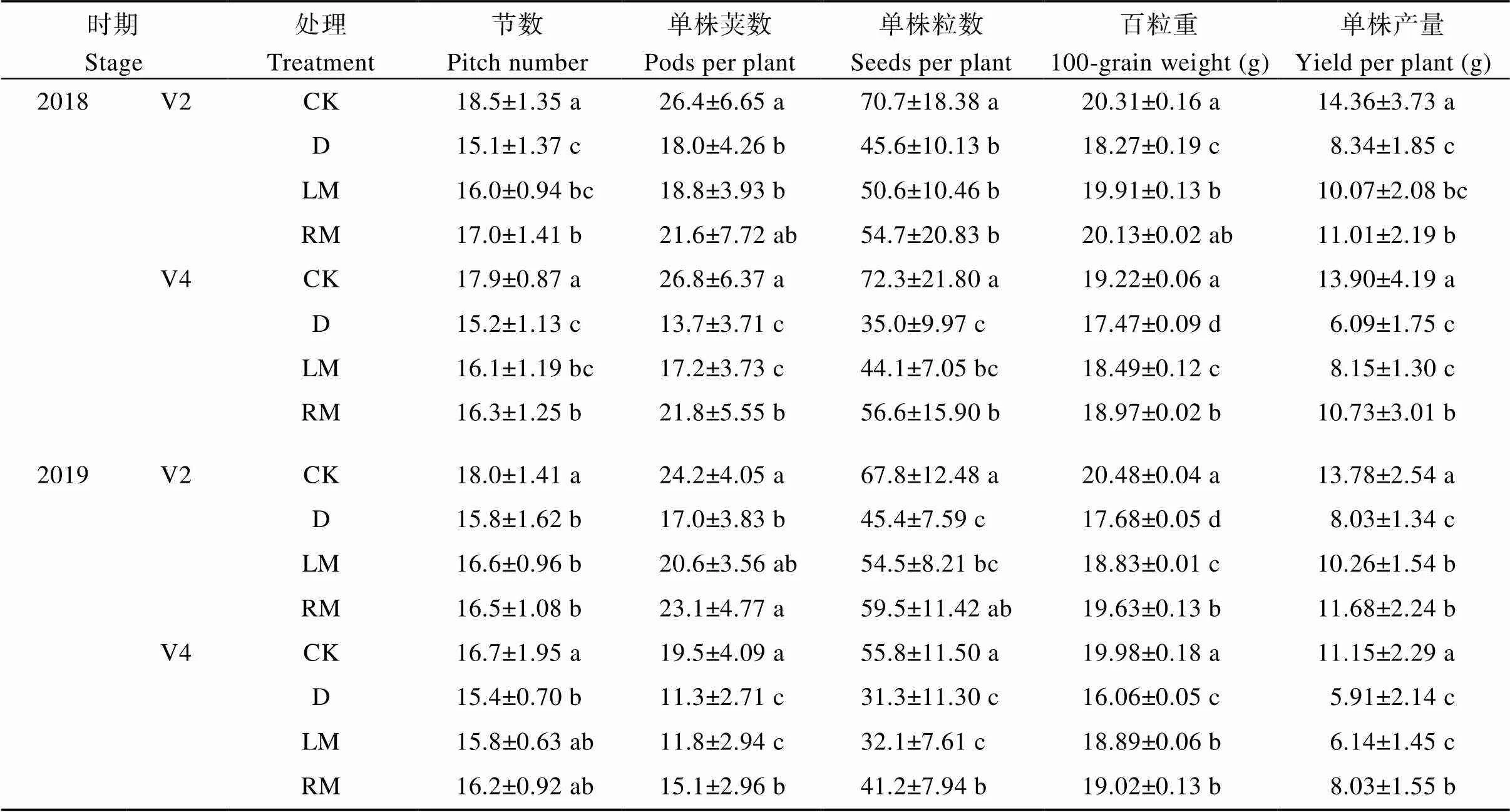
表4 外源褪黑素对干旱胁迫下大豆产量及其构成因素的影响
V2: 第二节龄期; V4: 第四节龄期。同列数值后不同小写字母表示处理间在0.05水平差异显著。处理同表1。
V2: the second trifoliolate; V4: the fourth trifoliolate. Value with different lowercase letters in same column indicates significant difference among different treatments at the 0.05 probability level. Treatments are the same as those given in Table 1.
干旱胁迫引起植物对光能捕获与利用的失调, 在PSI中NADPH氧化酶与O2反应产生过量O2–, 在PSII中形成H2O2[34], 导致大量积累的光量子与氧分子结合, 加剧了ROS和膜脂过氧化产物丙二醛(MDA)产生[35], 被认为是植物损伤过程中膜脂过氧化程度的标志。随着干旱时间的延长ROS和MDA呈增加的趋势[36], 本研究中, V2和V4期干旱后的第4天至第8天O2–、H2O2和MDA含量增加, 说明干旱胁迫下膜脂过氧化程度加剧, 细胞生物膜受损, 而褪黑素处理降低了干旱胁迫下ROS (H2O2、O2–)和MDA的过量积累, 说明褪黑素处理维持细胞渗透平衡, 通过与自由基的级联互作[37], 减轻干旱胁迫下膜质过氧化物对细胞膜的伤害, 主要原因与褪黑素可以提高作物抗氧化系统, 抑制膜质过氧化的反应有关[38], 利于保护膜的完整性, 缓解植株损伤程度, 增强大豆苗期的抗旱性, 这与刘仕翔等[39]在水稻上的研究结果较为相似。另有研究表明, 在干旱胁迫下, 黄瓜[40]和大豆[12,17-18]幼苗应用褪黑素可提高叶片的抗氧化酶活性、抗氧化剂和渗透调节物质含量。本试验中同样发现干旱条件下应用褪黑素后, 可诱导提高抗氧化酶活性和非酶类抗氧化剂含量, 从而减少活性氧的积累, 缓解植株损伤程度。逆境胁迫时植株体内抗氧化防御系统随之启动, SOD可将过量的O2–歧化反应生成为H2O2和O2, POD参与H2O2的清除, CAT通过酶的血红素铁与H2O2反应生成铁过氧化物活性体, 降低植株体内的ROS[41]。本试验中, 褪黑素处理对抗氧化酶(SOD、POD、CAT)活性显著提高, 说明褪黑素可能会通过激发自身抗氧化系统相关的调控基因, 清除由干旱胁迫积累过多的H2O2和O2–, 提高可溶性蛋白等渗透调节物质含量, 平衡细胞内外渗透电位, 缓解细胞生物膜的损伤, 降低MDA含量, 其中浇灌褪黑素处理略好于叶面喷施处理。
大量研究已证实, 采用不同的施用方式应用外源激素如浸种[42]、叶面喷施[43]和浇灌[44]均可以不同程度的缓解或减轻逆境对作物造成的损伤, 具有用量小、见效快、效果显著等特点。本研究表明, 将100 µmol L-1褪黑素采用浇灌方式能较好的缓解干旱胁迫对大豆幼苗造成的损伤, 减缓对百粒重的抑制效果, 降低大豆落花落荚率, 增加荚果数量, 或许与叶片光合作用的同化产物运输有关, 可能会加速向籽粒运转, 促进籽粒发育进而提高大豆产量。基于本试验2年的生理研究结果表明, 利用褪黑素缓解干旱抑制的效果来提高作物抗逆性是一种重要的农业调节措施, 而褪黑素处理的作用机理和模式仍需要进行广泛而深入的研究。
4 结论
大豆苗期干旱胁迫下, 应用褪黑素可以提高叶片抗氧化酶活性和渗透调节物质的含量, 清除了过量的活性氧, 降低了MDA含量, 增加叶面积, 改善光合特性, 加速光合产物向各器官积累, 通过提高大豆单株荚数和单株粒数, 进而提高大豆产量, 缓解大豆苗期的干旱胁迫。其中, 浇灌褪黑素(RM)处理产量高于叶面喷施褪黑素(LM)处理。
[1] 李秀芬, 马树庆, 李云峰, 于海, 徐丽萍, 陈凤涛, 张洪伟, 翟墨. 水分胁迫对春大豆出苗和幼苗长势的影响. 生态学杂志, 2020, 39: 2602–2609.
Li X F, Ma S Q, Li Y F, Yu H, Xu L P, Chen F T, Zhang H W, Zhai M. Effects of soil water stress on emergence and seeding growth of spring soybean., 2020, 39: 2602–2609 (in Chinese with English abstract).
[2] 李琬. 干旱对大豆根系生育的影响及灌溉缓解效应研究进展. 草业学报, 2019, 28(4): 192–202.
Li W. Research progress in understanding the effect of drought on growth of the soybean root system and the efficiency of irrigation., 2019, 28(4): 192–202 (in Chinese with English abstract).
[3] 邹京南, 于奇, 金喜军, 王明瑶, 秦彬, 任春元, 王孟雪, 张玉先. 外源褪黑素对干旱胁迫下大豆鼓粒期生理和产量的影响. 作物学报, 2020, 46: 745–758.
Zou J N, Yu Q, Jin X J, Wang M Y, Qin B, Ren C Y, Wang M X, Zhang Y X. Effects of exogenous melatonin on physiology and yield of soybean during seed filling stage under drought stress., 2020, 46: 745–758 (in Chinese with English abstract).
[4] 莫金钢, 马建, 沈勇, 张丽辉, 曲静, 王丕武. 干旱胁迫下大豆抗旱突变体M18苗期生长和生理特性. 中国油料作物学报, 2014, 36: 770–776.
Mo J G, Ma J, Shen Y, Zhang L H, Qu J, Wang P W. Growth and physiological characteristics of seedlings of soybean drought-resistant mutant M18 under drought stress., 2014, 36: 770–776 (in Chinese with English abstract).
[5] 叶君, 邓西平, 王仕稳, 殷俐娜, 陈道钳, 熊炳霖, 王鑫月. 干旱胁迫下褪黑素对小麦幼苗生长、光合和抗氧化特性的影响. 麦类作物学报, 2015, 35: 1275–1283.
Ye J, Deng X P, Wang S W, Yin L N, Chen D Q, Xiong B L, Wang X Y. Effects of melatonin on growth, photosynthetic characteristics and antioxidant system in seedling of wheat under drought stress., 2015, 35: 1275–1283 (in Chinese with English abstract).
[6] Li B Y, Feng Y N, Zong Y Z, Zhang D S, Hao X Y, Li P. Elevated CO2-induced changes in photosynthesis, antioxidant enzymes and signal transduction enzyme of soybean under drought stress., 2020, 154: 105–114.
[7] Chastain D R, Snider J L, Collins G D, Perry C D, Whitaker J, Byrd S A. Water deficit in field-grownprimarily limits net photosynthesis by decreasing stomatal conductance, increasing photorespiration, and increasing the ratio of dark respiration to gross photosynthesis., 2014, 171: 1576–1585.
[8] Reiter R J, Tan D X, Terron M P. Melatonin and its metabolites: new findings regarding their production and their radical scavenging actions., 2007, 54: 1–9.
[9] Zhang M C, He S Y, Zhan Y C, Qin B, Jin X J, Wang M X, Zhang Y X, Hu G H. Exogenous melatonin reduces the inhibitory effect of osmotic stress on photosynthesis in soybean., 2019, 14: e0226542.
[10] 巩彪, 史庆华. 园艺作物褪黑素的研究进展. 中国农业科学, 2017, 50: 2326–2337.
Gong B, Shi Q H. Review of melatonin in horticultural crops., 2017, 50: 2326–2337 (in Chinese with English abstract).
[11] 蒲玉瑾, 张一璇, 苗灵凤, 杨帆. 常温和低温条件下不同浓度褪黑素对降香黄檀幼苗的生理生态影响. 广西植物[2020-08- 30].http://kns.cnki.net/kcms/detail/45.1134.Q.20200807.1108.006. html.
Pu Y J, Zhang Y X, Miao L F, Yang F. Effects of exogenous melatonin on the eco-physiological characteristics of Dalbergia odorifera seedlings under ambient and low temperatures., [2020-08-30]. http://kns.cnki.net/kcms/detail/45.1134.Q.20200 807.1108.006.html (in Chinese with English abstract).
[12] Zou J N, Jin X J, Zhang Y X, Ren C Y, Zhang M C, Wang M X. Effects of melatonin on photosynthesis and soybean seed growth during grain filling under drought stress., 2019, 57: 512–520.
[13] Ye J, Wang S W, Deng X W, Yin L, Xiong B L, Wang X Y. Melatonin increased maize (L.) seedling drought tolerance by alleviating drought-induced photosynthetic inhibition and oxidative damage., 2016, 38: 38–48.
[14] Zhang N, Zhao B, Zhang H J, Weeda S, Yang C, Yang Z C, Ren S X, Guo Y D. Melatonin promotes water-stress tolerance, lateral root formation, and seed germination in cucumber (L.)., 2013, 54: 15–23.
[15] Wang P, Sun X, Li C, Wei Z W, Liang D, Ma F W. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple., 2013, 54: 292–302.
[16] 刘领, 李冬, 马宜林, 王丽君, 赵世民, 周俊学, 申洪涛, 王艳芳. 外源褪黑素对干旱胁迫下烤烟幼苗生长的缓解效应与生理机制研究. 草业学报, 2019, 28(8): 95–105.
Liu L, Li D, Ma Y L, Wang L J, Zhao S M, Zhou J X, Shen H T, Wang Y F. Alleviation of drought stress and the physiological mechanisms in tobacco seedings treated with exogenous melatonin., 2019, 28(8): 95–105 (in Chinese with English abstract).
[17] Cao L, Jin X J, Zhang Y X. Melatonin confers drought stress tolerance in soybean (L.) by modulating photosynthesis, osmolytes, and reactive oxygen metabolism., 2019, 57: 812–819.
[18] Gao H, Zhang Z K, Chai H K, Hong K, Cheng N, Yang Y, Wang D N, Yang T, Cao W. Melatonin treatment delays postharvest senescence and regulates reactive oxygen species metabolism in peach fruit., 2016, 118: 103–110.
[19] Zhang M C, Sun W X, Liu Y Y, Luo S G, Zhang J, Wu Q, Wu Z Y, Jiang Y. Timing of N application affects net primary production of soybean with different densities., 2014, 13: 60345–60347.
[20] 秦彬, 张明聪, 何松榆, 张春宇, 王明瑶, 金喜军, 王孟雪, 张玉先, 胡国华. 褪黑素浸种对大豆种子萌发过程中干旱胁迫的缓解效应. 干旱地区农业研究, 2020, 38(3): 192–198.
Qin B, Zhang M C, He S Y, Zhang C Y, Wang M Y, Jin X J, Wang M X, Zhang Y X, Hu G H. Alleviating effect of melatonin soaking on drought stress during soybean seed germination., 2020, 38(3): 192–198 (in Chinese with English abstract).
[21] 施海涛. 植物逆境生理学实验指导. 北京: 科学出版社, 2016. pp 57–74.
Shi H T. Plant Adversity Physiology Experiment Guide. Beijing: Science Press, 2016. pp 57–74 (in Chinese).
[22] Chaitanya K K, Naithani S C. Role of superoxide, lipid peroxidation and superoxide dismutase in membrane perturbation during loss of viability in seeds ofGaertn. F., 1994, 126: 623–627.
[23] Mukherjee S P, Choudhuri M A. Implications of water stress-induced changes in the levels of endogenous ascorbic acid and hydrogen peroxide in Vigna seedlings., 1983, 58: 166–170.
[24] 刘文夫, 董守坤, 徐亚会, 李雪凝, 刘丽君. 大豆苗期干旱胁迫对糖分吸收与相关酶活性的影响. 作物杂志, 2014, (3): 117–120.
Liu W F, Dong S K, Xu Y H, Li X N, Liu L J. Effects of drought stress on sugar absorption and elated enzyme activities at soybean seedling., 2014, (3): 117–120 (in Chinese with English abstract).
[25] 魏鑫, 倪虹, 张会慧, 王晶英. 外源脱落酸和油菜素内酯对干旱胁迫下大豆幼苗抗旱性的影响. 中国油料作物学报, 2016, 38: 605–610.
Wei X, Ni H, Zhang H H, Wang J Y. Effects of exogenous abscisic acid and brassinolide on drought resistance of soybean seedlings., 2016, 38: 605–610 (in Chinese with English abstract).
[26] Tilden A R, Becker M A, Amma L L, Arciniega J, Mcgaw A K. Melatonin production in an aerobic photosynthetic bacterium: an evolutionarily early association with darkness., 1997, 22: 102–106.
[27] Wang P, Sun X, Li C, Wei Z W, Liang D, Ma F W. Long-term exogenous application of melatonin delays drought-induced leaf senescence in apple., 2013, 54: 292–302.
[28] Wei W, Li Q T, Chu Y N, Russel J R, Yu X M, Zhu D H, Zhang W K, Ma B, Lin Q, Zhang J S, Chen S Y. Melatonin enhances plant growth and abiotic stress tolerance in soybean plants., 2015, 66: 695–707.
[29] Nazar R, Umar S, Khan N A, Sareer O. Salicylic acid supplementation improves photosynthesis and growth in mustard through changes in proline accumulation and ethylene formation under drought stress., 2015, 98: 84–94.
[30] Kobra M, Yahya E, Mohammad P. Effect of silicon on photosynthetic gas exchange, photosynthetic pigments, cell membrane stability and relative water content of different wheat cultivars under drought stress conditions., 2016, 39: 1001–1015.
[31] 李耕, 高辉远, 赵斌, 董树亭, 张吉旺, 杨吉顺, 王敬锋, 刘鹏. 灌浆期干旱胁迫对玉米叶片光系统活性的影响. 作物学报, 2009, 35: 1916–1922.
Li G, Gao H Y, Zhao B, Dong S T, Zhang J W, Yang J S, Wang J F, Liu P. Effects of drought stress on activity of photosystems in leaves of maize at grain filling stage., 2009, 35: 1916–1922 (in Chinese with English abstract).
[32] 耿庆伟. 臭氧胁迫叠加温光逆境对葡萄叶片光合性能的影响. 山东农业大学硕士学位论文, 山东泰安, 2017.
Geng Q W. Effect of High Ozone Plus Temperature and Light Stress on Photosynthetic Characteristics of Grape Leaves. MS Thesis of Shandong Agricultural University, Tai’an, Shandong, China, 2017 (in Chinese with English abstract).
[33] 杨新元. 外源褪黑素对干旱胁迫下向日葵幼苗生长、光合及抗氧化系统的影响. 华北农学报, 2019, 34(4): 113–121.
Yang X Y. Effects of exogenous melatonin on growth, photosynthesis and antioxidant system of sunflower seedling under drought stress., 2019, 34(4): 113–121 (in Chinese with English abstract).
[34] Li C, Tan D X, Liang D, Chang C, Jia D F, Ma F W. Melatonin mediates the regulation of ABA metabolism, free-radical scavenging, and stomatal behaviour in two Malus species under drought stress., 2015, 66: 669–680.
[35] 李冬, 王艳芳, 申洪涛, 马宜林, 王丽君, 赵世民, 刘领. 外源MT和EBR对干旱胁迫下烤烟幼苗的缓解效应. 中国烟草学报, 2019, 25(5): 77–85.
Li D, Wang Y F, Shen H T, Ma Y L, Wang L J, Zhao S M, Liu L. Alleviation effects of exogenous melatonin and 2,4-epibrassinolide on flue-cured tobacco seedlings under drought stress., 2019, 25(5): 77–85 (in Chinese with English abstract).
[36] 万林, 李张开, 李素, 刘丽欣, 马霓, 张春雷. 外源独脚金内酯对油菜苗期干旱胁迫的缓解效应. 中国油料作物学报, 2020, 42: 461–471.
Wan L, Li Z K, Li S, Liu L X, Ma N, Zhang C L. Alleviation effects of exogenous strigolactone on growth ofL. seedling under drought stress., 2020, 42: 461–471 (in Chinese with English abstract).
[37] Tan D X, Manchester L C, Esteban-zubero E, Zhou Z, Reiter R J. Melatonin as a potent and inducible endogenous antioxidant: synthesis and metabolism., 2015, 20: 18886–18906.
[38] 厉恩茂, 李敏, 安秀红, 陈艳辉, 李燕青, 李壮, 程存刚. 叶面喷施褪黑素对干旱胁迫下苹果抗旱生理生化指标的影响. 中国南方果树, 2019, 48(4): 95–98.
Li E M, Li M, An X H, Chen Y H, Li Y Q, Li Z, Cheng C G. Effects of melatonin on physiological and biochemical indexes of apple under drought stress., 2019, 48 (4): 95–98 (in Chinese with English abstract).
[39] 刘仕翔, 黄益宗, 罗泽娇, 黄永春, 保琼莉, 王培培, 袁彪, 李文华. 外源褪黑素处理对镉胁迫下水稻种子萌发的影响. 农业环境科学学报, 2016, 35: 1034–1041.
Liu S X, Huang Y Z, Luo Z J, Huang Y C, Bao Q L, Wang P P, Yuan B, Li W H. Effects of exogenous melatonin on germination of rice seeds under Cd stresses., 2016, 35: 1034–1041 (in Chinese with English abstract).
[40] 张娜. 褪黑素处理对渗透胁迫下黄瓜种子萌发及幼苗生长的影响及其分子机制. 中国农业大学博士学位论文, 北京, 2014.
Zhang N. Regulation of Melatonin on Germination and Seedling Growth under Osmotic Stress in Cucumber. PhD Dissertation of China Agricultural University, Beijing, China, 2014 (in Chinese with English abstract).
[41] 曹林, 吴玉环, 章艺, 郭怡, 肖有铁, 郦枫, 马丽, 徐根娣, 刘鹏. 外源水杨酸对铝胁迫下菊芋光合特性及耐铝性的影响. 水土保持学报, 2015, 29(4): 260–266.
Cao L, Wu Y H, Zhang Y, Guo Y, Xiao Y T, Li F, Ma L, Xu G D, Liu P. Effect of exogenous salicylic acid on photosynthetic characteristics and aluminum tolerance of helianthus tuberosus under aluminum stress.,2015, 29(4): 260–266 (in Chinese with English abstract).
[42] 于奇, 曹亮, 金喜军, 邹京南, 王孟雪, 张明聪, 任春元, 张玉先. 低温胁迫下褪黑素对大豆种子萌发的影响. 大豆科学, 2019, 38: 56–62.
Yu Q, Cao L, Jin X J, Zou J N, Wang M X, Zhang M C, Ren C Y, Zhang Y X. Effects of melatonin on seed germination of soybean under low temperature stress., 2019, 38: 56–62 (in Chinese with English abstract).
[43] 赫传杰. 外源褪黑素对干旱胁迫下樟子松的缓解效应. 沈阳农业大学学报, 2020, 51: 279–286.
He C J. Alleviating effect of exogenous melatonin onvar. mongolica under drought stress., 2020, 51: 279–286 (in Chinese with English abstract).
[44] Liu J, Wang W, Wang L. Exogenous melatonin improves seedling health index and drought tolerance in tomato., 2015, 77: 317–326.
Effects of exogenous melatonin on morphology, photosynthetic physiology, and yield of spring soybean variety Suinong 26 under drought stress
ZHANG Ming-Cong1,**, HE Song-Yu1,**, QIN Bin1, WANG Meng-Xue1, JIN Xi-Jun1, REN Chun-Yuan1, WU Yao-Kun2, and ZHANG Yu-Xian1,*
1College of Agronomy, Heilongjiang Bayi Agricultural University, Daqing 163319, Heilongjiang, China;2Daqing Branch of Heilongjiang Academy of Agricultural Sciences, Daqing 163316, Heilongjiang, China
It is of great significance to study the mechanism of improving the drought resistance ability of soybean seedlings for the growth of soybean seedlings in Northeast China. This experiment was conducted using ‘Suinong 26’ as the experimental material with four treatments to investigate the physiological indexes and yield of soybean under drought stress, including the normal nutrient solution (CK), the drought stress treatment (D), the drought stress + foliar spraying melatonin treatment (LM), and the drought stress + irrigation melatonin treatment (RM). The results indicated that the gas exchange parameters, the dry matter accumulation of organ at seedling stage, the activities of antioxidant enzyme, and the content of soluble protein were increased under LM and RM compared with D. The net photosynthetic rate and stomatal conductance were significantly increased at V2 and V4 stages, and the transpiration rate and intercellular carbon dioxide concentration were significantly increased at V4 stage with< 0.05; POD and CAT of RM were significantly increased at< 0.05; the content of soluble protein was significantly increased after drought stress at V2 and V4 stages at< 0.05. Compared with D, the yield of soybean with LM at V2 and V4 stages was increased by 24.2% and 19.1% at< 0.05, RM increased by 38.6% and 56.3% at< 0.05. Compared with LM, the yield of soybean with RM at V2 and V4 stages was increased by 11.6% and 31.3% at< 0.05. These results revealed that the application of melatonin increased the yield of soybean under drought stress and the yield of soybean with irrigation melatonin treatment was higher than that of foliar spraying melatonin treatment.
drought stress; melatonin; soybean; growth and development; yield
10.3724/SP.J.1006.2021.04154
本研究由国家重点研发计划项目“大田经济作物优质丰产的生理基础与调控” (2018YFD1000905), 中国博士后科学基金项目(2016M591561), 黑龙江省自然科学基金项目(C2016042), 黑龙江省应用技术研究与开发计划项目(GA19B101-02), 黑龙江省农垦总局重点科研计划项目(HKKY190206-01)和黑龙江八一农垦大学博士科研启动基金项目(XYB2014-04)资助。
This study was supported by the National Key Research and Development Program of China “Physiological Basis and Agronomic Management for High-quality and High-yield of Field Cash Crops” (2018YFD1000905), the China Postdoctoral Science Foundation (2016M591561), the Natural Science Foundation of Heilongjiang Province (C2016042), the Applied Technology Research and Development Project of Heilongjiang Province (GA19B101-02), the Key Scientific Research Projects of Heilongjiang Farms and Land Reclamation administration (HKKY190206-1), and the Doctoral Scientific Research Start-up Foundation of Heilongjiang Bayi Agricultural University (XYB2014-04).
张玉先, E-mail: zyx_lxy@126.com
**同等贡献(Contributed equally to this work)
张明聪, E-mail: zhangmingcong@163.com; 何松榆, E-mail: 1274167812@qq.com
2020-07-11;
2021-01-21;
2021-03-10.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20210309.1558.002.html

