花生耐冷综合评价体系构建及耐冷种质筛选
张 鹤 蒋春姬 殷冬梅 董佳乐 任婧瑶 赵新华 钟 超 王晓光 于海秋,*
花生耐冷综合评价体系构建及耐冷种质筛选
张 鹤1蒋春姬1殷冬梅2董佳乐1任婧瑶1赵新华1钟 超1王晓光1于海秋1,*
1沈阳农业大学农学院/花生研究所, 辽宁沈阳 110161;2河南农业大学农学院, 河南郑州 450046
早春低温主要发生在萌发期和幼苗期2个阶段, 是限制我国东北地区花生产量和品质的关键性因素。在农业生产上, 耐冷品种的选育是解决低温冷害问题最直接有效的手段。本研究以68个东北地区主栽的花生品种为试验材料, 分别在室内萌发期、幼苗期及田间对其耐冷性进行了评价。在萌发期, 通过对10℃、8℃、6℃和4℃处理7 d后各花生品种的种子活力进行综合隶属函数分析和标准正态分布检测发现, 6℃处理7 d适合作为大批量花生种质耐冷性鉴定的条件。在幼苗期, 经6℃处理7 d后, 以株高、叶面积、地上部鲜重、地下部鲜重、地上部干重、地下部干重和耐冷等级作为评价指标, 对各花生品种的耐冷性进行鉴定。相关性分析表明, 叶面积、地上部鲜重和耐冷等级与花生的耐冷性关系最为密切, 可以作为花生苗期耐冷性鉴定的主要评价指标。在田间自然条件下, 采用提前播期和分期播种的方式, 以相对出苗率、相对出苗能力及产量构成因素为评价指标对室内筛选结果进行验证, 基于多重表型分析方法, 最终鉴定出适合东北地区种植的在萌发期和幼苗期均耐冷的花生品种农花5号, 以及冷敏感型花生品种阜花18号。本研究为我国高寒地区的花生种植提供了品种参考, 为花生耐冷机制研究提供了优异种质资源。
花生; 耐冷性; 综合评价; 种质资源筛选
花生(L)是世界范围内重要的经济作物和油料作物, 广泛种植于热带和亚热带地区。近年来, 随着对花生需求量的日益增加, 其种植区域正不断地向高海拔、高纬度地区扩张, 目前, 我国东北地区的花生种植面积已达到46.7万~53.3万公顷, 占全国总种植面积的11%左右[1]。但花生作为喜温作物, 整个生育期对温度的要求较高, 东北地区热量条件有限, 春季经常发生大规模的低温冷害, 严重限制了花生的生长发育、产量和品质建成[2-3]。
在农业生产上, 耐冷品种的选育是解决低温冷害最直接有效的手段, 而耐冷性综合评价体系的建立是筛选耐冷种质的前提[4]。近年来, 在耐冷性鉴定分析方法和耐冷指标筛选方面, 前人做了大量工作, 张瑞栋等[5]在25℃、20℃、16℃和12℃人工气候箱中对30份高粱品种进行低温萌发试验, 通过测定不同温度下各高粱品种的发芽势、发芽率、芽长、根长、芽重、根重等萌发指标, 并利用主成分分析和聚类分析方法将30份高粱品种的耐冷性分为4个等级; 黄贺等[6]通过测定9℃低温处理下不同油菜品种的发芽势、发芽率、发芽指数和平均发芽时间, 利用综合隶属函数法对66份油菜品种的耐冷性进行评价, 筛选出极端耐冷型和冷敏感型油菜材料; 张玮等[7]利用田间自然低温, 通过测定18份木薯种质幼苗叶片的相对电导率、丙二醛、可溶性糖、可溶性蛋白、保护酶活性等生理指标, 运用相关性分析和逐步回归分析等方法对其耐冷性进行了综合评价。然而, 作物的耐冷性是一个复杂的数量性状, 受诸多因素控制, 不同作物在不同生育时期和不同冷害类型下会表现出显著的形态发育及生理生化差异[8], 因此, 评价作物对低温冷害的耐受性应选用适当的方法和指标。
目前, 关于花生耐冷性鉴定的研究虽取得一定进展[9-12], 但评价方法和鉴定指标相对较为单一, 利用综合性状筛选耐冷种质的研究少见报道, 完善的耐冷性综合评价体系还未建立。针对东北地区花生生产上的早春低温冷害问题, 本研究以68个东北地区主栽的花生品种为试验材料, 采用室内模拟鉴定和田间自然鉴定相结合的方法对其萌发期和幼苗期的耐冷性进行评价, 并利用综合隶属函数分析、聚类分析、相关性分析和主成分分析等多元统计学分析方法对各评价方法和鉴定指标进行综合分析, 以期构建出花生耐冷性综合评价体系, 筛选出适合东北地区种植的耐冷花生品种, 为高寒地区的花生种植提供种质参考, 同时为花生耐冷机制研究提供优异种质。
1 材料与方法
1.1 供试材料
室内萌发期耐冷性鉴定材料为68个花生品种, 均由沈阳农业大学花生研究所提供, 具体信息如表1所示。
田间耐冷性鉴定和苗期耐冷性鉴定材料为30个花生品种, 其中, 耐冷型花生品种10个: 农花1号、农花5号、农花12号、彩花7号、农花23号、花育19号、花育22号、四粒红、远杂9102和Y-7黑花生; 中间型花生品种10个: 农花11号、农花13号、农花18号、农花19号、花育32号、铁花1号、阜花12号、阜花23号、唐油4号和粤油85号; 敏感型花生品种10个: 农花9号、农花16号、花育20号、铁花3号、锦花5号、阜花18号、冀油2号、冀油9606、粤油26号和白沙1016, 均由沈阳农业大学花生研究所提供。
1.2 试验设计
1.2.1 萌发期试验 采用SHP-150型生化培养箱进行种子标准发芽试验(纸床发芽法)。挑选大小一致、饱满、有活力的花生种子, 分别用1%次氯酸钠溶液消毒10 min, 室温浸泡12 h后, 置于铺有双层湿润滤纸的培养皿中, 分别于4℃、6℃、8℃和10℃下黑暗培养7 d, 之后转入28℃条件下恢复7 d, 期间定量补充蒸馏水, 保证种子湿润, 对照处理(CK)为种子吸胀12 h后直接于28℃下黑暗培养。每个处理设置3次重复, 每个重复30粒种子。

表1 供试花生材料信息

(续表1)
1.2.2 田间试验 从室内萌发期筛选出的耐冷型、中间型和冷敏感型花生品种中, 分别选取10个进行田间耐冷性评价, 试验于2018年和2019年在沈阳农业大学后山试验田(41°82′N, 123°56′E)进行。该试验区属于温带大陆性季风气候, 积温3300~3400℃, 无霜期155~180 d, 年平均气温8.7℃, 年平均降水量714 mm。2018年和2019年生长季降雨量分别为448.4 mm和572.3 mm, 生长季平均气温分别为22.19℃和22.20℃。供试土壤为棕壤土, 含有机质14.9 g kg-1、全氮1.1 g kg-1、碱解氮91.26 mg kg-1、速效磷10.17 mg kg-1、速效钾125.12 mg kg-1, pH 6.5。
采用提前播种的方法, 分为3个播期, 分别于4月10日、4月20日和5月10日(对照)播种。每个品种1行, 单粒播种, 每行30粒, 行长3 m, 垄宽0.6 m, 垄距0.5 m, 株距0.1 m, 每个处理3次重复, 采用随机区组设计。播种前施磷酸二铵150 kg hm-2、过磷酸钙300 kg hm-2和硫酸钾150 kg hm-2作为基肥, 其他管理措施同常规田间管理进行。
1.2.3 苗期试验 从室内萌发期筛选出的耐冷型、中间型和冷敏感型花生品种中分别选取10个进行苗期耐冷性评价, 试验于沈阳农业大学人工气候室内进行。将发芽整齐的种子播种至装有高温灭菌湿沙的花盆中, 每盆播种5粒, 每个品种10盆, 于人工气候室内培养, 期间每天定量补充1/2 Hoagland营养液, 人工气候室培养条件为: 光周期16 h/8 h (昼/夜), 温度28℃/23℃ (昼/夜), 光照强度600 μmol m-2s-1。幼苗长至三叶一心期时, 将盆栽分为2组(每组每个品种5盆), 一组继续在人工气候室内正常培养(对照), 另一组置于低温气候室内处理7 d, 气候室培养条件为: 光周期16 h/8 h (昼/夜), 温度6℃, 光照强度600 μmol m-2s-1。在不同月份重复3次试验。
1.3 测定项目及方法
1.3.1 花生萌发期耐冷性评价指标 以露白(胚根伸出0.5 mm)为标准, 从第1粒种子萌发开始, 逐日测定种子的发芽数, 计算种子活力指标:
发芽势(%) = 萌发4 d种子发芽数/供试种子数× 100
发芽率(%) = 萌发7 d种子发芽数/供试种子数× 100
发芽指数(germination index, GI) = ΣGt/Dt, 式中, Gt为第Dt天对应的发芽数(从第一粒种子萌发开始, 至连续3 d没有种子继续萌发为止)。
活力指数(vigour index, VI) = S×发芽率, 式中, S为萌发结束后10粒种子胚根的平均长度(mm)。
1.3.2 花生田间耐冷性评价指标 自第1期播种之日起到最后1期全部品种连续3 d不再出苗为止, 每日定点记录地下5 cm土层温度, 出苗后, 每日调查并记录各品种出苗数, 计算出苗率、相对出苗率和出苗能力:
出苗率(%) = 各品种出苗数/供试种子数×100
出苗能力(emergence ability, EA) = 相对出苗率× 100/从播种到第天出苗的相应天数
收获时, 3个播期中每个品种各选取5株(出苗率过低不足5株的取3株)具有代表性的植株进行考种, 调查单株饱果数、百果重、百仁重和单株产量, 取平均值。
田间试验分析所用数据均为2018年和2019年试验测定的平均值。
1.3.3 花生苗期耐冷性评价指标 低温胁迫7 d后观察花生幼苗的表型变化, 包括叶片皱缩、叶片似烫伤、叶色变褐等, 并根据叶片的萎蔫情况对各花生品种苗期的耐冷等级进行评价, 分1~9级评价(表2)。

表2 花生幼苗期耐冷性分级标准
低温胁迫7 d后, 每个品种选取5株长势一致的幼苗, 小心地将幼苗连根从沙中取出, 用自来水冲洗, 吸干表面水分(保持根部潮湿但不附着水珠), 用直尺测量株高, 用称重法测定叶面积[13], 用电子天平称取地上部和地下部鲜重, 随后分别装入牛皮纸袋中105℃杀青30 min, 然后于70℃烘干至恒重, 称重得幼苗地上部和地下部的干重。
1.4 数据统计与分析
利用Microsoft Excel 2010整理和分析数据, 利用SPSS 19.0和Origin 2017对数据进行聚类分析、主成分分析和相关性分析, 采用模糊数学中的隶属函数法对花生的耐冷性进行综合评价。
为了消除不同品种基础性状间的差异, 采用性状的相对值(耐冷系数)对耐冷性进行评价, 即:
CC=处理测定值/对照测定值×100%
采用正交旋转的方法对数据进行旋转, 建立综合指标方程, 即:

式中, CI()为综合指标值,B为单项指标相对系数进行规范化标准化的值; Prin()为综合指标的特征向量。
隶属函数法根据模糊数学原理, 将各指标换算成隶属函数值, 即:
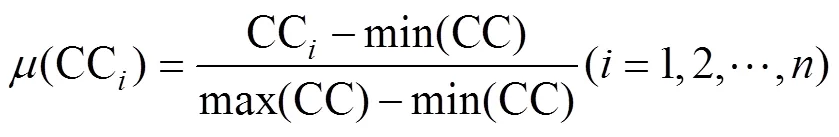
基于隶属函数的耐冷性综合评价值:
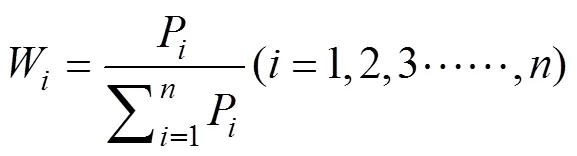
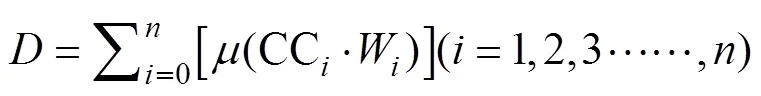
式中,W为各指标的权重系数, 表示第个指标的重要程度,P为第个综合指标贡献率(各指标的特征值即贡献率),为耐冷性综合评价值。
利用标准值计算公式将主成分综合得分和综合隶属函数值进行标准化:
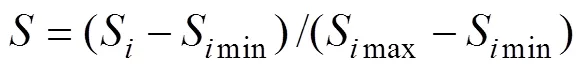
然后计算二者的差值:
其中,S为某花生品种的主成分综合得分或者综合隶属函数值,max、min分别为综合得分或综合隶属函数值中的最大和最小值,S为某花生品种的综合隶属函数值的标准值, 为某花生品种综合得分的标准值。采取差异值0.5作为评判同一方法在不同环境的分析结果之间差异的标准。
2 结果与分析
2.1 花生萌发期耐冷性评价
2.1.1 不同低温处理下各指标的耐冷系数 由表3可知, 低温胁迫下, 68个花生品种的各项活力指标均表现出不同程度的下降趋势, 品种之间差异显著, 变异系数介于7.41%~104.58%之间, 表明供试材料具有丰富的遗传多样性, 测定的指标对低温反应较敏感。但不同花生品种在不同温度处理下各单项指标的变化趋势和变化幅度不尽相同, 即不同指标反映出的耐冷性不同, 因此, 利用单一性状的耐冷系数对花生品种的耐冷性进行评价很难准确反映其耐冷水平, 也无法确定适合花生耐冷性鉴定的温度条件, 故需进一步对多个指标进行综合评价。
2.1.2 不同低温处理下各性状的隶属函数分析
隶属函数法可以综合多个指标对不同花生品种的耐冷性进行分级评价, 有效筛选出对低温胁迫表现极端的品种。以上4个处理温度的结果均表明(附表1), 四粒红、Y-7黑花生和农花5号的耐冷性极强, 而铁花3号和阜花18号的耐冷性最弱。综合4个温度处理下68个花生品种的隶属函数值来看, 不同低温下各花生品种的耐冷性排序并不完全一致, 即不同品种适应低温胁迫的温度范围存在差异, 并且, 在过高或过低的处理温度下, 除少数几个极端材料外, 大部分品种对低温的表现几乎无明显差异, 很难对其耐冷性进行明确分级, 因此, 确定适合评价大部分花生品种耐冷性的温度条件至关重要。
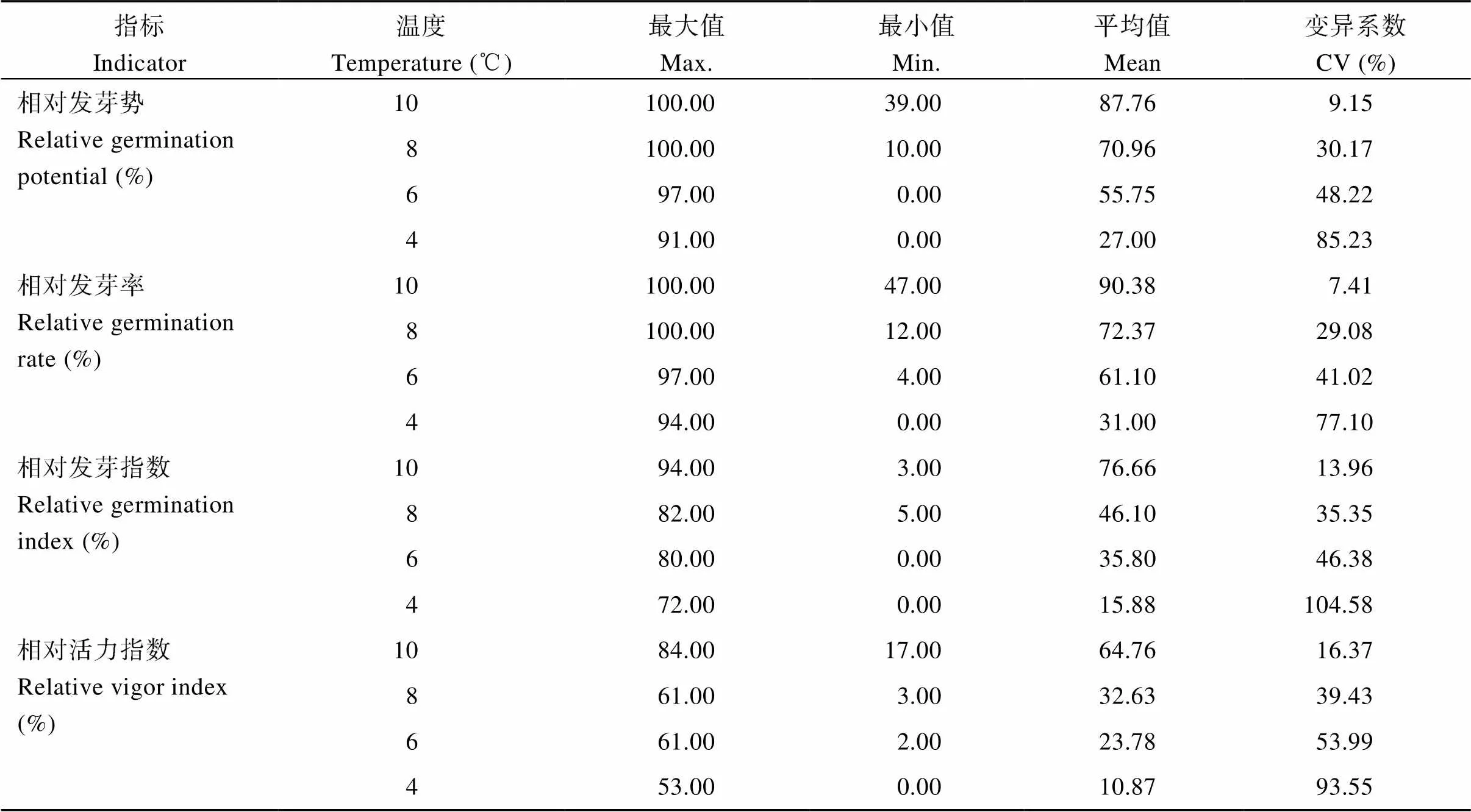
表3 不同低温胁迫处理下68个花生品种的萌发特性
Max.: maximum value; Min.: minimum value; Mean: mean value; CV: coefficient of variation.
2.1.3 花生萌发期耐冷性评价温度的确定 为确定适合作为花生萌发期耐冷性鉴定的温度条件, 利用SPSS 19.0软件对68个花生品种在不同处理温度下的综合隶属函数值进行统计分析。由图1-A可知, 10℃、8℃和4℃低温处理下, 各品种综合隶属函数正态分布检验的峰度均大于0, 呈尖顶峰, 而6℃处理下的峰度为-0.87, 呈平顶峰, 最接近于0; 8℃和4℃低温处理的隶属函数正态检验偏度均大于0, 呈正向偏离, 10℃低温处理的偏度为-2.59, 呈较大程度的负向偏离, 而6℃低温处理下的偏度仅为-0.10, 最符合正态分布。隶属函数的QQ-Plot分析结果也表明(图1-B), 6℃低温处理后各品种的隶属函数值与趋势线的拟合程度最高,2最接近于1, 符合标准正态分布。因此, 6℃处理7 d可以作为鉴定花生萌发期耐冷性的低温胁迫条件。
A: 频率直方图; B: QQ-Plot图。A: frequency histogram; B: QQ-Plot.
2.1.4 花生萌发期耐冷性的聚类分析 将6℃低温处理后68个花生品种的综合隶属函数进行系统聚类分析(图2)发现, 在λ=12.5处, 可将68个花生品种的耐冷性分为4类: 第I类包含农花5号、四粒红、Y-7黑花生、彩花7号和花育22号等18个花生品种, 为耐冷型材料; 第II类包含铁花1号、阜花12号、农花11号、农花19号和唐油4号等18个花生品种, 为中度耐冷型材料; 第III类包含阜花24号、粤油29号、锦9703、粤油98号和连花3号等20个花生品种, 为中度敏感型材料; 第Ⅳ类包括农花16号、阜花18号、铁花3号、农花9号和花育20号等12个花生品种, 为敏感型材料, 其中第Ⅱ类和第III类统称为中间型材料。
2.2 花生田间耐冷性评价
2.2.1 试验期内田间低温变化 辽宁省春季土壤温度以低温为主, 阶段性变化较为明显, 且持续时间较长(附图1)。4月10日至4月25日期间, 平均地温基本维持在15℃以下, 日最低温度仅为4~10℃。4月25日以后, 日平均温度均在15℃以上, 且每日最低温度也基本达到12℃, 可以满足大部分花生种子萌发的最低温度要求。但是在5月下旬(出苗结束), 可能由于持续降雨, 也会出现几次骤然降温, 5月22日、5月23日、5月27日和5月28日的最低温度仅为6~8℃, 虽然低温时间持续较短, 但低温加上高湿的土壤环境可能对花生幼苗的生长造成严重威胁。
2.2.2 不同播期对花生出苗的影响 与第3播期相比, 第1播期各品种的出苗率均有所降低(相对出苗率<1) (图3-A), 其中铁花3号、农花9号、花育20号、农花16号和阜花18号的相对出苗率最低, 不足30%, 而四粒红、农花1号、唐油4号和Y-7黑花生的相对出苗率依然保持较高水平, 均在90%以上。第2播期, 各品种出苗率的降低幅度明显小于第1播期, 大部分品种的相对出苗率在80%以上, 品种间差异较小, 其中四粒红、农花1号、Y-7黑花生和彩花7号的相对出苗率为100%。表明, 春播后遭遇的低温胁迫严重影响种子活力, 降低出苗率, 且经历低温时间越长, 低温烂种概率越大。
出苗能力是综合相对出苗率和出苗时间衡量不同花生品种出苗能力的指标, 在正常条件下, 各花生品种的出苗能力差异较小, 但在遭遇低温胁迫后品种间差异显著(图3-B)。第1播期各花生品种的出苗能力介于0~4之间, 其中四粒红、农花1号、唐油4号、农花12号和Y-7黑花生的出苗能力最强, 铁花3号、农花9号、农花16号、花育20号和阜花18号的出苗能力最弱, 与相对出苗率基本一致。第2播期各花生品种的出苗能力在1~5之间, 其中农花19号的出苗能力最强为4.56, 冀油9606和农花9号的出苗能力最弱, 大部分品种处于较高水平, 且与相对出苗率的高低排序具有一定的差异, 这可能是由于第2期播种经历的低温时间较短, 强度较低, 对大部分品种影响不大所致。
2.2.3 不同播期对各花生品种产量构成因素的影响
从附表2可知, 单株饱果数和单株产量受不同播期的影响较大, 而大部分品种的百果重和百仁重在3个播期的变化并不显著。其中, 四粒红(85%, 65%)、阜花18号(71%, 59%)和铁花3号(67%, 58%)的单株饱果数在第1播期和第2播期的下降幅度最大, 农花5号(15%, 5%)、花育22号(27%, 15%)、唐油4号(28%, 22%)和农花1号(37%, 11%)的降低幅度最小。四粒红(78%, 57%)、铁花3号(76%, 71%)、农花16号(66%, 51%)、彩花7号(66%, 47%)和阜花18号(60%, 48%)单株产量在2个播期中的下降幅度最大, 农花1号(27%, 8%)、花育22号(32%, 17%)、农花5号(33%, 19%)和农花18号(34%, 15%)的单株产量下降幅度最小。
A: 相对出苗率; B: 出苗能力。*和**分别表示在0.05和0.01水平上差异显著。
A: relative emergency rate; B: emergency ability. * and ** mean significantly different at the 0.05 and 0.01 probability levels, respectively.
2.2.4 花生田间耐冷性综合评价 以第3播期为对照, 分别对第1播期和第2播期各花生品种的出苗率、出苗能力、单株饱果数、单株产量、百果重和百仁重等田间测定指标的相对值进行隶属函数分析。从图4可以看出, 农花1号、农花5号、花育22号、唐油4号和铁花1号的综合隶属函数值较大, 在0.7以上, 表明在田间具有较强的耐冷性, 而铁花3号、阜花18号、冀油9606、粤油26号、农花9号和农花16号的综合隶属函数值较小, 均在0.4以下, 表明其对田间低温较为敏感。
X1-1和X1-2分别代表第1播期和第2播期的相对出苗率; X2-1和X2-2分别代表第1播期和第2播期的相对出苗能力; X3-1和X3-3分别代表第1播期和第2播期的相对单株饱果数; X4-1和X4-2分别代表第1播期和第2播期的相对单株产量; X5-1和X5-2分别代表第1播期和第2播期的相对百果重; X6-1和X6-2分别代表第1播期和第2播期的相对百仁重。
X1-1 and X1-2 represent the relative emergence rate of the first sowing date and the second sowing date, respectively; X2-1 and X2-2 represent the relative emergence ability of the first sowing date and the second sowing date, respectively; X3-1 and X3-2 represent the relative number of full pods per plant of the first sowing date and the second sowing date, respectively; X4-1 and X4-2 represent the relative yield per plant of the first sowing date and the second sowing date, respectively; X5-1 and X5-2 represent the relative weight of 100-pod weight of the first sowing date and the second sowing date, respectively; X6-1 and X6-2 represent the relative weight of 100-seed weight of the first sowing date and the second sowing date, respectively.
2.2.5 基于多重表型分析方法对不同环境下花生耐冷评价的差异比较 采用多重表型分析法, 对田间评价结果和室内萌发期鉴定结果进行比较, 以差异值0.5作为参考线, 从图5可以看出, 有4个花生品种(锦花5号、四粒红、冀油2号和Y-7黑花生)在田间试验和室内萌发试验中的结果差异较大, 而大部分品种的差异值分布在0.2以下, 其中农花5号、铁花3号、阜花23号和粤油26号的基本为0, 表明在2种试验条件下耐冷性比较稳定, 验证了利用室内培养箱对花生耐冷性进行鉴定的可靠性。
2.3 花生幼苗期耐冷性评价
2.3.1 低温胁迫对不同花生品种生长表型的影响
利用人工气候室, 对萌发期筛选出的耐冷型、中间型和敏感型花生品种进行幼苗期耐冷性鉴定。6℃处理7 d后, 30个花生品种表现出不同程度的脱水、萎蔫、黄化、褪色等症状(附图2)。其中, 彩花7号、农花5号、农花1号和花育22号在低温胁迫下依然能够保持直立, 只有少数叶片发生脱水, 稍有萎蔫, 无黄化和褪色现象; 而冀油9606和阜花18号在低温胁迫下表现出茎秆干枯黄化, 叶片褪色发白, 有些植株甚至枯死。
2.3.2 低温胁迫下各形态指标的关联分析 为明确低温胁迫对各花生品种苗期生长发育的影响, 对花生幼苗的耐冷等级、株高、叶面积、地上部鲜重、地下部鲜重、地上部干重和地下部干重等形态指标进行测定(附表3), 并进一步对各性状进行关联分析。由图6可知, 不同形态指标并非完全独立, 部分性状之间甚至具有较强的关联性, 株高、叶面积、地上部鲜重、地下部鲜重、地上部干重和地下部干重均与耐冷等级显著正相关, 其中叶面积与耐冷等级、地上部鲜重与耐冷等级之间的皮尔森相关系数达到0.9以上, 结果表明叶面积和地上部鲜重与花生幼苗的耐冷性关系最为密切, 而地下部鲜重和地下部干重与植株耐冷性之间的关系则相对较弱。从图6中的正态分布图可以看出, 各性状均呈较强的单峰分布, 其中叶面积、地上部鲜重和耐冷等级最接近标准正态分布。
2.3.3 低温胁迫下各形态指标的主成分分析 为了进一步明确低温胁迫下花生幼苗各形态指标的内在联系, 利用主成分分析法对7个观测指标进行综合分析(附表4和附表5), 根据各主成分的贡献率, 建立了花生耐冷性综合评价数学模型:
= 0.681+0.382+0.403-0.404-0.425-0.266+ 0.307
其中,1~7分别代表株高、叶面积、地上部鲜重、地下部鲜重、地上部干重、地下部干重和耐冷等级的标准化值。
将各指标的标准化值代入耐冷性综合评价模型, 得到各花生品种的耐冷性综合得分(图7), 有14个花生品种的综合得分为负值, 16个花生品种的综合得分为正值, 其中, 阜花18号、四粒红、冀油9606、铁花3号、农花16号和花育20号的综合得分均在-1以下, 为冷敏感型材料, 而彩花7号、农花5号、农花1号和花育22号的综合得分在1以上, 在苗期为耐冷型材料。
3 讨论
低温冷害是限制我国东北地区农业生产的主要非生物胁迫因素之一, 影响作物的整个生育进程[14]。萌发期和幼苗期是植物生长发育过程中最脆弱而又十分重要的时期, 而东北地区十年九春寒, 春播时期遭遇的低温冷害轻者延缓作物种子萌发和幼苗生长发育[15], 重者使大部分种子丧失发芽能力, 造成出苗不齐、苗势弱、出苗时间延长等后果, 最终导致大幅度减产[16]。在大多数作物中, 有些品种不同生育期的耐冷性是一致的, 而有些品种不同生育期的耐冷性存在显著差异[17-18]。因此, 在各生育时期对花生种质资源进行有效地耐冷性鉴定、筛选与利用对指导东北地区的花生生产至关重要。本研究以68个东北地区主栽的花生品种为试验材料, 分别在室内萌发期和幼苗期及田间对其耐冷性进行评价, 构建了花生耐冷性综合评价体系, 为我国高寒地区的花生种植提供品种参考。
PH: 株高; LA: 叶面积; SFW: 地上部鲜重; RFW: 地下部干重; SDW: 地上部干重; RDW: 地下部干重; CTG: 耐冷等级。*和**分别表示在0.05和0.01水平上差异显著。
PH: plant height; LA: leaf area; SFW: shoot fresh weight; RFW: root fresh weight; SDW: shoot dry weight; RDW: root dry weight; CTG: cold tolerance grade.*and**mean significantly different at the 0.05 and 0.01 probability levels, respectively.
植物的耐冷性是为适应低温环境而产生的一种生理反应, 同一物种的不同品种之间在耐低温性能上存在一定的差异[19]。目前, 关于低温对花生生产的影响以及耐低温花生种质的筛选已有相关报道, 且大多集中在种子萌发期。陈昊等[20]通过分析常温条件下(25℃)和冷胁迫条件下(2℃)花生种子萌发过程中的吸水状况, 证明了吸胀阶段种子2℃冷胁迫12 h能够更好地区分不同花生种质之间耐冷性的差异, 并利用该鉴定体系对64份花生种质的耐冷性进行鉴定。陶群等[21]在萌发期设置2℃、-1℃和-4℃ 3个温度梯度, 对不同花生种质的耐冷性进行鉴定表明,-1℃处理12 h后种子活力显著降低, 影响发芽和出苗, 可作为花生萌发期耐冷性鉴定的条件。虽然前人对花生种子萌发期间的耐低温特性进行了有价值的研究, 但在处理条件和评价指标上仍未形成统一的标准, 因此, 确定适合大批量花生种质耐冷性评价的温度条件是花生耐冷性鉴定工作有效进行的前提。本研究以68个花生品种为试验材料, 根据田间播种后可能遭遇的冷害温度, 对吸胀后的花生种子分别在4℃、6℃、8℃和10℃的低温条件下处理7 d, 在常温下恢复7 d后以相对发芽势、相对发芽率、相对发芽指数和相对活力指数作为评价指标, 对花生品种的耐冷性进行鉴定表明, 4℃的低温处理对花生种子活力的影响较大, 大部分花生品种均处于较低的水平, 无法对其耐冷能力进行有效区分; 8℃和10℃的低温处理对花生种子的活力影响较小, 品种间的差异并不显著; 而6℃处理7 d后, 各种子活力指标均呈明显的正态分布, 品种间差异显著, 可以明确地将各花生品种的耐冷性进行分级排序, 因此, 6℃处理7 d可以作为大批量花生种质耐冷性鉴定的条件。
为了保证筛选出的耐低温种质适合于田间生产,在田间自然条件下对其耐冷性进行进一步验证是十分必要的[22]。本研究从室内萌发期筛选出的耐冷型、中间型和敏感型花生品种中各选取10个, 采用提前播种的方法, 对其耐冷性进行验证评价。为了探究早春低温导致的出苗时间延迟是否会造成后期产量的降低, 本研究除了将相对出苗率和出苗能力作为评价指标外, 还综合了产量构成因素, 结果表明, 不同播期之间以及同一播期不同品种之间的出苗情况和产量构成均存在显著差异。利用多重表型分析方法, 将室内萌发期筛选结果与田间验证结果进行比较发现, 2种环境下大部分花生品种的耐冷性表现一致, 但少数品种如四粒红和Y-7在2种环境条件下却表现出相反的结果, 在田间虽然出苗率较高, 但产量却较低, 不适合田间生产, 这也表明了在田间耐冷性评价中综合考虑产量构成因素是十分必要的。
花生除了在萌发出苗期易受低温冷害的威胁, 在出苗结束后也会遭遇瞬时低温冷害, 影响植株的生长和生存能力。植物在逆境条件下, 会通过改变自身的生长和形态特征如降低植株的高度、鲜重和干重等来适应这种逆境条件[23], 通过调整自身生物量的分配来维持逆境条件下植株的存活和生长[24]。靳亚楠[25]以相对电导率、根长、株高、苗鲜重和苗干重作为评价指标, 对205份玉米材料的耐冷性进行鉴定表明, 相对苗鲜重和相对苗干重是较好的鉴定指标, 但不同品种不同指标对低温胁迫的反应不尽相同, 用某一单项指标很难全面准确地反映品种的耐冷实质, 采用多个指标对作物的耐冷性进行综合评价更为可靠。本研究以株高、叶面积、地上部鲜重、地下部鲜重、地上部干重、地下部干重和耐冷等级作为鉴定指标, 采用相关性分析和主成分分析等综合分析方法对30个花生品种的耐冷性进行评价表明, 叶面积、地上部鲜重和耐冷等级与花生的耐冷性关系最为密切, 可以作为花生苗期耐冷性鉴定的指标。
4 结论
利用综合隶属函数分析、聚类分析和主成分分析等多元分析方法, 对68个花生品种萌发期、幼苗期和田间的耐冷性进行鉴定, 最终筛选出适合东北地区种植的在萌发期和幼苗期均耐冷的花生品种农花5号和冷敏感型花生品种阜花18号, 并建立了花生耐冷综合评价体系: 在萌发期, 6℃处理7 d适合作为大批量花生种质耐冷性鉴定的条件, 符合东北地区生产实际; 在幼苗期, 叶面积、地上部鲜重和耐冷等级与花生的耐冷性最相关, 可以作为花生苗期耐冷性快速鉴定的指标。
附表和附图 请见网络版: 1) 本刊网站http://zwxb. chinacrops.org/; 2) 中国知网http://www.cnki.net/; 3) 万方数据http://c.wanfangdata.com.cn/Periodical-zuo wxb.aspx。
[1] 国家统计局. 中国统计年鉴2019. 北京: 中国统计出版社, 2019.
National Bureau of Statistics. Statistical Yearbook of China 2019. Beijing: China Statistics Press, 2019 (in Chinese).
[2] 张高华, 于树涛, 王鹤, 王旭达. 高油酸花生发芽期低温胁迫转录组及差异表达基因分析. 遗传, 2019, 41: 1050–1059.
Zhang G H, Yu S T, Wang H, Wang X D. Transcriptome profiling of high oleic peanut under low temperature during germination. Hereditas, 2019, 41: 1050–1059 (in Chinese with English abstract).
[3] Zhang H, Dong J, Zhao X, Zhang Y, Ren J, Xing L, Jiang C, Wang X, Wang J, Zhao S, Yu H. Research progress in membrane lipid metabolism and molecular mechanism in peanut cold tolerance., 2019, 10: 838.
[4] 周亚峰, 许彦宾, 王艳玲, 李琼, 胡建斌. 基于主成分-聚类分析构建甜瓜幼苗耐冷性综合评价体系. 植物学报, 2017, 52: 520–529.
Zhou Y F, Xu Y B, Wang Y L, Li Q, Hu J B. Establishment of a comprehensive evaluation system for chilling tolerance in melon seedlings based on principal component analysis and cluster analysis., 2017, 52: 520–529 (in Chinese with English abstract).
[5] 张瑞栋, 肖梦颖, 徐晓雪, 姜冰, 邢艺凡, 陈小飞, 李邦, 艾雪莹, 周宇飞, 黄瑞冬. 高粱种子对萌发温度的响应分析与耐低温萌发能力鉴定. 作物学报, 2020, 46: 889–901.
Zhang R D, Xiao M Y, Xu X X, Jiang B, Xing Y F, Chen X F, Li B, Ai X Y, Zhou Y F, Huang R D. Responses of sorghum hybrids to germination temperatures and identification of low temperature resistance., 2020, 46: 889–901 (in Chinese with English abstract).
[6] 黄贺, 闫蕾, 吕艳, 丁晓雨, 蔡俊松, 程勇, 张学昆, 邹锡玲. 甘蓝型油菜发芽期低温耐性的评价与材料筛选. 中国油料作物学报, 2019, 41: 723–734.
Huang H, Yan L, Lyu Y, Ding X Y, Cai J S, Cheng Y, Zhang X K, Zou X L. Screening and evaluation of low temperature tolerance of rapeseed (L.) at germination stage., 2019, 41: 723–734 (in Chinese with English abstract).
[7] 张玮, 易拓, 唐维, 宋勇. 木薯耐寒性种质资源及其鉴定指标的筛选与综合评价. 热带作物学报, 2019, 40(1): 1–10.
Zhang W, Yi T, Tang W, Song Y. Selection and comprehensive evaluation of Cassava cold-resistant germplasm resources and identification indexes., 2019, 40(1): 1–10 (in Chinese with English abstract).
[8] 张笑笑, 潘映红, 任富莉, 蒲伟军, 王道平, 李玉斌, 陆平, 李桂英, 朱莉. 基于多重表型分析的准确评价高粱抗旱性方法的建立. 作物学报, 2019, 45: 1735–1745.
Zhang X X, Pan Y H, Ren F L, Pu W J, Wang D P, Li Y B, Lu P, Li G Y, Zhu L. Establishment of an accurate evaluation method for drought resistance based on multilevel phenotype analysis in sorghum., 2019, 45: 1735–1745 (in Chinese with English abstract).
[9] 常博文, 钟鹏, 刘杰, 唐中华, 高亚冰, 于洪久, 郭炜. 低温胁迫和赤霉素对花生种子萌发和幼苗生理响应的影响. 作物学报, 2019, 45: 118–130.
Chang B W, Zhong P, Liu J, Tang Z H, Gao Y B, Yu H J, Guo W. Effect of low-temperature stress and gibberellin on seed germination and seedling physiological responses in peanut., 2019, 45: 118–130 (in Chinese with English abstract).
[10] 吕建伟, 马天进, 李正强, 陈锋, 姜慧芳. 花生种质资源出苗期耐低温性鉴定方法及应用. 花生学报, 2014, 43(3): 13–18.
Lyu J W, Ma T J, Li Z Q, Chen F, Jiang H F. Identification method of low temperature tolerance on peanut germplasm resources in emergence stage and its application., 2014, 43(3): 13–18 (in Chinese with English abstract).
[11] 唐月异, 王传堂, 高华援, 凤桐, 张树伟, 王秀贞, 张建成, 禹山林. 花生种子吸胀期间耐低温性及其与品质性状的相关研究. 核农学报, 2011, 25: 436–442.
Tang Y Y, Wang C T, Gao H Y, Feng T, Zhang S W, Wang X Z, Zhang J C, Yu S L. Low Temperature tolerance during seed imbibition and its relationship to main quality traits in peanut., 2011, 25: 436–442 (in Chinese with English abstract).
[12] 陈小姝, 刘海龙, 王绍伦, 杨富军, 高华援, 孙晓苹, 李春雨, 吕永超, 朱晓敏, 宁洽, 周玉萍. 花生发芽至苗期耐低温性的鉴定及评价. 东北农业科学, 2019, 44(1): 12–17.
Chen X S, Liu H L, Wang S L, Yang F J, Gao H Y, Sun X P, Li C Y, Lyu Y C, Zhu X M, Ning Q, Zhou Y P. Identification and evaluation of cold resistance of peanut during germination and seedling period., 2019, 44(1): 12–17 (in Chinese with English abstract).
[13] 潘铜华, 王云龙, 杨俊伟, 习林杰, 丁娟娟, 张静, 邹志荣. 蔬菜幼苗叶面积快速测定方法筛选与优化. 中国蔬菜, 2018, (8): 64–69.
Pan T H, Wang Y L, Yang J W, Xi L J, Ding J J, Zhang J, Zou Z R. Screening and optimization of rapid measurement method for leaf area of vegetable seedlings., 2018, (8): 64–69 (in Chinese with English abstract).
[14] 何学敏, 刘笑, 殷红, 游松财. 1986–2015年中国东北地区主要农业气象灾害变化特征. 沈阳农业大学学报, 2019, 50: 392–398.
He X M, Liu X, Yin H, You S C. Characteristics of major agricultural meteorological disasters in northeast China from 1986 to 2015., 2019, 50: 392–398 (in Chinese with English abstract).
[15] Li M, Sui N, Lin L, Yang Z, Zhang Y. Transcriptomic profiling revealed genes involved in response to cold stress in maize., 2019, 46: 830–844.
[16] Shen X, Liu B, Xue Z, Jiang M, Lu X, Zhang Q. Spatiotemporal variation in vegetation spring phenology and its response to climate change in freshwater marshes of northeast China., 2019, 666: 1169–1177.
[17] 何洋, 刘洋, 方宝华, 何小娥, 杨坚, 滕振宁, 张玉烛. 不同生育期温度逆境处理对早稻产量的影响. 中国农学通报, 2016, 32(24): 18–24.
He Y, Liu Y, Fang B H, He X E, Yang J, Teng Z N, Zhang Y Z. Effect of temperature on early rice yield at different growth stages., 2016, 32(24): 18–24 (in Chinese with English abstract).
[18] 李霞, 戴传超, 程睿, 陈婷, 焦德茂. 不同生育期水稻耐冷性的鉴定及耐冷性差异的生理机制. 作物学报, 2006, 32: 76–83.
Li X, Dai C C, Cheng R, Chen T, Jiao D M. Identification for cold tolerance at different growth stages in rice (L.) and physiological mechanism of differential cold tolerance., 2006, 32: 76–83 (in Chinese with English abstract).
[19] Ding Y, Shi Y, Yang S. Advances and challenges in uncovering cold tolerance regulatory mechanisms in plants., 2019, 222: 1690–1704.
[20] 陈昊, 徐日荣, 陈湘瑜, 张玉梅, 胡润芳, 蓝新隆, 唐兆秀, 林国强. 花生种子萌发吸胀阶段冷害抗性的鉴定及耐冷种质的筛选. 植物遗传资源学报, 2020, 21: 192–200.
Chen H, Xu R R, Chen X Y, Zhang Y M, Hu R F, Lan X L, Tang Z X, Lin G Q. Identification of imbibitional chilling injury resistance for peanut and screening of imbibitional chilling-tolerance germplasm., 2020, 21: 192–200 (in Chinese with English abstract).
[21] 陶群, 张晓军, 王月福, 赵长星, 王铭伦. 低温对花生种子发芽及幼苗生长的影响. 花生学报, 2014, 43(1): 24–27.
Tao Q, Zhang X J, Wang Y F, Zhao C X, Wang M L. Effects of low temperature on seed germination and seedling growth of peanut., 2014, 43(1): 24–27 (in Chinese with English abstract).
[22] Li Q, Byrns B, Badawi M A, Diallo A B, Danyluk J, Sarhan F, Laudencia-Chingcuanco D, Zou J, Fowler D B. Transcriptomic insights into phenological development and cold tolerance of wheat grown in the field., 2018, 176: 2376–2394.
[23] Körner C. Plant adaptation to cold climates., 2016, 5(F1000 Faculty Rev): 2769.
[24] Falster D S, Westoby M. Plant height and evolutionary games., 2003, 18: 337–343.
[25] 靳亚楠. 玉米苗期耐冷性评价及禾本科COLD1蛋白功能与进化分析. 沈阳农业大学博士学位论文, 辽宁沈阳, 2019.
Jin Y N. Evaluation of Maize (L.) Cold Tolerance at Seedling Stage, and Functional and Evolutionary Analyses of Crops COLD1 Proteins. PhD Dissertation of Shenyang Agricultural University, Shenyang, Liaoning, China, 2019 (in Chinese with English abstract).
Establishment of comprehensive evaluation system for cold tolerance and screening of cold-tolerance germplasm in peanut
ZHANG He1, JIANG Chun-Ji1, YIN Dong-Mei2, DONG Jia-Le1, REN Jing-Yao1, ZHAO Xin-Hua1, ZHONG Chao1, WANG Xiao-Guang1, and YU Hai-Qiu1,*
1College of Agronomy / Peanut Research Institute, Shenyang Agricultural University, Shenyang 110161, Liaoning, China;2College of Agronomy, Shenyang Agricultural University, Zhengzhou 450046, Henan, China
Low temperature in early spring is the key factor limiting the yield and quality of peanut in Northeast China, which mainly occurs at germination and seedling stages. The selection and breeding of cold-tolerant cultivars are the most direct and effective means to solve the problem of chilling injury in agricultural production. In this study, 68 peanut cultivars mainly planted in Northeast China were used as experimental materials, and their cold tolerance was evaluated at germination and seedling stages in the climatic chamber and field, respectively. At germination stage, we found that the cold treatment at 6℃ for seven days could be the suitable condition for cold tolerance evaluation of large-scale peanut germplasm by the comprehensive membership function analysis and the standard normal distribution test according to the seed vigor of peanut cultivars after treatments at 10℃, 8℃, 6℃, and 4℃ for seven days. At seedling stage, after treatment at 6℃ for seven days, plant height, leaf area, fresh weight of aerial parts, fresh weight of root, dry weight of aerial parts, dry weight of root, and cold tolerance grade were measured to evaluate the cold tolerance of various peanut cultivars. Correlation analysis revealed that the leaf area, fresh weight of aerial parts and cold tolerance grade had the most significant relationships with cold tolerance and could be used as the main evaluation indicators for the identification of cold tolerance at seedling stage in peanut. In the field, cold tolerance of various cultivars were evaluated by emergence rate, emergence ability, and yield component factors through the early sowing and sowing by stages. Finally, based on the multiple phenotypic analysis, the most cold-tolerant peanut (cultivar NH5) and the most cold-sensitive peanut (cultivar FH18) were identified at germination and seedling stages, suitable for planting in Northeast China. This study provided the reference for peanut planting in high-latitude and cold regions and the excellent germplasm of cold tolerance mechanism in peanut.
peanut; cold tolerance; comprehensive evaluation; screening for germplasm resources
10.3724/SP.J.1006.2021.04182
本研究由国家重点研发计划项目“大田经济作物优质丰产的生理基础与调控”(2018YFD1000900)和辽宁省“兴辽英才计划”项目(XLYC1902002)资助。
This study was supported by the National Key Research and Development Program of China “Physiological Basis and Agronomic Management for High-quality and High-yield of Field Cash Crops” (2018YFD1000900), and the Liaoning Revitalization Talents Program (XLYC1902002).
于海秋, E-mail: yuhaiqiu@syau.edu.cn
E-mail: ZhangHe_517@163.com
2020-08-10;
2021-01-21;
2021-02-25.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20210225.1548.015.html

