莴苣种子萌发过程中细胞壁降解酶活性的动态变化
叶 漪, 贺 芬, 王 晖, 曾 清, 梁 娟,
(1.怀化学院生物与食品工程学院, 湖南 怀化 418000;2.民族药用植物资源研究与利用湖南省重点实验室, 湖南 怀化 418000)
种子萌发首先是胚根突破胚乳细胞壁,而胚乳细胞壁中存在的甘露聚糖等多聚物对种子萌发时胚根的伸出有较强的机械阻力[1-2]。Ikuma等[3]认为,种子萌发前细胞壁的降解有助于胚根的突破。胚乳弱化的概念由此产生。胚乳弱化是指种子萌发过程中,包围在胚根外围的胚乳组织由于细胞壁发生降解,机械强度下降,从而有助于胚根突破胚乳,完成萌发过程。研究表明,细胞壁的酶促反应或物理方法处理能有效降低胚乳的机械阻力,对胚根突破胚乳细胞壁,即种子萌发非常重要[3-6]。如在拟南芥、番茄种子萌发过程中,内切-β-甘露聚糖酶的活性增加[1,7-8],而在白菜、水稻种子萌发过程中,内切-β-甘露聚糖酶、α-半乳糖苷酶和β-甘露糖苷酶均有不同程度的增加[9-10]。
以往研究各处理对种子萌发过程中细胞壁降解酶活性的影响,都是在种子完成萌发后一起进行测定[10-11],有些种子萌发快,有些慢,甚至还有少量不萌发,此时各种子的生理活性差异较大,一起测定不能较准确地反映此时细胞壁降解酶的活性。另外,在研究种子萌发过程中细胞壁降解酶活性变化时,则是在种子的整个萌发进程中每隔一定时间多次测量酶活性[12-13],然而细胞壁降解酶活性测定方法繁琐、耗时,且测定所用试剂价格昂贵。为进一步阐明细胞壁降解酶活性与种子萌发的关系,本实验以莴苣种子为材料,探讨内切-β-甘露聚糖酶、α-半乳糖苷酶和β-甘露糖苷酶活性等三种主要的细胞壁降解酶在种子的不同萌发阶段,即干种子、吸胀种子、狭义萌发种子和完全萌发种子中的变化情况,为种子萌发机理的阐明提供理论依据,同时也为测定其他种子萌发过程中酶活性的变化提供一条新的思路。
1 材料与方法
1.1 材 料
供试材料为上海种都公司提供的莴苣种子,市购,于-20 ℃ 冰箱中保存待用。
1.2 方 法
1.2.1莴苣种子吸水曲线的测定
取莴苣种子100粒于80 ℃烘箱中烘至恒重,计算初始含水量。再取100粒莴苣种子置于垫有2层滤纸的直径为9 cm的培养皿中,加入5 mL去离子水,置于19 ℃恒温培养箱中吸胀(前期实验发现莴苣种子的最适萌发温度为19 ℃),吸胀时间分别为:0、1、2、4、6、8、10、12、16、20、24、28、32、36、40、44、48 h。按上述时间吸胀后,用滤纸吸干种子表面水分并称重,计算含水量(g·g-1干种子),每次处理3次重复,取平均值。最后以吸胀时间为横坐标,以种子含水量为纵坐标作吸水曲线。
1.2.2莴苣种子萌发进程的测定
取100粒莴苣种子置于垫有2层滤纸的直径为9 cm的培养皿中,加入5 mL去离子水,置于19 ℃恒温培养箱中萌发(以下胚轴突破种皮2 mm视为发芽),每隔2 h统计种子萌发情况,设3次重复,然后以萌发时间为横坐标,萌发率为纵坐标绘制萌发进程曲线。
1.2.3莴苣种子不同萌发阶段的确定
结合吸水曲线与萌发进程,确定莴苣种子萌发的四个不同阶段,即干种子、吸胀种子、狭义萌发种子、完全萌发种子。其中干种子为存于-20 ℃ 冰箱中待用的种子;吸胀种子为置于4 ℃冰箱中吸胀的种子(吸胀时间与狭义萌发种子处理时间一致);狭义萌发种子为置于19 ℃恒温培养箱中萌发至1%萌发率时的种子,即萌发刚启动的种子;完全萌发种子为19 ℃恒温培养箱中萌发至48 h的种子(18 h后每隔2 h将萌发的种子转移至-20 ℃冰箱保存),即刚萌发完成的种子。各不同萌发阶段的莴苣种子均保存于-20 ℃冰箱中用于后续细胞壁降解酶活性的测定。
1.2.4莴苣种子萌发过程中细胞壁降解酶活性的测定
取不同萌发阶段的300粒莴苣种子加入缓冲液,在冰上迅速研磨(3 min),然后离心15 min(4 ℃,12 500 r·min-1),收集上清液,上清液再次离心15 min(4 ℃,12 500 r·min-1),该上清液用于α-半乳糖苷酶和内切-β-甘露聚糖酶酶活性的测定。再往含有沉淀的离心管中加入缓冲液,混匀,离心15 min(4 ℃,12 500 r·min-1),收集上清液,此上清液用于β-甘露糖苷酶的活性测定。
α-半乳糖苷酶和β-甘露糖苷酶活性的测定采用PNPG法[14]。α-半乳糖苷酶和β-甘露糖苷酶分别可催化 p-硝基苯基-α-D-吡喃半乳糖苷和4-硝基酚苯酚-β-D-吡喃甘露糖甘水解生成对硝基苯酚,后者在405 nm处有最大吸收峰。酶促反应后分别测定405 nm处的OD值,再用考马斯亮蓝法测定这两个酶的蛋白含量。酶活力单位为每毫克蛋白每分钟水解得到多少微摩尔对硝基苯酚(对硝基苯酚与蛋白标准曲线如图1、2所示)。每个设3次重复,取平均值。
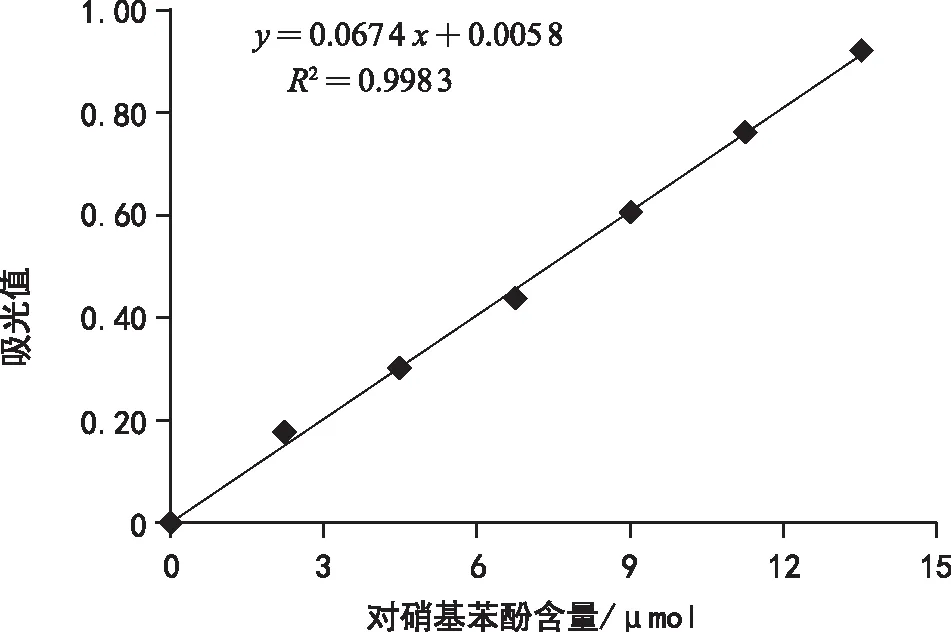
图1 对硝基苯酚标准曲线

图2 牛血清蛋白标准曲线
内切-β-甘露聚糖酶活性的测定采用凝胶扩散法[14]。内切-β-甘露聚糖酶能够水解槐豆胶中的半乳甘露聚糖,形成透明圈,其活性大小与透明圈直径成正比,酶活力用每毫克蛋白所含的酶活力单位来表示(内切-β-甘露聚糖酶活力标准曲线如图3所示)。每个处理设3次重复,取平均值。

图3 内切-β-甘露聚糖酶活力标准曲线
1.3 数据分析
用SPSS 20.0软件进行数据统计分析,用Student-Newman-Keulsl(S-N-K,p<0.05)进行显著性差异分析。
2 结果与分析
2.1 莴苣种子的吸胀曲线
以种子干重为基础表示含水量。如图4所示,莴苣种子初始含水量较低,为0.05 g·g-1。莴苣种子萌发过程中吸水呈现“S型曲线”。在0~6 h内,种子吸水速率快,含水量迅速上升至0.46 g·g-1,该阶段吸水主要靠吸胀作用完成。在6~16 h内,莴苣种子处于吸水停滞期,吸水量基本保持恒定,含水量由0.455 g·g-1上升至0.475 g·g-1。在16~48 h内,莴苣种子吸水速率再次上升,但上升较为平缓,含水量由0.48 g·g-1上升至0.63 g·g-1,此阶段种子相继萌发,其吸水为生命吸水。

图4 莴苣种子吸水曲线
2.2 莴苣种子的萌发进程
莴苣种子萌发进程如图5所示。莴苣种子在18 h时开始萌发,随后萌发率迅速上升,在36 h时,萌发率达90.11%,随后种子萌发率逐步稳定, 48 h时萌发率达95.11%。种子吸水曲线与萌发进程的测定为莴苣种子萌发阶段的划分提供了重要依据。
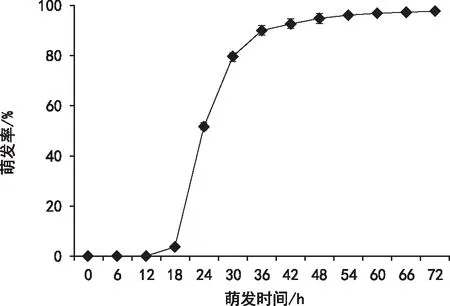
图5 莴苣种子萌发进程
2.3 不同萌发活性莴苣种子中细胞壁降解酶活性的变化
在莴苣种子萌发进程中,细胞壁降解酶活性存在显著差异(图6~图8)。在干种子中,具有一定的α-半乳糖苷酶和 β-甘露糖苷酶活性,但内切-β-甘露聚糖酶活性为0。随着萌发进程的推进,吸胀种子、狭义萌发种子以及完全萌发种子中α-半乳糖苷酶的活性呈递增的趋势,完全萌发种子中其活性为7.82 μmol·(min·mg)-1;内切-β-甘露聚糖酶活性增加最为显著,完全萌发种子中其活性为0.05 nkat·mg-1;而 β-甘露糖苷酶的活性则呈递减的趋势,完全萌发种子中该酶的活性最低。

注:同列不同字母表示处理间差异达5%显著水平。下同。图6 莴苣种子不同萌发阶段α-半乳糖苷酶活性变化
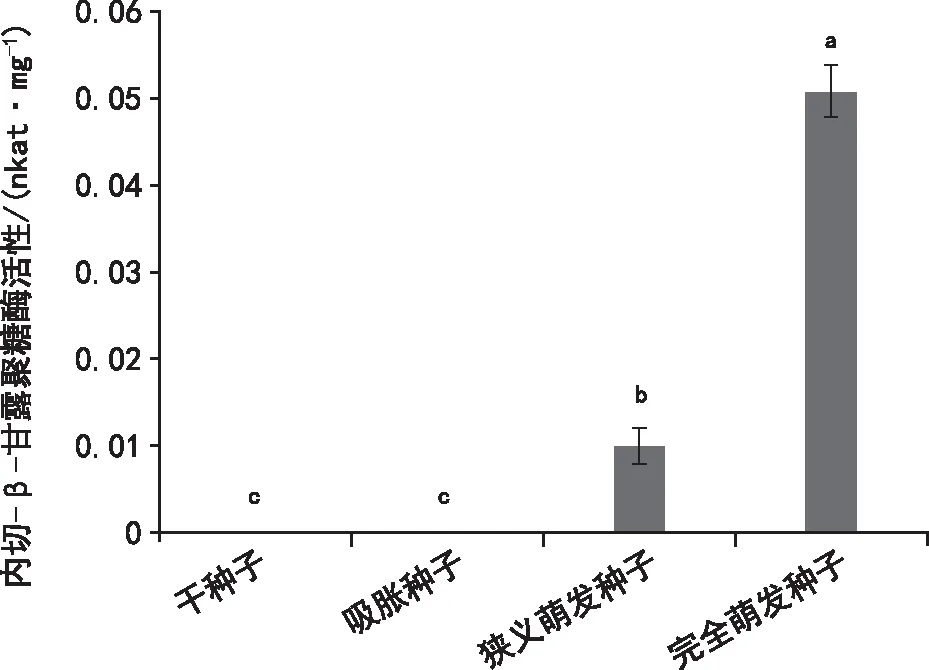
图7 莴苣种子不同萌发阶段内切-β-甘露聚糖酶活性变化
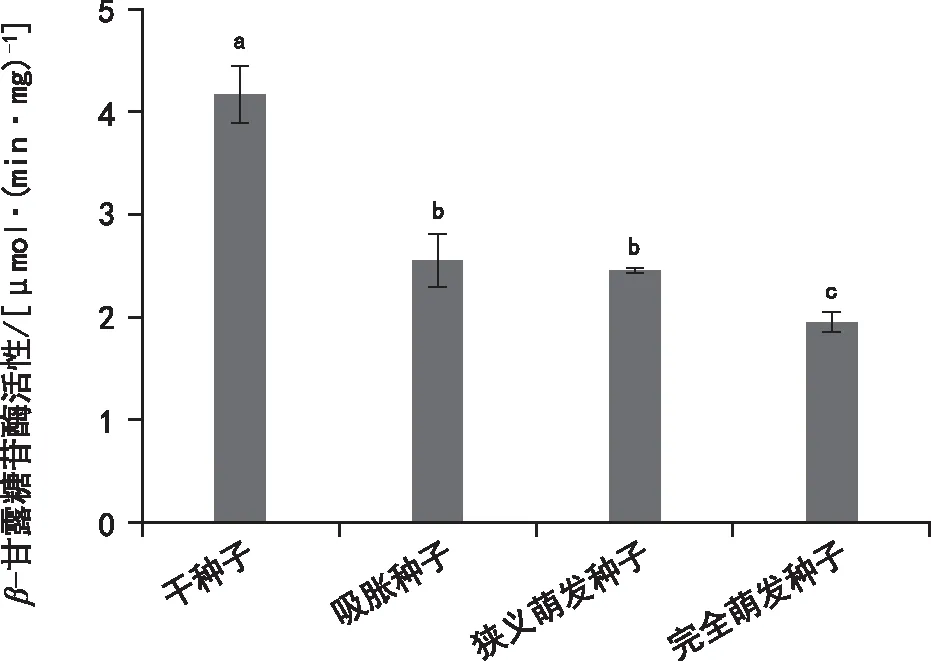
图8 莴苣种子不同萌发阶段β-甘露糖苷酶活性变化
3 结论与讨论
种子的萌发过程包含了一系列生理生化变化,其中胚根必须要先从胚乳细胞壁中突破,才可能突破种皮。很多植物种子的胚乳细胞壁都含有甘露聚糖,通常情况下它是以半乳甘露聚糖的形式存在,而半乳甘露聚糖对种子萌发时胚根的伸出具有强的机械阻力。而半乳甘露聚糖的降解需要α-半乳糖苷酶、内切-β-甘露聚糖酶和β-甘露糖苷酶的共同作用[15-16]。其中α-半乳糖苷酶是一种外多糖酶,它能水解切断半乳糖侧链和甘露糖骨架之间的α-(1→6)连接;内切-β-甘露聚糖酶是一种内切水解酶,它能将甘露糖的多聚物水解成甘露二糖或甘露三糖;而β-甘露糖苷酶可继续水解甘露二糖和甘露三糖成为甘露单糖,同时还可从寡聚甘露糖链上水解单个甘露糖残基。在这3 种酶中,内切-β-甘露聚糖酶较为关键[17],其活性在新收获的干种子中几乎检测不到,但在种子萌发过程中迅速增加。
本实验发现,莴苣干种子、吸胀种子中内切-β-甘露聚糖酶活性为0,狭义萌发种子活性有所增加,完全萌发后酶活性最高。α-半乳糖苷酶和β-甘露糖苷酶在干种子中均有一定的活性,随萌发进程的推进,内切-β-甘露聚糖酶活性和α-半乳糖苷酶活性不断增加,但β-甘露糖苷酶活性有所降低。因此,内切-β-甘露聚糖酶和α-半乳糖苷酶的活性与莴苣种子萌发密切相关。莴苣种子萌发后内切-β-甘露聚糖酶活性的迅速增加可降解胚乳细胞壁中的甘露聚糖,弱化胚乳,同时为幼苗的生长提供营养物质,从而促进种子萌发[11,18]。α-半乳糖苷酶则通过降解半乳甘露聚糖的支链半乳糖,为种子萌发的早期提供营养物质[19]。β-甘露糖苷酶活性降低,说明其对莴苣种子萌发作用小或活性表达不具生理意义[20]。
研究整个萌发过程中细胞壁降解酶活性的动态变化能更好地阐明细胞壁降解酶活性与种子萌发的关系。本实验选取四个具有典型代表性的阶段——干种子、吸胀种子、狭义萌发种子和完全萌发种子分别进行酶活性的测定。干种子即为萌发的起点,狭义萌发处理种子为即将萌发的种子,吸胀种子介于两者之间,完全萌发种子为萌发终点。测定这四个阶段的细胞壁降解酶活性变化,可较准确、真实地反映种子整个萌发过程中酶活性的变化,同时还可简化实验,节约药品。为以后研究种子萌发过程中酶活性的变化提供了一条新的思路。

