黄芩苷对大鼠类风湿性关节炎软骨损伤的影响
孙标, 邓翠翠, 王加, 刘超, 王利华
(1.宜昌市中医医院骨科,湖北宜昌 443003;2.武汉科技大学附属医院骨科,湖北武汉 430000)
类风湿关节炎(rheumatoid arthritis)是一种慢性、对称和全身性的自身免疫性关节疾病,其主要特征为滑膜增生、关节和周围组织炎症以及骨骼和软骨组织破损[1-2]。其病因不明,发病机理复杂,可导致关节破坏和畸形,使人们丧失工作能力甚至死亡。目前,类风湿关节炎的治疗策略已从使用传统的非甾体类抗炎药、糖皮质激素和疾病改良型抗风湿药变为靶向细胞因子包括肿瘤坏死因子α(TNF-α)、环氧合酶(COX)和白细胞介素(IL)等的生物靶向剂[3-4],但这些药物成本高昂且伴有严重副作用,包括免疫缺陷、肠胃不适和体液疾病等。中草药被认为是现代西药的补充疗法,其副作用低,便于抗风湿性关节炎的长期康复治疗,恰好弥补了非甾体抗炎药治疗的不足[5]。黄芩,是唇形科植物黄芩Scutelaria baicalensisGeorgi的根,味苦,性寒,无毒,有清热燥湿、泻火解毒、止血安胎的功效,用于湿温、暑温胸闷呕恶、湿热痞满、泻痢、黄疸、肺热咳嗽、高热烦渴、血热吐衄、痈肿疮毒、胎动不安等病证的治疗。黄芩苷(baicalin)是从黄芩的根部分离出来的一种黄酮类化合物,可抑制炎症、调控免疫功能[6],改善类风湿关节炎大鼠症状、减轻关节炎炎症反应,疗效较好,不良反应小[7-9]。有研究表明,Janus激酶(JAK)/信号转导转录激活因子3(STAT3)信号通路可调控炎症反应,激活该信号,可促进类风湿关节炎疾病的进展[10]。为进一步探讨黄芩苷治疗类风湿关节炎的作用机制,本研究拟观察黄芩苷对类风湿关节炎大鼠骨组织JAK/STAT3途径的调控作用,现将研究结果报道如下。
1 材料与方法
1.1 实验动物健康SPF级雌性SD大鼠40只,体质量(180±20)g,购自北京维通利华实验动物技术有限公司,动物质量合格证号:SCXK(京)2016-0011。饲养环境保持温度在25℃左右,湿度50%~70%,12 h光照,动物自由饮水,3 d换1次垫料,保持鼠笼清洁干燥。所有动物实验均根据相关的国际实验动物规则和道德准则进行。
1.2 药物与试剂黄芩苷(分子量:446.4 g/mol;分子式:C21H18O11;批号:B20570;含量≥98%)购自上海源叶生物科技有限公司。完全弗氏佐剂(complete Freund’s adjuvant,CFA)(美国Sigma公司);白细胞介素(IL)-17、IL-23、IL-10酶联免疫吸附分析(ELISA)试剂盒(美国R&D公司);抗Osx、Ⅰ型胶原蛋白α1链(Col1a1)、Dlx-2、IL-6、IL-10、β-actin等抗体(北京博奥森生物技术有限公司);抗JAK1、磷酸化JAK1(p-JAK1)、STAT3、磷酸化STAT3(p-STAT3)等抗体(上海赛信通公司);苏木素-伊红(HE)染色试剂盒、番红O染色液、碱性磷酸酶(ALP)检测试剂盒(北京索莱宝生物科技有限公司);骨钙素(osteocalcin)检测试剂盒(德国罗氏诊断有限公司)。
1.3 仪器CX23光学显微镜(日本Olympus公司);UV-1200紫外分光光度计(上海美谱达仪器有限公司);XElx800型酶标仪(美国Perkin Elmer公司);1659001型蛋白电泳仪、小型Trans-Blot转膜仪(美国Bio-Rad公司);GIS-500型凝胶成像仪(杭州米欧仪器有限公司)。
1.4 动物模型的构建与给药适应性喂养7d后,将40只SD大鼠随机分为5组,即假手术组,模型组,黄芩苷低、中、高剂量组,每组各8只。除假手术组大鼠右后足垫皮内一次性注射0.1 mL生理盐水之外,其余各组大鼠均于右后足垫皮内一次性注射0.1 mL完全弗氏佐剂诱导类风湿关节炎模型(为第1天)[11]。按照以下关节炎症状评分法,每天进行评估:正常爪,计0分;脚趾红斑,计1分;脚掌红斑和肿胀,计2分;脚踝肿胀,计3分;整个腿完全肿胀,计4分;无法弯曲,计6分。每只大鼠的关节炎指数是将4个单独爪的分数相加得出的[12]。第1~13天观察关节炎症状,当至少1只未注射的爪发炎时,则判断类风湿关节炎模型建立成功,当第10~13天,大鼠关节炎症状已达高峰。成功造模后,第14~28天,黄芩苷低、中、高剂量组每天在同一时间分别给予对应剂量为25、50、100 mg/kg的黄芩苷(溶于生理盐水配制)灌胃,假手术组和模型组给予等体积生理盐水灌胃。
1.5 观察指标与方法
1.5.1 骨小梁间距测量 给药结束后,以戊巴比妥钠(50 mg/kg)麻醉大鼠后,显微CT扫描股骨测量骨小梁间距(Tb.Sp)。
1.5.2 HE染色法观察关节组织病理变化 取大鼠踝关节组织,以10%乙二胺四乙酸(EDTA)脱钙,包埋在石蜡中,石蜡切片后用HE染色,然后在光学显微镜下观察关节组织病理变化。
1.5.3 番红O染色法观察软骨损伤情况 取膝关节,脱钙、包埋、石蜡切片后番红O染色液内浸染,分化液洗涤切片,梯度乙醇脱水,二甲苯透明,树脂封固后,在光学显微镜下观察软骨病理改变。
1.5.4 血清ALP、骨钙素的检测 按ALP检测试剂盒和骨钙素检测试剂盒说明书操作。使用紫外分光光度计检测510 nm波长处吸光度值,计算大鼠血清ALP含量;使用酶标仪检测450 nm波长处吸光度值,计算大鼠血清骨钙素含量。
1.5.5 蛋白免疫印迹法检测股骨组织Osx、Col1a1、Dlx-2、IL-6、IL-10、JAK1、p-JAK1、STAT3、p-STAT3表达 取股骨组织,提取总蛋白,用Nanodrop 2000测量蛋白质浓度并调平后,用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质,再将其转移到聚偏二氟乙烯(PVDF)膜上。接下来,用含有50 g/L脱脂牛奶的Tris-HCl缓冲盐吐温溶液(TBST)将膜封闭2 h。然后,将膜与抗Osx抗体4℃孵育过夜。TBST洗涤3次,与辣根过氧化物酶(HRP)偶联的抗体37℃孵育1 h。TBST洗涤3次,加入增强的化学发光液,应用凝胶成像仪曝光,对电泳条带灰度值进行分析。Col1a1、Dlx-2、IL-6、IL-10、JAK1、p-JAK1、STAT3、p-STAT3、β-actin等指标的检测方法同上。
1.5.6 ELISA法检测血清炎症因子IL-10、IL-17、IL-23含量 麻醉大鼠后,摘取眼球取血,静止30 min,以3 000 r/min(离心半径8.5 cm)4℃离心10 min,分离出上层血清,按照ELISA试剂盒说明书操作,应用酶标仪于波长450 nm处测定吸光度值,计算血清IL-10、IL-17、IL-23的含量。
1.6 统计方法采用SPSS 21.0统计软件进行数据分析,实验数据以均数±标准差(±s)表示,进行正态分布检验和方差齐性检验。所有数值均符合正态分布和方差齐性,多组比较采用单因素方差分析,组间比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠关节组织病理变化比较图1结果显示:假手术组大鼠滑膜和软骨组织结构正常,滑膜细胞排列整齐,软骨表面光滑,关节腔内未见渗出液,无炎性细胞浸润;模型组大鼠关节表面不平整,周围大量中性粒细胞浸润,滑膜增生肥厚,纤维组织增生,软骨及骨骼损伤;与模型组比较,黄芩苷中、高剂量组大鼠滑膜增生、炎性细胞浸润、软骨表面侵蚀和关节变性显著减轻。表明黄芩苷可显著改善类风湿关节炎大鼠软骨损伤。

图1 各组大鼠关节组织病理变化比较(HE染色,×200)Figure 1 Comparison of the pathologicalchanges in rat knee joint tissue of various groups(by HE staining,×200)
2.2 各组大鼠骨小梁间距,血清ALP、骨钙素含量的比较图2结果显示:与假手术组比较,模型组骨小梁间距增宽,血清ALP和骨钙素含量降低(P<0.05);与模型组比较,黄芩苷中、高剂量组骨小梁间距显著减小,血清ALP和骨钙素含量显著升高(P<0.05)。

图2 各组大鼠骨小梁间距,血清碱性磷酸酶(ALP)、骨钙素含量的比较Figure 2 Comparison of the trabecular bone spacing and serum contents of ALP and osteocalcin in various groups
2.3 各组大鼠软骨损伤情况及成骨标记蛋白Osx、Col1a1、Dlx2表达的比较图3结果显示:假手术组软骨基质呈红色,结构规则,基质较丰厚;模型组软骨基质蛋白多糖流失几乎不着色,缺损部位深及软骨层钙化,软骨下骨小梁结构疏松紊乱,且股骨组织中Osx、Col1a1、Dlx2表达水平均显著下调(P<0.05);与模型组比较,黄芩苷处理组尤其是高剂量组显著改善软骨损伤,软骨基质恢复充盈,结构恢复规则致密,且黄芩苷中、高剂量组股骨组织中Osx、Col1a1、Dlx2表达水平显著上调(P<0.05)。
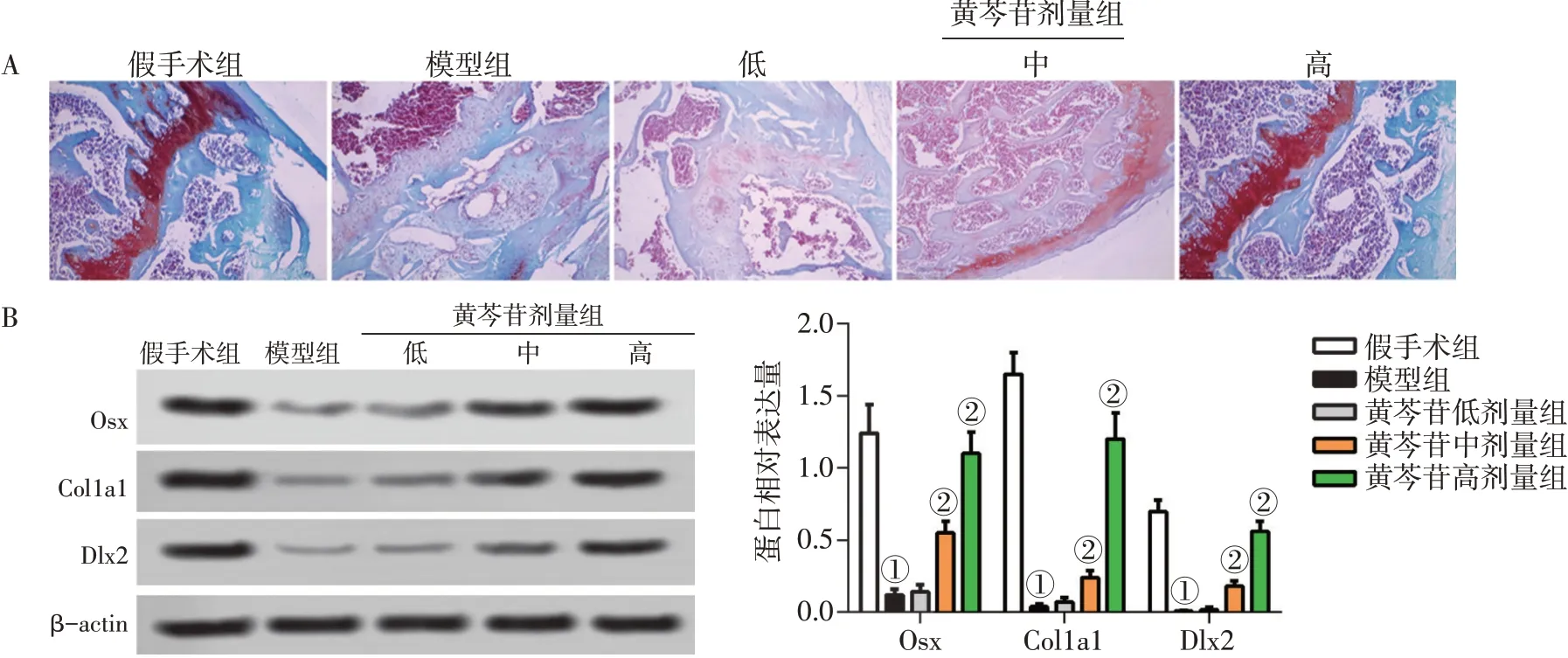
图3 各组大鼠软骨损伤情况及成骨标记蛋白Osx、Col1a1、Dlx2表达的比较Figure 3 Comparison of the cartilage damage status and expression levels of marker Osx,Col1a1 and Dlx2 of osteogenic differentiation in various groups
2.4 各组大鼠炎症因子IL-17、IL-23、IL-6、IL-10水平的比较图4结果显示:与假手术组比较,模型组大鼠血清IL-17、IL-23、IL-10含量均显著升高(P<0.05);与模型组比较,黄芩苷中、高剂量组呈剂量依赖性显著降低血清IL-17、IL-23含量,升高血清IL-10含量(P<0.05)。IL-6和IL-10蛋白表达的趋势与上述结果一致。
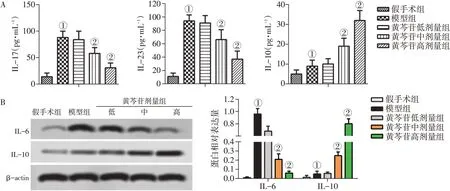
图4 各组大鼠炎症因子IL-17、IL-23、IL-6、IL-10水平的比较Figure 4 Comparison of the levels of inflammatory factor IL-17,IL-23,IL-6,IL-10 in various groups
2.5 各组大鼠股骨组织JAK1、STAT3磷酸化水平比较图5结果显示:与假手术组比较,模型组大鼠股骨组织p-JAK1/JAK1、p-STAT3/STAT3的蛋白相对表达量显著升高(P<0.05);与模型组比较,黄芩苷中、高剂量组p-JAK1/JAK1、p-STAT3/STAT3的蛋白相对表达量显著下降(P<0.05),黄芩苷低剂量组的差异无统计学意义(P>0.05)。

图5 各组大鼠股骨组织JAK1、STAT3磷酸化水平比较Figure 5 Comparison of JAK1 and STAT3 phosphorylation levels in femur tissue in various groups
3 讨论
越来越多的研究[7-9,13]表明,黄芩苷可有效治疗类风湿关节炎,但其机制尚不完全明确。完全弗氏佐剂诱发的关节炎是临床前研究中常用的动物模型,其病理特征如血管生成、炎性细胞浸润、软骨细胞降解和骨侵蚀与人类类风湿关节炎非常相似。因此,该模型被广泛用于类风湿关节炎的基础研究和抗类风湿关节炎药物的开发[14]。本研究通过在大鼠右后足垫皮内注射完全弗氏佐剂构建了类风湿关节炎模型,病理组织切片结果可见类风湿关节炎模型大鼠关节表面不平整,周围大量中性粒细胞浸润,滑膜增生肥厚,软骨及骨骼损伤,表明类风湿关节炎模型构建成功。给予黄芩苷干预后,类风湿关节炎大鼠软骨的破坏及炎症反应明显改善,滑膜增生、炎性细胞浸润和软骨破损显著减轻,表明黄芩苷对类风湿关节炎具有潜在的保护作用。
ALP和骨钙素均由成骨细胞合成分泌。ALP的活性是反映成骨细胞分化程度和功能状态的良好指标[15]。骨钙素是骨组织的特异性蛋白,目前认为血清骨钙素是反映成骨细胞功能的标志物[16]。骨小梁间距,可反映骨小梁结构形态的变化。本研究结果显示:类风湿关节炎大鼠骨小梁间距显著变宽,ALP和骨钙素含量显著降低,黄芩苷能够逆转骨小梁间距,恢复骨小梁正常结构,且能显著增加ALP和骨钙素含量。表明黄芩苷能够促进类风湿关节炎大鼠的骨分化,改善骨小梁结构。
类风湿关节炎的关节滑膜炎症和增生导致血管翳形成,进而侵犯关节软骨,最终导致骨关节畸形和功能丧失[11]。当软骨受到损伤时,软骨中的糖蛋白会释放出来,使基质成分分布不均匀,导致番红O淡染或不着色[17]。本研究番红O染色结果显示,假手术组大鼠软骨基质呈红色,结构规则,基质较丰厚,模型组大鼠软骨基质几乎不着色,表明模型组大鼠软骨基质蛋白多糖流失严重。且模型组大鼠股骨匀浆中成骨细胞分化和骨形成过程中的关键调控因子Osx、Col1a1和Dlx2表达水平均显著下调。但经黄芩苷干预后,软骨病理损伤得到显著改善,Osx、Col1a1和Dlx2表达水平显著上调,故表明黄芩苷可显著逆转类风湿关节炎大鼠软骨损伤。
有研究证实,患者血清或关节炎中促炎性细胞因子IL-6、IL-17和IL-23,抗炎性细胞因子IL-10的水平,与关节的损坏和破坏密切相关[18-19]。抑制这些促炎性细胞因子、促进抗炎性细胞因子水平对类风湿关节炎有积极的治疗作用。本研究结果显示,类风湿关节炎大鼠血清IL-17、IL-23和IL-10表达水平均显著上调,给予黄芩苷尤其是100 mg/kg剂量处理后,IL-17和IL-23表达水平显著下调,抗炎因子IL-10表达水平显著上调,表明黄芩苷通过其抗炎作用可减轻类风湿关节炎炎症反应。
JAK1/STAT3作为介导类风湿关节炎的发生及疾病进展的信号通路,可广泛参与促炎因子TNF-α和IL-6等的合成转化,在免疫炎症过程中具有重要的调节作用,抑制该信号的活化可减轻类风湿关节炎的临床症状,延缓疾病的进展[20-21],且JAK/STAT途径的选择性抑制剂CP-690550已开发用于类风湿关节炎的治疗[22]。本研究结果显示,黄芩苷能够显著降低类风湿关节炎大鼠骨组织中JAK1和STAT3的磷酸化水平,表明黄芩苷可通过抑制JAK1/STAT3通路的活性减轻类风湿关节炎。
综上所述,黄芩苷可有效改善类风湿关节炎大鼠的软骨损伤,其机制可能与其抑制JAK1/STAT3途径的活化进而抑制炎症反应,从而阻止关节炎病变进程有关。故预测黄芩苷可能成为治疗类风湿关节炎的新型药物。

