樱花‘初美人樱’品种组培技术研究
刘国华,巫建新,胡众恒
(江苏农林职业技术学院,江苏句容212499)
樱属植物在我国栽培历史悠久,樱花(Cerasuss p.)隶属于蔷薇科、李亚科、樱属,观赏乔木,树皮光滑,叶多呈卵形,两面无毛,缘有锯齿,主要分布于北半球温暖地区,为北温带植物[1-2]。近年来,樱花的组培快繁技术日益受到关注,并开展了广泛的研究,由于樱花组培苗较矮,能用于生根的苗比例少[3]。目前利用组织培养方式获得樱花苗,在外植体初代培养到继代培养过程中,均易出现污染,且污染后生长缓慢,甚至死亡[4-7]。该文采用樱花品种‘初美人樱’,此品种是开花最早的樱花新品种,先花后叶,花期2月中下旬至3月上旬,初花时粉红色,繁花满树,远望极为美观。通过对该品种进行组织培养研究,以期为樱花组培快繁技术提供理论参考。
1 材料与方法
1.1 材料
外植体选用的樱花母株选自江苏农林职业技术学院科研苗圃,品种为‘初美人樱’。于3月份晴天中午11:00选取母株健壮、无病虫害、腋芽饱满、生长情况良好的一年生枝条,剪去叶片,剪成2 c m左右带1~2个腋芽的茎段,作为外植体,并做好标签标记。
1.2 方法
1.2.1 外植体杀菌处理。将做好标记的枝条冲洗90 m in的茎段放入超净工作台中,杀菌剂浸泡,再用75%酒精浸泡50 s,0.1%升汞浸泡4 m in,无菌水冲洗3遍,其中多菌灵浓度为2 g/L,青霉素0.6 g/L,链霉素0.6 g/L(表1)。

表1 不同樱花灭菌方式
1.2.2 冷处理。通过低温冷藏的方式打破休眠,选择晴天中午采集外植体(有芽的健康茎段长度20 c m左右),将外植体放于流水下冲洗75 m in,洗衣粉浸泡5 m in,无菌水冲洗2~4次;2 g/L多菌灵浸泡10 m in,0.6 g/L链霉素浸泡6 m in,无菌水冲洗3~5次,二氯化汞0.1%浸泡3 m in,无菌水冲洗5次。外植体放入已经灭过菌的瓶中,冷藏4℃,42 d。从冰箱中取出苗,放入2%漂白粉+20滴T w een20溶液中浸泡1 m in,200 mg 8-H QC/L+20 g/L蔗糖培养液,23℃插入前茎段基部稍剪去,培养液每3~4 d更换1次,21 d后统计发芽率(用长出芽进行组培)。
1.2.3 不同激素配比对无菌外植体腋芽进行诱导。选用M S培养基,通过加入不同浓度的细胞分裂素6-B A和生长素N AA来诱导外植体的腋芽,浓度分别为:6-B A(2、1.5、1、0.5 mg/L)和N AA(0.20、0.15、0.1,0.05 mg/L)(表2),培养基中附加30 g/L蔗糖,7.0 g/L琼脂,p H 5.8~6.0。每个处理分别接种20瓶,每瓶插入2个,重复3次。
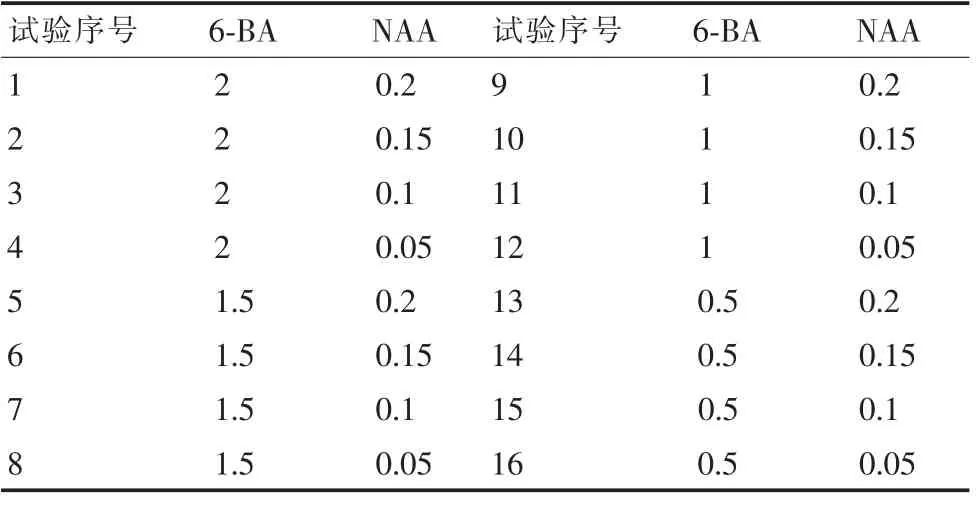
表2 腋芽诱导的植物生长调节剂配比 mg/L
赤霉素作为一种重要的植物激素,参与控制多种多样的植物发育和生理过程。赤霉素及其合成抑制剂在农作物和观赏植物上有多种用途,已发挥重要的作用[5]。赤霉素G A3是植物组织培养中常用的一种生长调节剂,能促使植物节间伸长,增加苗高[6]。在试验中加入了赤霉素,使苗增高和节间伸长(表3)。试验选用W P M培养基,樱花品种为‘初美人樱’,重复3次,取平均值进行统计。

表3 不同浓度赤霉素GA 3试验配比
1.2.4 不同激素配比对无菌苗生根的诱导。生根培养分别选用1/2M S培养基和W P M培养基,每组试验添加相同浓度的6-B A 0.8 mg/L和浓度不同的N AA和I B A(表4和表5),蔗糖20 g/L,琼脂7 g/L,每个处理接种20瓶,每瓶接种1个茎段,重复3次,28 d后观察其生根情况。

表4 1/2MS两种不同浓度激素的配比 mg/L
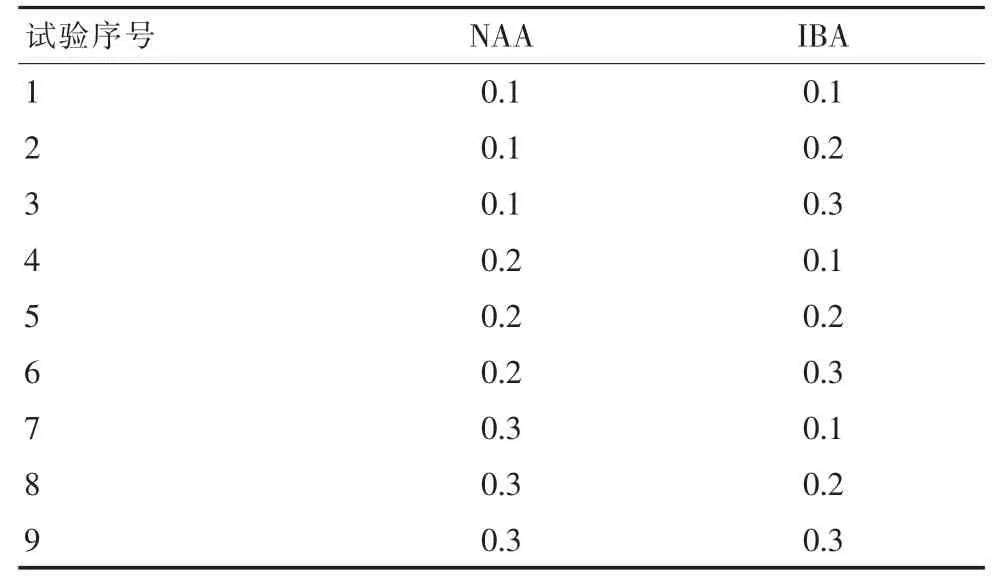
表5 WPM两种不同浓度激素的配比 mg/L
1.2.5 驯化与移栽的管理措施。将生根健壮的组培苗放入温室大棚并做好遮荫,时间为10 d。其次将准备好的基质用6 g/L的多菌灵溶液喷洒进行杀菌、晒干,移栽基质用不同比例的草炭、蛭石、珍珠岩、营养土搭配使用(表6)。

表6 不同基质混合的比例
2 结果与分析
2.1 不同杀菌剂相同处理时间对外植体污染率的影响
为了证实灭菌剂对樱花表面灭菌的效果,在试验中选择3种不同品种的樱花进行试验,并在21 d后统计污染率、褐化率、成活率。
从表7和图1可以看出,在不同搭配杀菌剂下,使用多菌灵+链霉素时污染率最低,成活率最高。
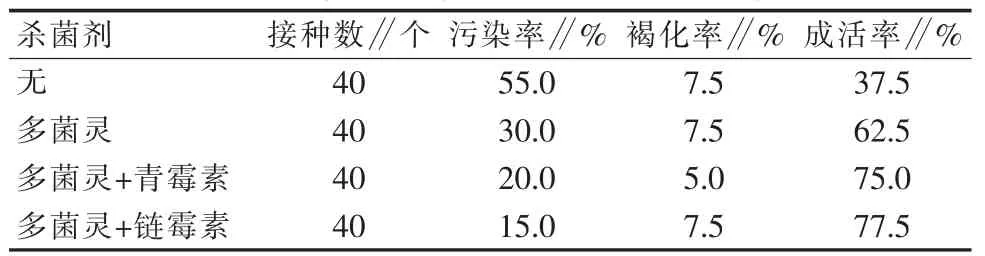
表7 不同杀菌剂对‘初美人樱’外植体的灭菌效果
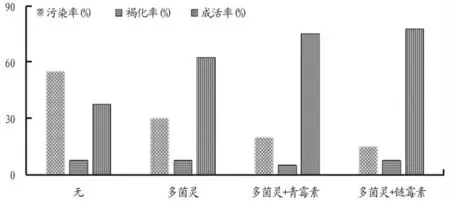
图1 不同杀菌剂对‘初美人樱’外植体的灭菌效果
2.2 使用冷处理方法对获得的苗成活率的影响
通过冷处理后,室内培养出的芽比室外生长的嫩芽更加洁净,用培养出的芽和露天采摘的芽进行试验,从表8可以看出,通过冷处理培养室培育出苗的成活率要高于露天采摘未经冷处理的苗。

表8 冷处理对‘初美人樱’成活率的影响
2.3 激素对腋芽诱导的影响
从表9可以看出,不同激素对腋芽诱导有不同反应,从表10可得6-B A浓度配比对腋芽萌发影响极显著。从表11可以看出,当6-B A浓度为2 mg/L时差异最大,萌芽率最高(图2)。

图2 腋芽萌发

表9 不同植物生长调节剂对‘初美人樱’腋芽诱导的影响
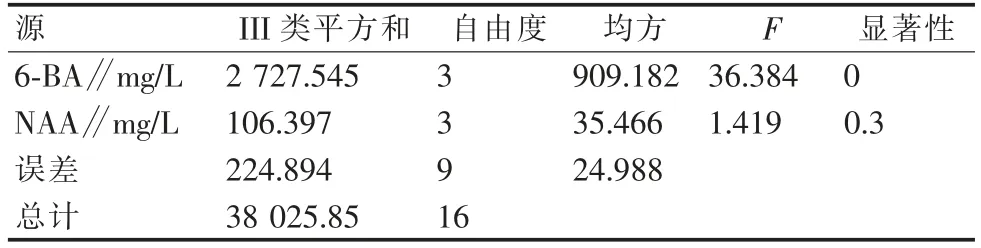
表10 不同植物生长调节剂‘初美人樱’腋芽诱导的方差分析
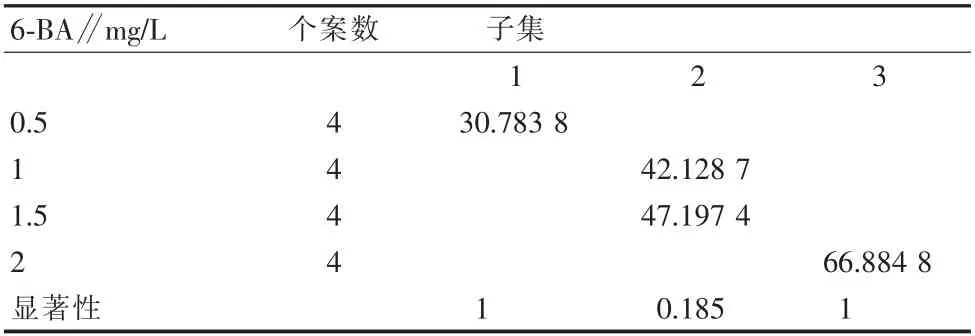
表11 不同植物生长调节剂‘初美人樱’腋芽诱导的多重比较
2.4 赤霉素(GA3)对苗茎伸长的影响
增殖培养20 d后,对生长情况进行记录(图3~图5)。从表12可以看出,当赤霉素浓度为0.02 mg/L时,生长情况最好,茎段高度可达36 mm,茎伸长明显。

图3 生长健壮苗

图4 添加赤霉素GA3茎伸长苗

图5 无赤霉素GA3茎无明显伸长苗
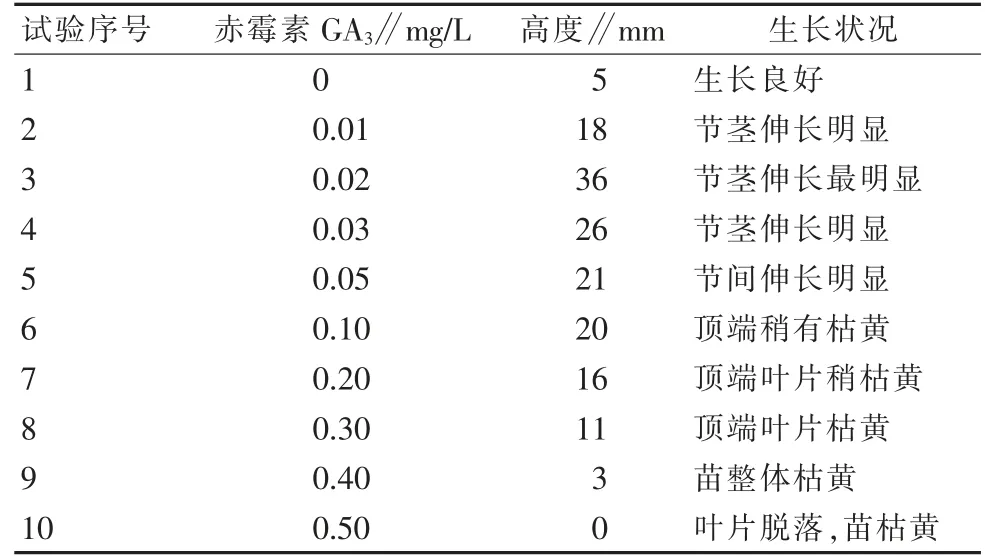
表12 不同浓度GA 3对樱花茎伸长影响
2.5 不同浓度的生长激素配比对生根效果的影响
从表13和表14可以看出,在生长调节剂浓度相同时,W P M培养基更适合‘初美人樱’的生根培养。从表14和表15可以看出,I B A和N AA对组培苗的生根影响都较显著。从表16可以看出,当I B A为0.1 mg/L时,根系较长且生根健壮,平均生根率可超过60%。

表13 1/2MS培养基不同植物生长调节剂对‘初美人樱’生根的影响
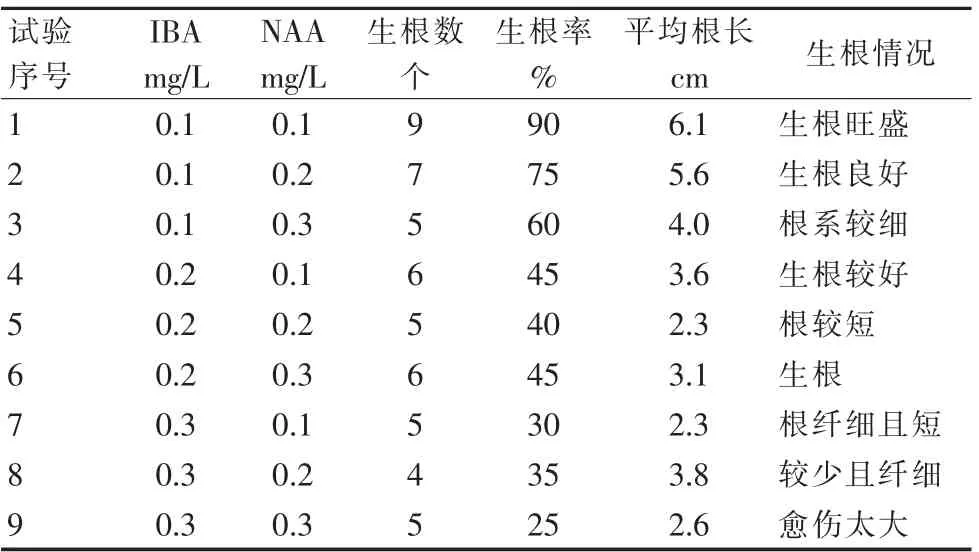
表14 WPM培养基不同植物生长调节剂对‘初美人樱’生根的影响
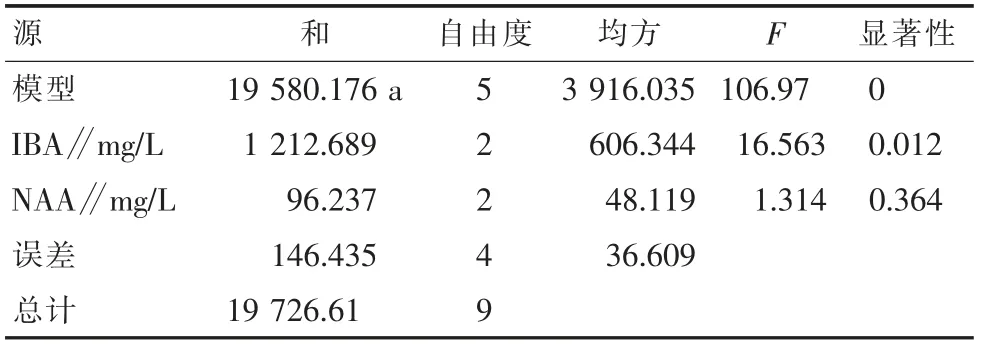
表15 WPM培养基不同植物生长调节剂对‘初美人樱’生根率影响的方差分析
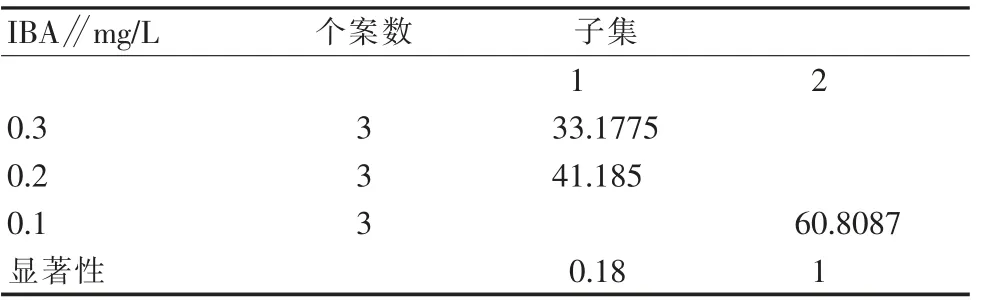
表16 WPM培养基不同植物生长调节剂对‘初美人樱’生根率影响的多重比较
2.6 不同的基质对后期驯化与移栽效果的影响
生根培养40 d后,将组培苗拿到花房进行驯化(表17,图6),纯营养土的栽培成活率最低为15%,最佳移栽基质为营养土∶草炭∶蛭石(1∶1∶1),成活率达80%。
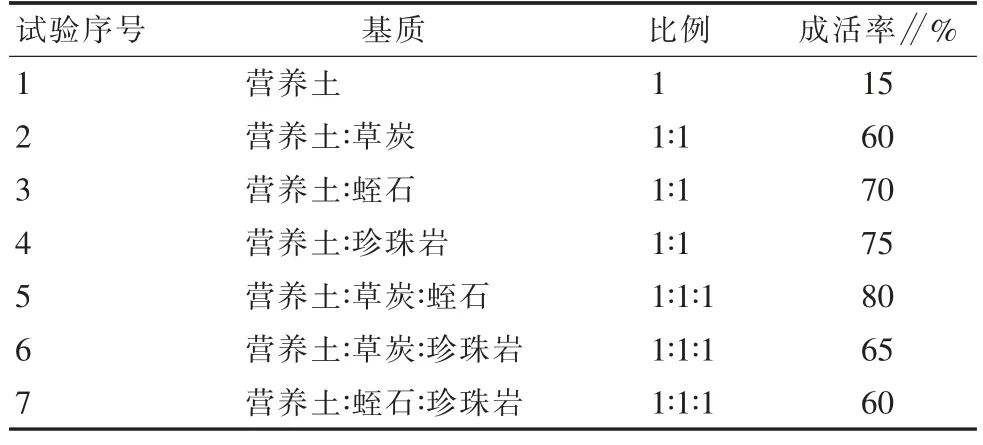
表17 不同基质的移栽成活率
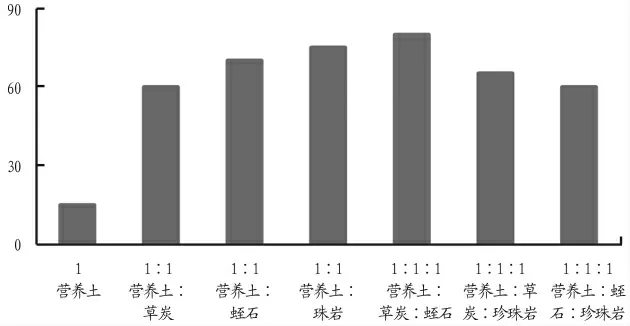
图6 不同基质的移栽成活率
3 结论与讨论
(1)通过试验发现多菌灵2 g/L搭配链霉素0.6 g/L溶液可有效降低樱花在组织培养中的污染率,污染率低至20%。
(2)使用冷处理获得芽的方式可以使污染率下降低至5%。当赤霉素浓度逐渐增大时,对苗具有明显的抑制作用,甚至导致苗的死亡。
(3)生根培养时,当I B A和N AA浓度都为0.1 mg/L时生根效果最佳,最高生根率可达90%,这可能与木本植物体内的多酚类物质被氧化有关,在培养基中添加活性炭、维生素C等能够有效解决樱花的褐化现象,降低培养基中无机盐浓度也取得了很好的效果[10]。建议‘初美人樱’最佳的移栽基质为营养土∶草炭∶蛭石(1∶1∶1)的混合基质。

