胆酸诱导急性肺损伤小鼠模型的建立和评价
孙昂然刘嘉豪陈星君李梦春文成刚高敏胡章雪*
(1.陆军军医大学大坪医院,重庆 400042;2.96961部队卫生队,北京 102206;3.陆军军医大学基础医学院生物化学与分子生物教研室,重庆 400038)
胎儿将胎粪污染的羊水误吸入肺所引起的急性肺损伤(acute lung injury,ALI)是新生儿重症研究的一个重要问题[1],然而胎粪中的重要成分胆酸,是否在ALI中发挥关键作用,尚无直接证据。胆酸作为一种重要的致炎因子[2],主要用于重症胰腺炎动物模型的构建[3],但能否诱导动物的肺损伤,尚无报道。本实验旨在利用胆酸构建小鼠的肺损伤模型,为探究胆酸诱发新生儿肺损伤的分子机制提供基础和依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
54只6~8周C57BL/6清洁级野生型小鼠。雄鼠18只,体重(26.0±1.8)g;雌鼠36只,体重(19.3±2.4)g,购于斯贝福(北京)生物技术有限公司【SCXK(京)2019-0010】。饲喂设施由陆军特色医学中心提供【SYXK(军)2017-0057】,饲养条件:(22±2)℃,昼夜各半循环照明,自由采食饮水,饲养7 d后开始实验。所有操作均符合陆军军医大学实验动物福利伦理审查委员会伦理学要求(审批号:AMUWEC 20201510)。
1.1.2 主要试剂与仪器
胆酸(Sigama,CAS:81-25-4);DMSO溶液(Solarbio,CAS:D8371);PBS溶液(Hyclone,CAS:SH30256.01);4%多聚甲醛固定液(碧云天,CAS:P0099);HE染色剂(碧云天,CAS:C0105);鼠TNFαELISA试剂盒(碧云天,CAS:PT512);鼠IL-1β ELISA试剂盒(碧云天,CAS:PI301);血气分析测试卡片(Abbott Point of Care Inc,CAS:03P88-25)。
小动物X光机(faxitron X-ray,MX-20,美国);手术器械(碧云天);电子天平(北京赛多利斯)。
1.2 方法
1.2.1 药品制备
胆酸以DMSO溶解,再用PBS稀释,使其终浓度为5 mmol/L。
1.2.2 动物分组
按照给药方法×药物(3×3)析因设计分组小鼠。给药方法分为:气管切开、鼻滴1 d,鼻滴6 d。药物为胆酸,并且设置其对应的溶剂对照DMSO组和空白对照PBS组,共9组,每组6只(雌鼠4只,雄鼠2只)。如表1所示。鼻滴给药处理的频率为每天1次,其中鼻滴1 d是指鼻滴给药处理1 d,鼻滴6 d是指鼻滴给药处理连续6 d,并且两次鼻滴间隔时间为24 h。

表1 给药方法×药物(3×3)析因设计小鼠分组Table 1 Administration method×drug(3×3)factorial design mice group
1.2.3 动物模型制备
气管切开灌肺模型:腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉小鼠。待小鼠肌肉松弛,四肢无活动后,充分暴露小鼠气管,在软骨间环状韧带处用眼科角膜剪剪开直径约2 mm开口,用微量加样枪灌注胆酸(0.1 mmol/kg),再推入1 mL空气,最后缝合。同理分别灌注溶剂对照DMSO组和空白对照PBS组。
鼻滴胆酸入肺模型:麻醉后,胆酸经鼻滴入小鼠(5μmol/kg)。鼻滴持续时间1~2 min。溶剂对照DMSO组和空白对照PBS组的动物,其处理方式同胆酸组。
1.2.4 一般体征观察
处置完成后,小鼠回笼饲养,给予充足的水和饲料,观察其饮食、活动等一般情况。连续鼻滴6 d的小鼠,每日称量体重,以粗略判断其健康状况。
1.2.5 样品检测
(1)胸部X线检查:小动物X光机参数设置:曝光时间18 s,管电压26 kV。
(2)血氧分压检测:麻醉后,打开小鼠胸腔,用肝素化的1 mL空针在心尖搏动出穿刺抽取0.15 mL血液,将血气标本注入血气测试卡片中检测血氧分压(blood oxygen partial pressure,PO2)。
(3)观察肺组织的大体改变:离体肺组织以PBS溶液冲洗后,观察肺叶出血、水肿情况,组织表面斑块、颜色并拍照。
(4)观察肺组织病理学变化:取右肺上叶,经4%多聚甲醛固定、常规石蜡包埋、切片和HE染色,再用光学显微镜观察小鼠肺组织的病理变化。
(5)ELISA法检测小鼠肺组织中TNF-α和IL-1β的含量:取一部分组织提取蛋白,经ELISA检测炎症因子TNF-α和IL-1β的含量。操作严格按照试剂说明进行,用酶标仪测定OD值后再计算试剂样品的浓度。
1.3 统计学分析
将血氧分压值、TNF-α和IL-1β的含量分别作为计量资料。对血氧分压结果采取3×3析因设计资料方差分析和单因素方差分析,对TNF-α和IL-1β的含量采取3×3析因设计资料方差分析。P<0.05则表示差异有统计学意义。用SPSS 20.0软件进行分析,用GraghPad Prism 8.0.1绘制统计分析图。
2 结果
2.1 一般体征观察
9组小鼠完成给药后全部存活。气管切开胆酸组与其溶剂对照DMSO组,或者与其空白对照PBS组相比,小鼠蜷缩,活动和饮食减少。胆酸鼻滴1 d组与其相应的溶剂对照DMSO组或空白对照PBS组相比,小鼠活动和饮食情况正常。胆酸鼻滴6 d从第4天开始,活动和饮食减少;溶剂对照DMSO组和空白对照PBS组小鼠,从第5天开始活动和饮食减少。胆酸鼻滴6 d组及其溶剂对照DMSO组和空白对照PBS组,3组小鼠体重均下降(如图1所示),但鼻滴结束时,各组间比较,均无显著性差异(P>0.05),说明3组小鼠营养状况相似。
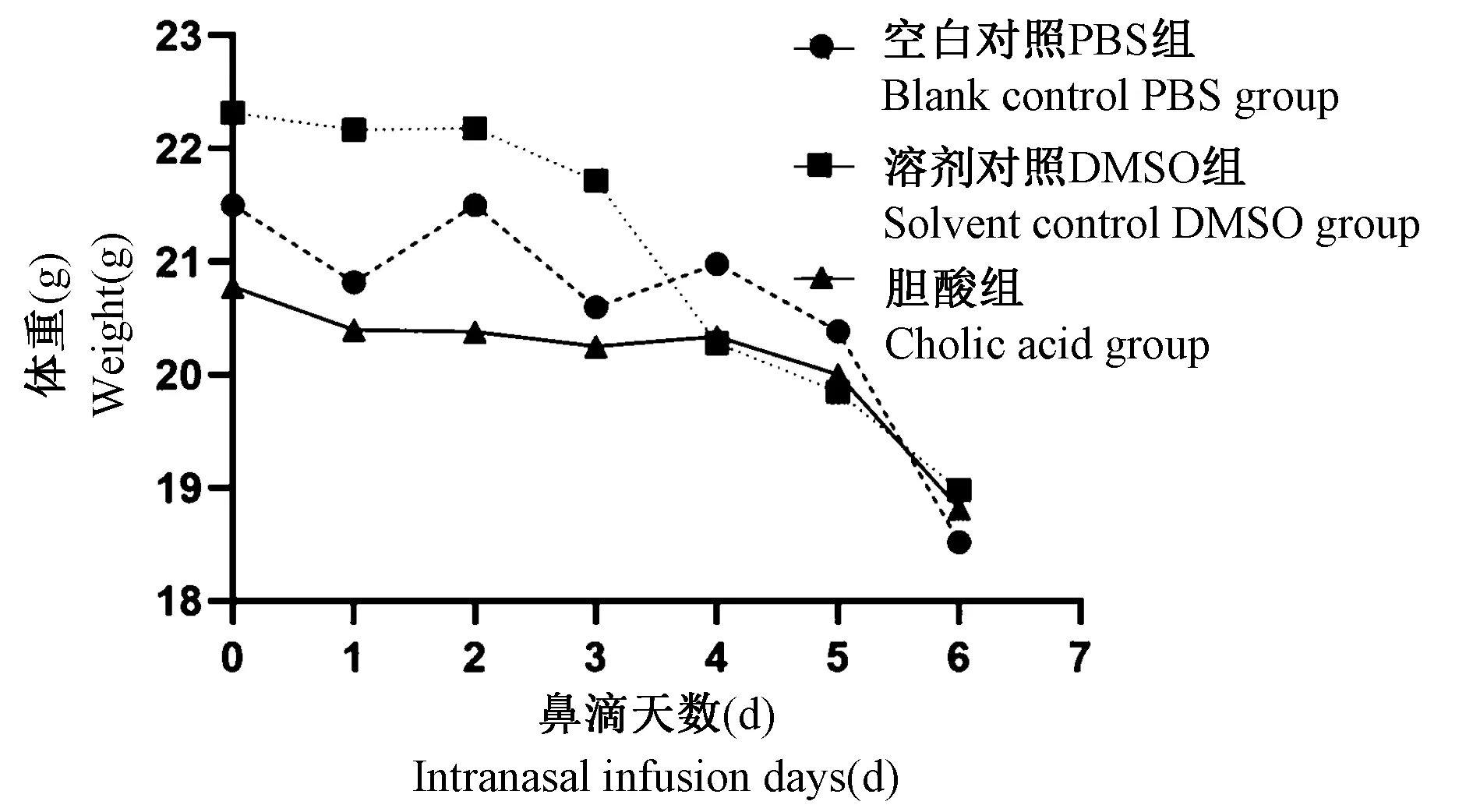
图1 小鼠体重的变化Figure 1 Alteration in mice body weight
2.2 小鼠胸部X线片
气管切开胆酸组与空白对照PBS组、溶剂对照DMSO组相比,肺纹理增多、肺野透光度降低,呈毛玻璃样改变,但未见心影增大、支气管充气(如表2,图2 a、b、c所示)。鼻滴1 d除胆酸组中有2例肺纹理增多,其余均未见异常(表2,图2 d、e、f所示)。鼻滴6 d胆酸组,有3例肺纹理增多,伴有毛玻璃样改变和散在小斑片样阴影,溶剂对照DMSO组中,有2例肺纹理增多(如表2,图2 g、h、i所示)。

图2 不同处理后小鼠出现肺弥漫性浸润表现的情况Figure 2 X-ray of diffuse lung infiltration in mice after different treatments

表2 不同处理后小鼠肺出现弥漫性浸润的例数Table 2 Number of cases of diffuse infiltration of mouse lungs after different treatments
2.3 肺组织大体观察
气管切开手术处理的小鼠中,空白对照PBS组的小鼠肺表面未见局灶性出血(图3a),但是胆酸组和溶剂对照DMSO组中,均可见肺局灶性出血(图3b、c)。鼻滴1 d处理的小鼠中,胆酸组、溶剂对照DMSO组和空白对照PBS组均未见肺局灶性出血(如图3 d、e、f所示)。鼻滴6 d处理的小鼠中,胆酸组、溶剂对照DMSO组和空白对照PBS组的肺表面均有广泛出血(如图3 g、h、i所示)。
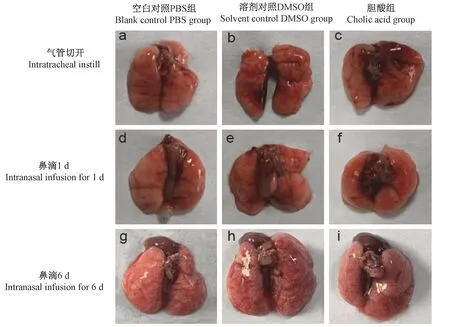
图3 不同处理后小鼠肺大体样本出血表现的情况Figure 3 Bleeding manifestations of mouse lung gross samples after different treatments
2.4 血氧分压检测
以血氧分压(PO2)作为测量指标进行析因分析。首先分析药物因素单独效应,胆酸组显著低于空白对照组(P<0.001)和溶剂对照组(P<0.05),说明胆酸可以诱导PO2降低(如表3所示)。再分析手术方法(包括气管切开、鼻滴1 d和鼻滴3 d)的单独效应,气管切开组与鼻滴1 d组或者鼻滴6 d组相比,均无统计学差异(P>0.05),但是鼻滴6 d组与鼻滴1 d组相比较,PO2显著降低(P<0.01),说明较长时间鼻滴(6 d)比短时间鼻滴(1 d)更加影响血氧分压(如表4所示)。

表3 药物因素单独效应各药物组间PO2比较Table 3 Comparison of PO2 between drug groups in individual effects of drug factors
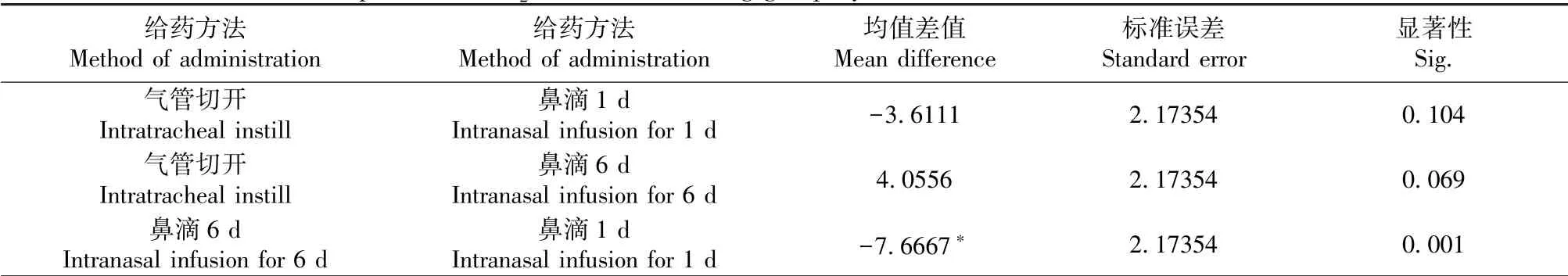
表4 给药方法因素单独效应各药物组间PO2比较Table 4 Comparison of PO2 between each drug group by factors of administration method alone effect
在析因分析后,对3种给药方式分别进行单因素方差分析。在气管切开小鼠中,胆酸组显著低于空白对照组(P<0.001)和溶剂对照组(P<0.01),说明气管切开手术条件下再灌注胆酸能有效降低血氧分压。鼻滴1 d时,胆酸组与其溶剂对照组和空白对照组相比,均无统计学差异(P>0.05),说明鼻滴1 d胆酸不能造成小鼠的肺损伤。鼻滴6 d胆酸组与其溶剂对照组和空白对照组相比,均有降低,但无统计学差异(P>0.05)(如图4)。

图4 不同给药方法分别进行药物组间比较血氧分压情况Note.Compared with cholic acid group,**P<0.01,***P<0.001.Figure 4 Compare the blood oxygen partial pressure between the drug groups with the drug groups with the different admistration methods
2.5 肺组织病理观察
气管切开手术的3组小鼠中,胆酸组与其溶剂对照DMSO组或空白对照PBS组相比,肺泡腔结构破坏、出血和肺泡壁增厚(如图5 a、b、c)。鼻滴1 d的3组小鼠中,胆酸组表现为散在的局灶性出血,但肺泡结构和肺内血管并无显著改变(如图5 d、e、f所示)。鼻滴6 d的3组小鼠中,胆酸组的肺泡壁有明显的增厚,肺泡壁破坏严重,血管周围和肺间质的炎细胞浸润(如图5 g、h、i所示)。

图5 不同处理方法对小鼠肺病理学的影响(HE染色)Figure 5 Effects of different treatment methods on lung pathology in mice(HE staining)
2.6 肺组织中TNF-α和IL-1β检测
以TNF-α和IL-1β作为测量指标进行析因设计。首先分析药物因素单独效应,胆酸组TNF-α,IL-1β显著高于空白对照组(P<0.001)和溶剂对照组(P<0.001)(如表5、6所示)。接着分析给药方法单独效应,鼻滴1 d的小鼠,其TNF-α和IL-1β显著低于气管切开小鼠(P<0.001)和鼻滴6 d的小鼠(P<0.001),但是气管切开小鼠和鼻滴6 d小鼠之间无统计学差异(如表7、8)。最后分析给药方法和药物是否存在交互作用。由于气管切开且灌注胆酸的小鼠,其TNF-α含量(138.07±15.02 pg/mL)和IL-1β(232.06±45.89 pg/mL)含量均高于其它各组,析因分析显示出给药方法和药物之间存在交互作用(如图6所示)。
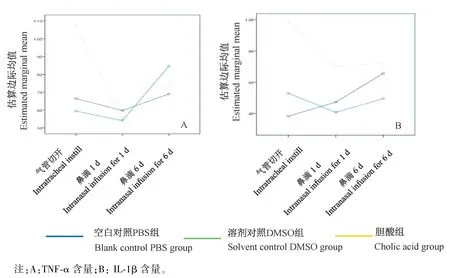
图6 给药方法与药物之间的交互效应Note.A.TNF-αcontent.B.IL-1βcontent.Figure 6 Interaction between drug delivery method and drug

表5 药物因素单独效应各药物组间TNF-α含量比较Table 5 Comparison of TNF-αcontent among different drug groups in individual effects of drug factors

表6 药物因素单独效应各药物组间IL-1β含量比较Table 6 Comparison of IL-1βcontent among different drug groups in individual effects of drug factors
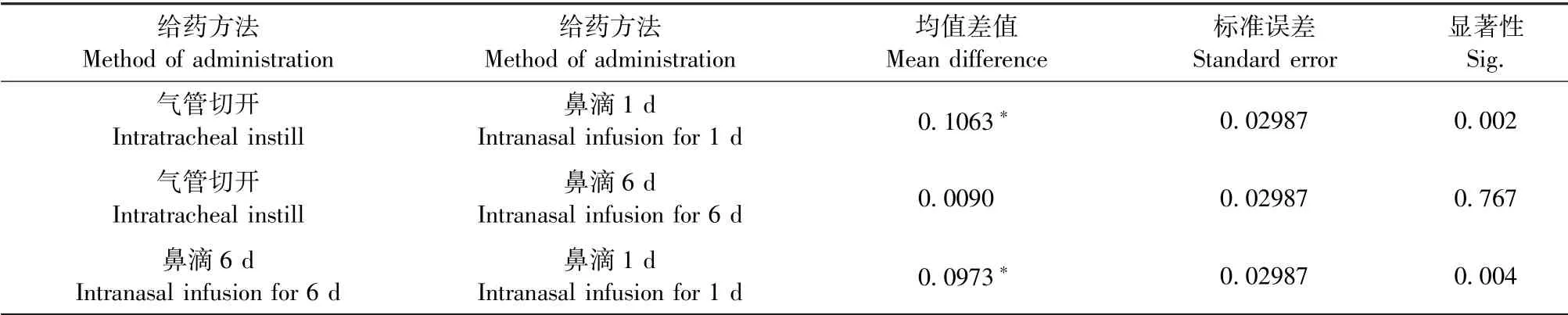
表8 给药方法因素单独效应各药物组间IL-1β含量比较Table 8 Comparison of IL-1βbetween each drug group by factors of administration method alone effect
3 讨论
急性肺损伤(acute lung injury,ALI)是一种常见的新生儿重症,而胎儿将胎粪污染的羊水误吸入肺所造成的ALI可进一步引发严重的并发症,危及胎儿生命。胎粪的成分复杂,包括胆酸、胆酸盐、胆固醇及其前体、脂质、胰磷脂酶A2、超多糖及蛋白质等[4-5]。胆酸是一种强烈的致炎因子,用于重症胰腺炎动物模型的构建[3]。模型中胆酸可以引起肺损伤[6],从而提示,如果用胆酸刺激肺,肺表现的炎性损伤可能会与胎儿的胎粪吸入所造成的ALI具有一定的相似性。
根据美国胸科协会对急性肺损伤动物模型的判断标准,只要具备组织损伤证据、肺泡毛细血管屏障改变的证据、炎症反应证据和生理功能障碍证据中的至少三项[7-8],即为ALI动物模型造模成功。目前,ALI动物模型主要分为直接和间接损伤两大类:直接肺损伤模型包括盐酸吸入模型、脂多糖[9]或油酸[10]注射模型、机械通气模型[11]以及病毒感染模型等;间接肺损伤模型包括内毒素模型、烧伤/烟雾吸入模型、输血模型、缺血-再灌注模型及胰腺炎模型等。但是这些模型不能模拟胎儿吸入胎粪引起的ALI。目前未见以胆酸直接刺激肺构建的ALI的模型。如果建立以胆酸灌注入肺诱发急性肺损伤(ALI)的动物模型,则能为探讨新生儿胎粪吸入所诱发的急性肺损伤机制奠定基础。
本实验把胆酸通过气管切开、鼻滴1 d和鼻滴6 d的方式给予小鼠。鼻滴法给药多用于临床治疗,也用于诱发肺炎的相关实验[12-13]。鼻滴胆酸6 d的小鼠,X胸片、组织病理变化、血氧分压、炎性因子TNF-α和IL-1β等各项指标都反映出其肺部炎症比鼻滴胆酸1 d的小鼠更加严重,表明重复鼻滴给药造成的肺损伤更加严重。鼻滴胆酸6 d的小鼠相对于其溶剂对照组和空白对照组,胸片、TNF-α和IL-1β的改变不及组织病理的变化,原因可能是小鼠肺损伤炎症性渗出期在24~48 h[7,13],TNF-3和IL-1β释放高峰在损伤后2 h和24 h[14],组织病理改变晚于炎症损伤,但是拍摄胸片和采集肺组织样本是在鼻滴6 d后,可能错过了肺部炎性渗出的峰值期和TNF-α和IL-1β释放的高峰期,故胸片只有轻微的弥散性浸润,TNF-峰含量胆酸组甚至低于溶剂对照组。如果能够连续拍摄X胸片和采集肺组织样本,检测炎性相关指标,则能提供一个更加合理的给药时间,有利于构建鼻滴胆酸诱导ALI的动物模型。
鼻滴6 d是连续刺激肺组织造成损伤。鼻滴6 d的3组小鼠,X胸片、大体样本、血氧分压指标都发生了明显的肺损伤,提示6 d的重复鼻滴给药的方式是造成肺损伤的重要原因。鼻滴引起小鼠的呛咳,使滴入物进入肺组织引发炎症反应,即使胆酸有致炎效应,也可能被鼻滴掩盖,所以鼻滴胆酸组与鼻滴DMSO组或鼻滴PBS组之间,除肺病理组织损伤一项证据,其余各项指标没有明显差异,说明鼻滴6 d胆酸不能有效诱导小鼠的ALI模型。如果要采用鼻滴造模,则要调整鼻滴药物的剂量和时间以取得其他相关实验证据。
本研究还通过气管切后再灌注胆酸以诱导形成ALI的动物模型。相较鼻滴滴入,气管切开后药物直接抵达肺组织,呛咳排出的药物体积较小,可以准确计量灌注剂量。并且,胆酸只作用于肺,不进入消化道,作用器官单一。气管切开再灌注胆酸的小鼠,其X线胸片、组织病理变化、血氧分压、TNF-α和IL-1β各项指标,较其溶剂对照组和空白对照均有显著改变,具备了组织病理、炎症反应和生理功能障碍这三项实验证据,证明气管切开确实能成功诱导ALI,形成胆酸诱导的ALI动物模型。
4 结论
本实验探讨了胆酸诱导小鼠急性肺损伤模型的构建,结果表明,气管切开灌注胆酸构建急性肺损伤小鼠模型周期短,药物剂量可控,重复性好,是一种相对可靠的构建方法。该模型的建立将为探究胆酸诱发新生儿肺损伤的分子机制提供基础和依据。

