纳米缓释丁酸钠对草鱼生长性能、血清生化指标、肠道黏膜形态及PepT1基因表达的影响
唐建洲 曹申平 瞿符发 彭 亮 刘 臻 侯德兴 贺 喜
(1. 湖南农业大学动物科技学院, 长沙 410128; 2. 长沙学院生物与环境工程学院, 水生动物营养与品质调控湖南省重点实验室, 长沙 410022)
随着草鱼(Ctenopharyngodon idella)养殖向规模化和集约化模式的发展, 其对饲料的需求量逐年增加, 而由于鱼粉价格的不断攀升, 饲料厂家往往采用价格低廉的植物性蛋白替代鱼粉来降低生产成本, 如豆粕、菜粕和棉籽粕等。植物蛋白源替代鱼粉可有效节约饲料成本, 同时, 还可以缓解鱼粉供给侧紧张, 减少因鱼粉需求增加而导致过度捕捞带来的一系列渔业资源破坏和生态失衡等问题[1]。一般来说, 随着植物性蛋白源替代比例升高, 养殖动物对饲料利用能力降低, 当植源性原料大量使用时还会引起鱼类肠道炎症, 严重则会造成鱼类死亡。研究表明, 植源性原料的一个重要危害就是其所含有的抗营养因子能损伤鱼类小肠绒毛细胞, 造成水产动物的肠道损伤[2]。另外, 由于鱼类对植物性饲料的利用率不高, 未消化吸收的营养物质直接排到水域环境, 造成水中氨氮过高, 水体富营养化,养殖水域环境严重污染[3]。丁酸钠是一种重要的饲料添加剂, 其能被肠道快速吸收, 具有促进肠道细胞增殖和成熟, 维持肠黏膜完整性, 促进小肠对营养物质的消化吸收的作用[4,5]。在仔猪(Sus domesticus)[6,7]和雏鸡(Gallus gallus domesticus)[8]中的研究发现, 丁酸钠能降低动物的饵料系数, 提高其增重率。同时, 还能够调节动物肠道内微生物的生态平衡, 提高机体自身抗免疫力[9,10]。在水产动物饲料中丁酸钠的应用也有相关报道。研究表明, 其对西伯利亚鲟(Acipenser baeri)[11]和南美白对虾(Litopenaeus vannamei)[12,13]的生长性能具有显著的促进作用, 但是有关丁酸钠对水生动物肠道蛋白质及小肽吸收转运影响的研究却鲜有报道。丁酸钠的活性成分是丁酸, 而丁酸具有挥发性和难闻的酸臭味,在应用中, 为了克服这些缺点并达到其在饲料投喂过程的增产等效果, 一般会采用包膜技术将丁酸钠进行各种包膜处理, 达到定点和延时释放的目的[14]。本研究拟在草鱼饲料中添加不同剂量的纳米缓释丁酸钠(专利号: ZL2016103275999), 利用养殖生长实验, 探讨纳米缓释丁酸钠对草鱼生长性能、血清生化指标、肠道上皮细胞的增殖及PepT1基因表达的影响, 从而为纳米缓释丁酸钠在草鱼饲料中的生产应用提供理论依据。
1 材料与方法
1.1 实验饲料
参照草鱼营养需求, 配制6种等氮等能的基础饲料, 在草鱼基础饲料中分别添加纳米缓释丁酸钠,添加量为0、0.10%、0.20%、0.40%、0.60%和0.8%。豆粕和鱼粉等大颗粒饲料原料经粉碎机粉碎后过40目筛筛选, 确保原料粉碎充分、均匀。原料的混合采用逐级放大法进行混合, 先将微量组分充分混合均匀后, 再添加大宗原料豆粕和大米蛋白等, 最后与鱼油和水充分混合, 采用SLX-80型(上海饲料机械制造有限公司)颗粒饲料机制粒, 粒径为2.5 mm, 晾干备用。实验饲料配方见表1。

表1 饲料配方及生化组成(%干物质)Tab. 1 Formulation and chemical composition of feed (% dry matter)
1.2 动物饲养与管理
实验用草鱼由湖南省水产科学研究所(湖南,长沙)提供, 养殖实验在长沙学院网箱养殖基地进行, 网箱规格为长200 cm×宽200 cm×深250 cm, 每个网箱内饲养50尾初始体重为(18.65±0.21) g, 大小规格一致的草鱼, 喂食60d, 实验共6个处理, 每个处理设3个重复, 以不添加丁酸钠组为对照组; 其他为处理组, 分别编号0.1%组、0.2%组、0.4%组、0.6%组和0.8%组。每天于8: 30、12: 30和16: 30投喂, 共投喂3次, 投喂量随鱼体质量而增加, 第一周投喂量为鱼体质量的5%, 以后每周增加1%, 在自然条件下养殖。每天记录天气状况、水温变化状况、投喂量和摄食状况。
1.3 样品采集与分析
生长性能指标在养殖实验结束后, 实验鱼禁食24h, 分别称量每网箱鱼的总体重并记录鱼总数量, 按照公式分别计算每个处理组的草鱼平均体重、成活率、增重率、蛋白质效率和特定生长率。每个网箱随机取出6尾实验鱼, 分别测量其体重和体长, 按照公式计算肥满度。计算公式如下:
成活率(SR, %)=终末尾数/初始尾数×100;
增重率(WGR, %)=(末均体重–初均体重)/初均体重×100;
蛋白质效率(PER)=体增重/(摄食量×饲料蛋白质含量);
特定生长率(SGR, %/d)=(ln末均体重–ln初均体重)/实验天数×100;
肥满度(CF, g/cm3)=体重/体长3×100。
饲料常规营养成分测定实验饲料中的粗蛋白、粗脂肪和灰分的测定参照AOAC(2003)标准方法: 采用凯氏定氮仪(2300, Kjeltec Analyzer Unit)测定粗蛋白; 粗脂肪采用索氏抽提仪(SoxtecSystem HT6, Tecator, Hoganas, Sweden)进行测定; 灰分在马弗炉中550℃煅烧3h, 采用失重法测定。
前肠的分离及黏膜形态测定和PepT1基因表达量的测定每个重复随机取6尾鱼, 分离前肠, 用4%多聚甲醛溶液进行固定, 石蜡切片, 并用HE染色法染色, 普通光学显微镜观察拍照, 并在40倍镜下随机选取10根生长平直、舒展和完整的绒毛, 测量绒毛高度及隐窝深度, 并计算绒毛高度/隐窝深度的比值。每个重复另取6尾鱼, 冰上解剖并分离前肠, 6尾鱼肠道组织合为一个样品, 迅速投入液氮中保存待用。
血清生化指标测测定在养殖结束后每个网箱随机取6尾鱼, 尾静脉采取血液, 采血过程中注意轻拿轻放, 防止溶血现象的发生, 全血放入4℃冰箱, 次日用Eppendof5804R台式离心机, 4℃, 4000 r/min离心10min, 上层血清–80℃保存待测。用日立7170A型自动生化测定仪检测血清总蛋白、谷草转氨酶、谷丙转氨酶和尿素氮等指标。
血清游离氨基酸的测定血清采集方法同上, 吸取100 μL血清样品加入100 μL预冷的乙腈,旋涡振荡混匀, 放入4℃冰箱中20min, 沉淀蛋白质,12000 r/min离心10min, 取上清100 μL, 加入50 μL PITC衍生剂和50 μL三乙胺, 室温避光衍生1h后12000 r/min离心10min, 上清中加入等体积的正己烷振荡混匀后静置15min, 去除过剩的衍生剂, 取下层液, 采用高效液相色谱柱法测定血清中游离氨基酸。
荧光定量引物设计及合成以GenBank中草鱼PepT1基因为依据, 用Primer Premier 5.0软件设计荧光定量PCR引物, 并设计草鱼管家基因βactin引物作为内参引物, 引物由长沙擎科生物科技有限公司合成。β-actin上游引物: 5′-GAACACTGT GCTGTCTGGAGGTA-3′, 下游引物: 5′-CTTGGGTT GGTCGTTTGAATC-3′; PepT1上游引物: 5′-TGCT CTTGTTGTGTTCATCG-3′, 下游引物: 5′-CTCTCTC TTGGGGTATTGCTT-3′。
前肠总RNA提取及cDNA第一链的合成取出肠道组织, 在研钵中用液氮研磨, 按照OMEGA公司EZNATMTotal RNA KitⅡ的操作说明提取RNA, 并消化去除DNA; cDNA第一链的合成: 按照Fermentas公司RevertAidTMFirst Strand cDNA Synthesis Kit试剂盒方法进行反转录合成cDNA第一链, –20℃保存备用。
肠道PepT1基因表达水平的分析参考Kenneth等[15]的报道, 采用荧光定量PCR方法测定PepT1基因在肠道中的相对表达量, 按照TaKaRa公司SYBR®Premix ExTaqTMⅡ试剂盒反应体系, 在Thermofisher公司Quant Studio 3 Real-Time PCR System实时荧光定量PCR仪上进行荧光定量分析。反应体系如下: SYBR Premix ExTaq12.5 μL、上游引物0.5 μL、下游引物0.5 μL、cDNA 2 μL, 用ddH2O补齐体积至25 μL, 每个样品重复3次。反应程序: 95℃预变性30s, 95℃变性3s、55℃退火25s、72℃延伸11s共40个循环。根据扩增曲线得出Ct值,用公式2–ΔΔCt[ΔΔCt=(Ct,目的基因−Ct,管家基因)–ΔCt校准样]计算基因相对表达丰度[16,17]。
1.4 数据统计分析
本文中所有实验数据均以平均值±标准误(Means±SE)表示, 用EXCEL(2013)进行计算和基本统计, 用SPSS软件(版本17.0)进行统计分析。实验数据经方差齐性检验后, 进行单因素方差分析(One-way ANOVA); 若各实验组间差异显著, 则进行Duncan’s多重比较; 以P<0.05判定为显著性差异。
2 结果
2.1 纳米缓释丁酸钠对草鱼生长性能的影响
如表2 所示, 经过60d的养殖实验, 0.6%组草鱼全部成活, 草鱼没有出现死亡与其他组有显著差异(P<0.05), 其他各处理之间都有死亡, 但没有显著差异; 增重率、特定生长率和肥满度3个指标方面, 随丁酸钠的浓度升高出现先升后降的趋势, 0.2%、0.4%和0.6%组草鱼增重率相比对照都有显著升高,以0.6%组升高最显著(P<0.05); 相比对照组, 各丁酸钠处理组的饵料系数均有不同程度升高, 但0.6%组与对照组无显著差异(P>0.05); 各丁酸钠处理组的蛋白质效率相比对照组都有不同程度降低, 但0.6%组与对照组接近, 无显著差异(P>0.05)。
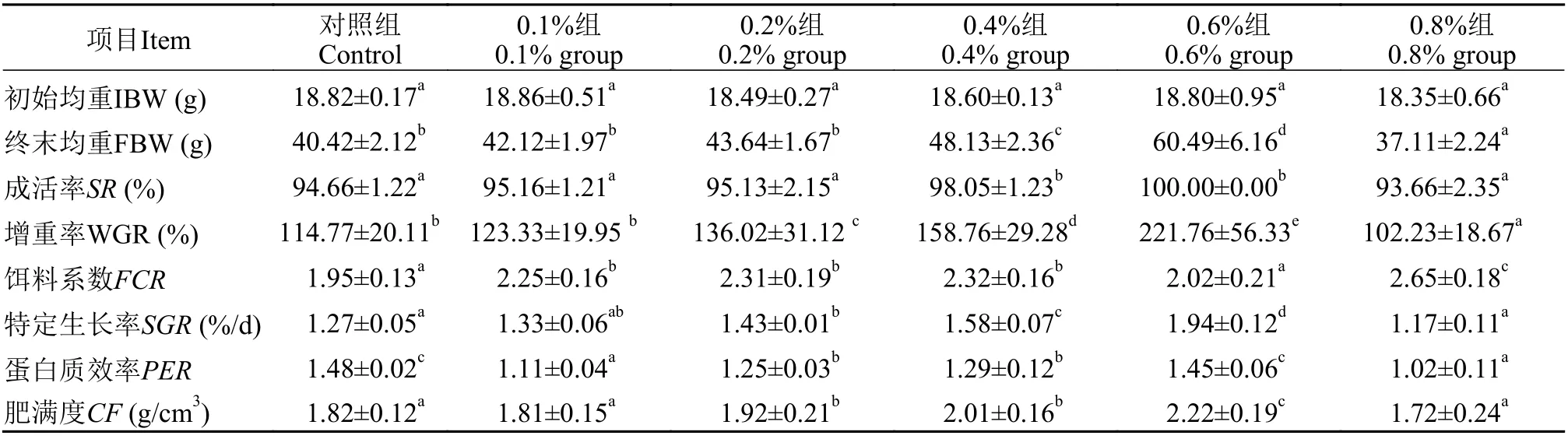
表2 纳米缓释丁酸钠对草鱼生产指标性能的影响Tab. 2 Effects of sustained release nanosphere sodium butyrate on the growth of grass carp
2.2 纳米缓释丁酸钠对草鱼肠道黏膜形态的影响
如表3所示, 纳米缓释丁酸钠对草鱼肠绒毛高度和隐窝深度的影响, 随着丁酸钠浓度升高, 草鱼肠绒毛高度逐渐增加, 隐窝深度逐渐变浅(图1)。当饲料中纳米缓释丁酸钠添加量为0.6%时, 肠绒毛高度与隐窝深度的比值最大, 与对照组有显著差异(P<0.05), 当超过这个浓度时则出现了负面影响。
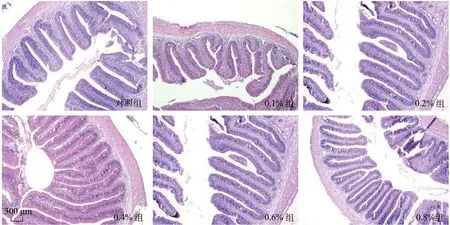
图1 不同处理组草鱼肠道黏膜形态光镜下比较(×40)Fig. 1 Intestinal mucosa morphology of grass carp in different groups under optical microscope (×40)
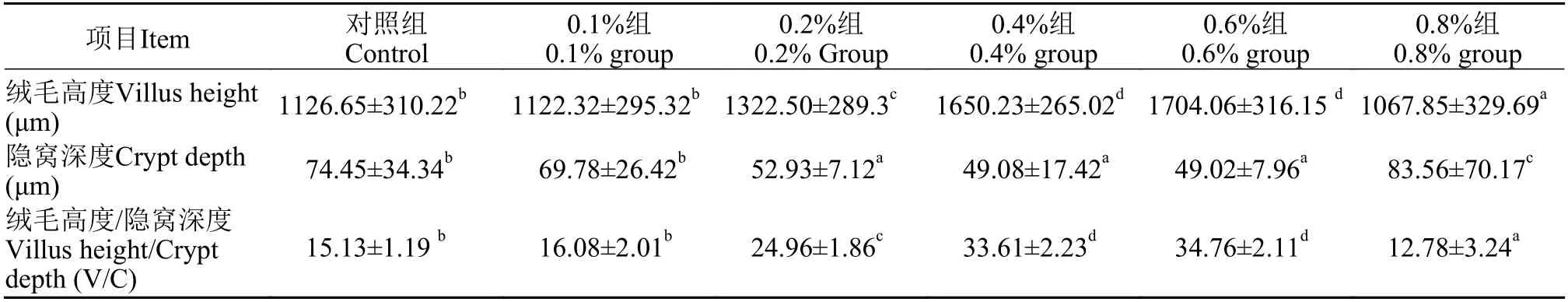
表3 纳米缓释丁酸钠对草鱼肠道黏膜形态的影响Tab. 3 Effects of sustained release nanosphere sodium butyrate on intestinal mucosa morphology of grass carp
2.3 纳米缓释丁酸钠对草鱼血清生化指标的影响
如表4所示, 在饲料中添加0.4%和0.6%丁酸钠会显著提高草鱼血清中总蛋白含量, 而添加0.1%和0.8%丁酸钠则会显著降低血清中总蛋白含量(P<0.05); 球蛋白含量除在0.4%添加组与对照组没有显著性差异以外, 其他各添加组球蛋白含量均显著低于对照组(P<0.05); 各添加组的谷丙转氨酶和谷草转氨酶含量相比对照组均出现下降, 当丁酸钠添加量为0.6%时, 这2个酶的含量与对照组差异不显著(P>0.05); 血清中尿素氮含量随丁酸钠浓度升高而显著逐渐下降。其中尿素氮在0.6%丁酸钠添加组含量达到最低值(P<0.05); 在血清中葡萄糖含量在丁酸钠浓度0.2%和0.8%时与对照组无显著差异(P>0.05), 而其余各添加组则显著低于对照组(P<0.05)。
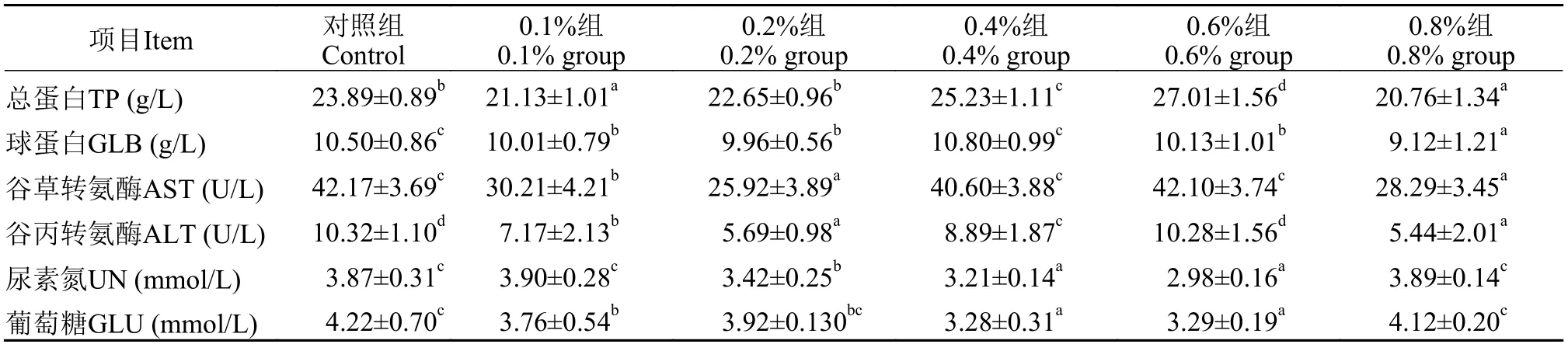
表4 纳米缓释丁酸钠对草鱼血清生化指标的影响Tab. 4 Effects of sustained release nanosphere sodium butyrate on serum indices of grass carp
2.4 纳米缓释丁酸钠对草鱼血清游离氨基酸的影响
各丁酸钠处理组血清中氨基酸含量随着丁酸浓度的升高而逐渐增加, 且在0.6%丁酸钠处理组达到最高, 随后下降, 其中组氨酸和脯氨酸变化最为明显(表5)。氨基酸总量和必需氨基酸也具有同样的趋势, 在0.6%丁酸钠添加组与对照组差异显著(P<0.05)。

表5 纳米缓释丁酸钠对草鱼血清游离氨基酸的影响Tab. 5 Effects of sustained release nanosphere sodium butyrate on serum free amino acids of grass carp
2.5 纳米缓释丁酸钠对草鱼肠道PepT1 mRNA表达的影响
随着丁酸钠添加比例的增加, 草鱼肠道PepT1 mRNA相对表达量呈上升趋势(图2); 其中,PepT1 mRNA在添加0.6%丁酸钠浓度时相对表达量最高,与对照组差异显著(P<0.05), 在添加0.8%丁酸钠浓度时相对表达量最低(P<0.05)。
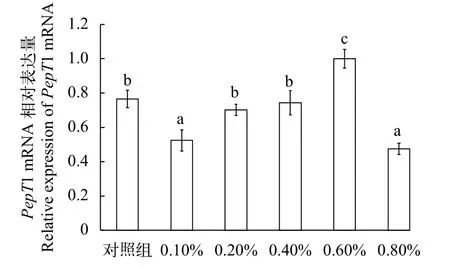
图2 纳米缓释丁酸钠对草鱼肠道PepT1表达量的影响Fig. 2 Effects of sustained release nanosphere sodium butyrate on PepT1 relative expression of grass carp
3 讨论
3.1 纳米缓释丁酸钠对草鱼生长性能的影响
在本实验中, 饲料中不同丁酸钠处理组的草鱼成活率、增重率、特定生长率和肥满度相比对照组均有一定程度提高, 而饵料系数和蛋白质效率与对照组接近, 无显著差异, 尤其以0.6%组效果最显著, 表明在饲料中添加适量的纳米缓释丁酸钠, 会提高促进草鱼的成活率, 促进生长。丁酸钠的促生长效果在畜禽动物上已有不少研究报道。张瑞阳等[18]研究发现, 在饲粮中添加包被的丁酸钠可明显提高断奶仔猪的生长性能。相似的是, 在断奶后小母牛饲料中添加丁酸钠对其生长性能和饲料效率均有促进作用, 且对消化道总表观消化率不产生负面影响[19]。Bortoluzzi等[20]研究表明, 在营养不良日粮的肉鸡饲料中添加丁酸钠, 可调节其盲肠微生物群并提高其免疫功能, 对其生长性能也有积极促进作用。在水产动物上, 还殿宇等[12]在鱼粉含量为12%的饲料中添加0.2%柠檬酸或丁酸钠, 可显著改善凡纳滨对虾生长性能, 提高饲料的利用效率。罗玲等[21]在饲料中添加适量微囊丁酸钠, 发现团头鲂的非特异性明显增高, 主要原因是因为提高了饲料利用率, 促进其健康生长。Zhou等[22]研究了3种不同类型的丁酸钠在不影响鱼体生长的情况下, 分别降低了鱼体的脂质积累, 可能对鱼苗的健康生长及发育有一定的促进作用。魏朝青等[23]在饲料中添加0.15%的丁酸钠研究其对大菱鲆幼鱼的影响, 发现丁酸钠提高了其生长性能等生长指标, 但是添加过多的丁酸钠会大大降低其生长性能。由此表明,在饲料中添加丁酸钠具有良好的促进生长作用, 但是要把握其添加量。在本实验中, 草鱼在0.6%组的成活率明显高于对照组, 而且其饵料系数和蛋白质效率指标与对照组无明显差异, 说明0.6%浓度的丁酸钠对草鱼具有一定的促生长效果, 这与上述研究报道相似, 表明在饲料中添加纳米缓释丁酸钠有一定的正面作用, 最佳添加量为0.6%。但并不是丁酸钠的浓度越高越好, 在添加浓度过高的实验组, 其生长效果及其他指标并不理想, 可能是过高的丁酸钠浓度抑制了肠道上皮细胞的生长, 从而降低了机体对营养物质的吸收利用, 具体原因有待进一步研究。
3.2 纳米缓释丁酸钠对草鱼肠道黏膜形态的影响
水生动物的消化系统没有胃, 肠道在食物的消化吸收中发挥重要作用, 但是水生动物的肠道壁都很薄, 植物性配合饲料中抗营养因子会造成鱼类肠道损伤, 抑制肠道黏膜上皮细胞的增殖和分化, 进而影响整个肠道的健康状况。研究表明, 丁酸钠在高等脊椎动物如牛和鸡的饲料中应用比较广泛, 能促进其肠道细胞的增值与成熟[24,25]; 丁酸钠在水生动物的应用中也表现出较好的促进鱼类肠道发育及增值的效果, 孙浪等[26]研究发现, 在饲料中添加一定浓度的丁酸钠能有效促进鲫肠道上皮细胞的增殖, 汪富荣等[27]在匙吻鲟饲料中添加1.0 g/kg的丁酸钠, 促进了匙吻鲟肠道绒毛的生长与增殖, 肠道绒毛高度与隐窝深度的比值显著增加。在本实验中, 当饲料中纳米缓释丁酸钠添加量为0.6%时,肠绒毛高度最高, 隐窝深度最浅, 其比值与对照组相比显著增加 (P<0.05), 表明丁酸钠对于草鱼肠道上皮细胞的生长与增殖具有很好的促进作用, 与上述研究结果一致。
3.3 纳米缓释丁酸钠对草鱼血清生化指标的影响
鱼体的身体健康及物质的代谢可以通过监测其血清生理生化指标的变化来评价。血清中的一些酶活力水平可以反映蛋白、肽类及氨基酸等物质的吸收代谢状况, 球蛋白等指标可以直观的反映机体健康及免疫状况[28,29]。在本实验中, 草鱼血清中的总蛋白和球蛋白含量在0.4%组和0.6%时相比对照组显著增加, 说明在饲料中添加纳米缓释丁酸钠后, 有利于草鱼对饲料中蛋白质等各种营养成分的吸收和利用, 蛋白质合成速度加快, 免疫力增强,间接的促进了草鱼的生产性能。AST和ALT是氨基酸代谢中重要的转氨酶, 主要分布在心脏和肝脏中, 在正常情况下, 血清中转氨酶活力在一定范围内的升高, 表示机体对蛋白质的合成、利用和分解代谢增强[28,30]。在本实验中, 各丁酸钠添加组这两种酶的活力均低于对照组, 没有差异, 说明饲料中的纳米缓释丁酸钠能有效提升鱼体蛋白质的代谢,而且不会损伤肝脏, 从而有助于鱼体内蛋白质的合成与积累。
血清中的尿素氮是蛋白质等含氮有机物代谢的终产物, 血清中尿素氮的含量可以反映体内蛋白质代谢的状况及肾脏功能的好坏[31]。Malmolf等[32]研究认为, 蛋白质和氨基酸之间的代谢平衡关系可以通过血清中的尿素氮含量来衡量, 在一定范围内,尿素氮的含量越低表明蛋白质合成效率越高, 越有利于营养物质的吸收和利用。在湘云鲫(Carassius auratusTrip1)[33]和匙吻鲟(Polyodon spathula)[34]等水产动物中发现, 丁酸钠可以显著降低血清中尿素氮的含量, 从而达到蛋白质的高效利用。在本实验中, 0.6%添加组组草鱼血清中的尿素氮含量最低,且与对照组相比差异显著, 说明饲料中添加纳米缓释丁酸钠能有效提高草鱼对饲料中蛋白质的吸收利用效率及蛋白质的合成效率。
葡萄糖是机体的主要供能物质, 血清中葡萄糖含量是机体营养状况的一个重要指标[35], 饲料中的营养素的吸收转运对血糖有较大影响。在本实验中, 0.6%组草鱼血清中葡萄糖含量与对照组无显著差异, 说明饲料中纳米缓释丁酸钠不会影响草鱼对营养物质的消化吸收, 不会对营养状况造成负面影响吧。
3.4 纳米缓释丁酸钠对草鱼血清游离氨基酸的影响
血清中游离氨基酸直接参与机体氨基酸的代谢和蛋白质的合成与积累, 其含量高低反应机体的营养状况[36]。汪富荣等[34]研究发现, 丁酸钠能显著提高匙吻鲟血清中蛋氨酸等氨基酸含量; 孙浪等[33]在湘云鲫的饲料中添加丁酸钠, 发现丁酸钠浓度为2.5 g/kg时, 血清中游离氨基酸含量最高。在本实验中, 饲料中添加一定量的纳米缓释丁酸钠, 能影响草鱼血清中的游离氨基酸含量, 各中氨基酸的总体趋势是先增后减, 在0.6%添加组, 其氨基酸总量和必需氨基酸含量显著提高, 表明饲料中添加纳米缓释丁酸可以提高草鱼血清中游离氨基酸含量, 进而表明草鱼的营养状况良好。
3.5 纳米缓释丁酸钠对草鱼肠道PepT1 mRNA表达的影响
蛋白质是鱼类的重要营养物质之一, 饲料中蛋白质的消化、吸收和利用的情况直接决定了鱼类对蛋白质的利用情况。传统蛋白质代谢理论认为,饲料中蛋白质在进入鱼类肠道后, 降解成氨基酸和小肽类分子, 大部分以小肽的形式被动物体吸收利用[37]。在动物小肠中负责吸收和转运小肽(二肽和三肽)的功能单位是位于其上皮细胞中的小肽转运载体PepT1(Oligopeptide transporter 1,PepT1),PepT1在小肠上皮细胞的表达水平将直接反应动物体对一部分蛋白质的利用效率。因此如何提高PepT1的表达量, 从而提高鱼类对蛋白质的消化利用至关重要。自从Fei等[38]克隆出兔小肠中PepT1基因以来,此后很多学者证实PepT1主要在高等哺乳动物中小肠上皮细胞中表达, 是小肠转运小肽的关键载体。近年, 关于鱼类的PepT1基因的研究日趋成熟, 发现鱼类PepT1基因也主要是在鱼类肠道上皮细胞中表达, 且主要集中于前肠, 在肝和肾中有少量表达[39]。目前, 国内淡水鱼如鳜[40]、草鱼[41]和鲫[42]等鱼类的PepT1基因已被克隆得到, 为本研提供了研究基础。在本实验中, 草鱼在0.6%丁酸钠添加组的肠道PepT1基因表达量相比对照组显著升高(P<0.05)。在高等动物中也有类似的实验结果, 丁酸钠能显著增加猪小肠黏膜上皮细胞PepT1的表达量[43]。在鱼类中, 吴凡等[44]在饲料中添加γ-氨基丁酸和丁酸钠,发现丁酸钠能显著提高草鱼肠道PepT1 mRNA的表达量; 孙浪等[26]也研究发现, 包膜丁酸钠能显著提高鲫鱼肠道PepTl的表达水平。本实验结果与前述研究结果一致, 说明在饲料中添加一定量的纳米缓释丁酸钠会显著影响肠道PepT1基因的表达量, 从而促进鱼体对蛋白质的吸收利用。
4 结论
本实验结果表明, 在草鱼饲料中添加0.6%的纳米缓释丁酸钠, 对于草鱼的生长性能和饲料利用率均未受到显著负面影响; 在饲料中添加适量(0.6%)的纳米缓释丁酸钠对鱼类具有保护肠道, 提高免疫力, 促进生长, 上调鱼肠道中小肽转运基因PepT1的表达水平。综上所述, 建议草鱼饲料中添加纳米缓释丁酸钠的量0.6%。

