生物信息技术筛选鸡空肠和盲肠的差异基因
樊庆灿
(宜春学院生命科学与资源环境学院,江西宜春 336000)
肠道具有转运和消化食物、吸收营养、排泄废物、维持生物体内环境稳定等功能,并在细胞和体液免疫、机体解毒和自愈等方面发挥重要作用[1]。鸡(Gallus domesticus)肠道包括小肠和大肠。小肠分为十二指肠、空肠和回肠,是消化食物和吸收营养物质的主要场所。大肠是由一对盲肠和直肠组成,盲肠后肠壁有丰富的淋巴组织形成盲肠扁桃体。目前,鸡肠道相关的分子研究虽然较多,但集中在肠道微生物方面[2-4],空肠和盲肠组织的分子研究较少。Bertocchi 等[5]利用鸡空肠和盲肠组织的转录组数据筛选肠道不同部位的差异表达基因,从分子水平探讨空肠和盲肠新功能。本研究利用基因表达综合数据库(Gene Expressioni Omnibus,GEO)中的数据,研究鸡空肠和盲肠的差异表达基因,讨论空肠和盲肠对不同营养物质的消化吸收作用和分子机理。
1 材料方法
1.1 数据来源 本研究所用数据来自于美国国家生物技术信息中心基因表达综合数据库,编号为GSE124066(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi)。19 只体重均等的Ros308 公鸡(42 d)屠宰后采集空肠和盲肠黏膜组织,利用GeneChip Chicken 1.0 ST Array(Affymetrix,Santa Clara,California,USA),测定空肠和盲肠各基因的表达量。
1.2 分析方法 将GSE124066 输入到BART(http://igc1.salk.edu:3838/bart/)的相应数据框中,平台类型为GPL19014,分组依据选择组织,所用的数据类型选择CEL 数据,数据上传后,BART 会首先对原始数据中的转录本表达矩阵进行log2 转换并做标准化。接下来做PCA 主成分分析对数据进行质控,矫正后用LΙMMA做差异分析。分析完成后下载标准基因表达量表、基因表达差异表和火山图。在Excel 中将adj.P<0.05 且|logFC|>1 的转录本称为差异表达转录本(Differentially Expressed Transcripts,DETs),对应的基因作为差异表达基因(Differentially Expressed Genes,DEGs)。将logFC>1 和logFC<-1 的DEGs 分别导入STRΙΝG(https://string-db.org/cgi/input.pl? sessionΙd=ΝPdug dyy2MoP &input_page_show_search=on)、Cytoskype 3.6.0 的BΙΝGO 插件和DAVΙD 6.8(https://david.ncifcrf.gov/tools.jsp)中,进行蛋白互作分析、生物过程富集分析和KEGG 分 析。把STRΙΝG 中combine score>0.7的互作网络数据导入Cytoskype 中绘制互作图,利用cytoHubb 插件Betweenness 法筛选互作图中的核心基因。
2 结果
2.1 差异表达结果 结果显示在空肠中表达上调的DETs共677 个(logFC<-1),对 应517 个可识别DEGs。在盲肠中表达上调的DETs 共660 个(logFC>1),对应534 个可识别DEGs。其中差异倍数大于6 的DEGs 见表1,其中空肠上调的DEGs 共10 个,载脂蛋白B(Apolipoprotein B,APOB)为差异倍数最大的DEG,此外包括4 个转运蛋白基因和5 个代谢相关酶。4 个转运蛋白基因为视黄醇结合蛋白2(Retinol Binding Protein 2,RBP2)、脂溶性载体家族6A19(Solute Carrier Family 6 Member 19,SLC6A19)、脂溶性载体家族15A1(Solute Carrier Family 15 Member 1,SLC15A1)和脂溶性载体家族7A9(Solute Carrier Family 7 Member 9,SLC7A9)。5 个代谢相关酶为谷氨酸谷氨氨肽酶(Glutamyl Aminopeptidase,EΝPEP)、甲基多巴α亚基(Meprin A Subunit Alpha,MEP1A)、蔗糖酶异麦芽糖酶复合物(Sucrase-Ιsomaltase,SΙ)、血管紧张素转换酶2(Angiotensin Ι Converting Enzyme 2,ACE2)和麦芽糖酶葡糖淀粉酶(Maltase-Glucoamylase,MGAM)。盲肠中表达上调的DEGs 为2 个,胱硫醚-β-合成酶(Cystathionine Beta-Synthase,CBS)为差异倍数最大的基因,其次为T 细胞分化相关蛋白(T Cell Differen tiation Protein,MAL)。
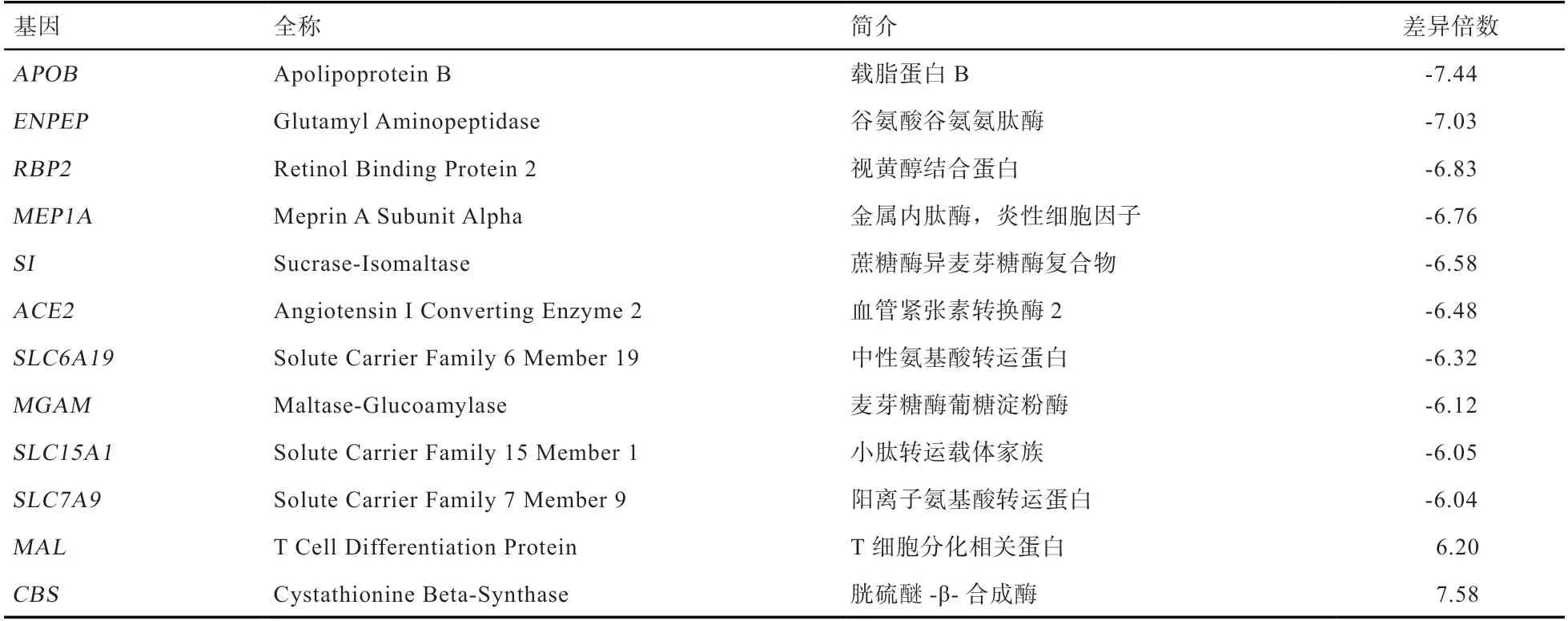
表1 表达差异倍数大于6 的DEGs
将空肠中517 个和盲肠中534 个DEGs 分别进行互作分析和核心基因筛选,图1 为部分基因的互作网络图。其中空肠(图1-a)DEGs 互作网络中的5 个核心基因分别为APOB、载脂蛋白A1(Apolipoprotein A1,APOA1)、骨髓基质细胞抗原1(Bone Marrow Stromal Cell Antigen 1,BST1)、黑素转铁蛋白2(Recombinant Melanotransferrin2,MFΙ2)和RBP2,其中APOB和RBP2为差异倍数大于6 的DEGs。盲肠(图1-b)DEGs 互作网络中的核心基因为周期依赖蛋白激酶1(Cyclin Dependent Kinase 1,CDK1)、细胞分裂周期蛋白20(Cell Division Cycle 20,CDC20)、丝氨酸/ 苏氨酸蛋白激酶1(Polo Like Kinase 1,PLK1)、正核分裂周期蛋白80(Νuclear Division Cycle 80,Νdc80)和微小染色体维持复合物5(Minichromosome Maintenance Complex Component 5,MCM5)。
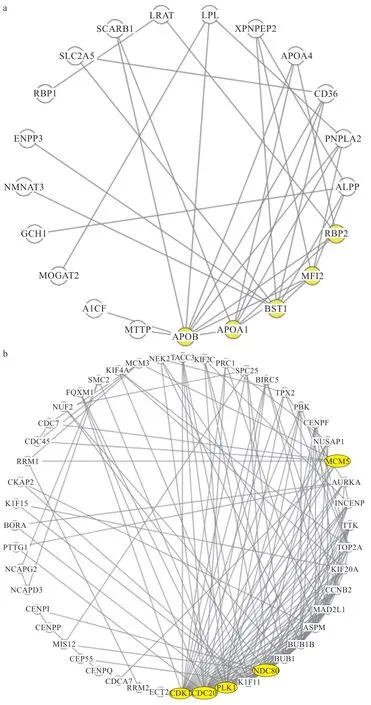
图1 空肠和盲肠的部分DEGs 互作图
2.2 空肠和盲肠DEGs 聚类分析 对空肠和盲肠中表达上调的DEGs 进行生物过程的GO 分析,空肠和盲肠中最为显著的10 个条目见表2。在空肠中表达上调的DEGs 主要聚集在脂、醚、酒精、小分子代谢和跨膜运输,其中脂代谢条目为P值最小条目,聚集在此条目的DEGs 有23 个。此外,筛选出多条脂代谢相关条目。盲肠中表达上调的DEGs 主要聚集在机体发育和细胞周期相关的条目,其中多细胞有机发育是P值最小的条目,聚集在此条目的DEGs 有74 个。此外,筛选出多条机体发育相关的条目。

表2 空肠和盲肠DEGs 生物过程分析的部分结果(前10 项)
对空肠和盲肠中表达上调的DEGs 进行KEGG 分析,P<0.01 的信号通路见图2。在空肠中表达上调的DEGs 参与PPAR 信号通路(03320)、代谢通路(01100)、过氧化物体(04146)、脂肪酸代谢(01212)和脂肪酸降解(00071)信号通路,其中PPAR 信号通路是P值最小的信号通路,有18 个DEGs 参与该通路。在盲肠中表达上调的DEGs 参与细胞周期(04110)、黏附斑信号通路(04510)、ECM-受体互作通路(04512)、硫代谢(00920)、抗生素合成(01130)、半胱氨酸和蛋氨酸代谢(00270)信号通路,其中细胞周期是P值最小的信号通路,共有14 个DEGs 参与该通路。

图2 空肠和盲肠DEGs 信号通路分析部分结果
3 讨论
本研究筛选出空肠中的表达上调的DEGs,从分子水平证实了空肠的生理功能。差异基因中MGAM编码的酶蛋白可作为α-淀粉酶活性降低时的替代酶,SΙ编码蛋白则在碳水化合物消化的最后阶段起着重要作用,聚类分析也筛选出酒精和小分子代谢条目。差异基因和聚类分析结果说明经过胃和十二指肠后,空肠是碳水化合物的消化末端,具有预防前端碳水化合物消化不完全的备用酶。聚类分析筛选的10 个条目中,7 个与脂代谢有关。KEGG 分析中,过氧化物酶体增殖物激活受体(PPAR)和过氧化物酶体信号通路参与调节脂类、葡萄糖代谢和炎症反应[6-7],其余通路也均与脂肪酸代谢有关,说明空肠中脂肪酸的消化和代谢相对比较活跃。在差异倍数较大的基因中,有氨基酸、脂类和维生素类转运蛋白,5 个核心基因中有4 个参与营养物质转运,说明空肠对各类营养物质都具有更强的吸收作用。聚类分析中的跨膜转运条目证明了空肠的吸收功能。综上所述,与盲肠相比,鸡的空肠中有少量的碳水化合物消化和比较旺盛的脂类消化,并对氨基酸、脂肪和维生素等具有更强的吸收作用。
鸡盲肠的表达上调的DEGs 主要聚集在机体发育和细胞周期,5 个核心基因均与细胞周期有关。这可能与鸡盲肠扁桃体的功能密切相关。盲肠扁桃体是禽类最大的肠相关性淋巴组织,由弥散性和密集型淋巴组织组成[8],含T 淋巴细胞和B 淋巴细胞,对肠道病原菌具有局部免疫作用[9-10]。扁桃体相关细胞活动比较活跃,细胞周期基因表达量则相应上调。KEGG 分析中,黏附斑和ECM-受体互作通路参与细胞信号传导,具有调节细胞分化和增殖[11-14]等生理作用,与细胞周期的调节密切相关。硫代谢、半胱氨酸和组氨酸代谢在肠道相关的研究中报道较少。半胱氨酸和组氨酸是鸡体内的含硫氨基酸。生物体内的硫有转移基团的作用[15]。含硫氨基酸具有抗氧化和清理肠道内自由基等作用,还是蛋白质生物活性的关键氨基酸[16-17]。盲肠内硫代谢和含硫氨基酸相关基因的高表达可能与抗体生成、抗生素合成和肠道自由基的清除有关。此外,由于盲肠中存在丰富的肠道微生物,抗生素的合成也是必不可少。传统观点认为,盲肠主要吸收粗纤维分解的脂肪酸和细菌合成的维生素,本研究中并未发现相关DEGs。可能是与空肠相比,盲肠中的脂肪酸和维生素吸收只是少量,盲肠中相关基因的表达量远远低于空肠。
在差异倍数较大的DEGs 中,空肠中高表达的ACE2和盲肠中高表达的CBS具有广泛的生物学功能。ACE2编码蛋白的羧肽酶结构域不仅能有效切割血管紧张素(Ang)ΙΙ 的C 末端苯丙氨酸,产生血管扩张剂Ang 1-7,还通过切割Ang Ι 的C 末端亮氨酸生成Ang 1-9,并进一步加工为Ang 1-7[18-19],抵消血管紧张素的作用,舒张血管,增加血流量。空肠中ACE2的高表达能够扩张消化道血管系统,促进营养物质吸收。此外,ACE2能协助将中性氨基酸转运蛋白SL6A19 转运至肠上皮细胞的质膜,促进肠道中性氨基酸的运输[19-20]。这与空肠功能也是相符的。CBS催化同型半胱氨酸(Hcy)与丝氨酸的缩合形成胱硫醚[16],这是转硫途径中的起始步骤和限速步骤[21-22]。CBS缺乏会导致同型半胱氨酸尿症[23]。胱硫醚随后被胱硫醚γ-裂解酶(CTH)裂解形成半胱氨酸,后者为谷胱甘肽的前体[17]。此外,CBS还参与了内源性硫化氢(H2S)生成[24]。CBS通过控制Hcy 和H2S 代谢发挥多种生物学功能,包括氧化还原稳态和蛋白质修饰等[17,22]。本研究发现盲肠中高表达CBS可能会参与抗体等蛋白的修饰,并在维持肠道的氧化还原方面发挥重要作用。
4 结论
本研究筛选了空肠和盲肠中的差异表达基因并进行生物信息学分析,从分子角度探讨空肠和盲肠的生理功能,发现空肠中脂肪消化比较旺盛,碳水化合物的消化相对较弱,且蛋白质、维生素和脂肪酸等营养物质的吸收作用较强;盲肠与肠道的局部免疫有关,可维持肠道内环境的稳定。

