CAⅨ联合CD8+TIL对宫颈癌淋巴结转移的预测价值
杨杨 梁罗娇 周琛斐 陈晓静 王薇
广州医科大学附属第一医院妇产科(广州510120)
宫颈癌是女性生殖系统最常见的恶性肿瘤之一,淋巴结转移是宫颈癌的主要转移途径和影响宫颈癌治疗及预后的独立危险因素[1]。有研究显示,临床上约15%~20%的宫颈癌患者在行根治性手术前已经出现淋巴结转移,术后需加用放化疗,对比单纯根治性放化疗,手术后追加放化疗的远期预后无明显改善,相反双重治疗的远期并发症增加[2]。2018年,国际妇产联盟组织(International Federation of Gynecology and Obstertrics,FIGO)妇科肿瘤委员会发布宫颈癌诊治最新指南,术前证实淋巴结转移,治疗首选根治性放化疗[3],这对术前准确诊断淋巴结转移提出更高的要求。目前临床最常用的方法是MRI、CT 扫描,但敏感性及特异性偏低。PET-CT检查、前哨淋巴结活检术是近年新兴的评估方法,但PET-CT 检测仅提高病灶>10 mm的淋巴结转移准确性[4]。前哨淋巴结活检术,由于示踪方法和病理检测技术的局限,假阴性率可达16.6%[5]。因此,为了规避宫颈癌患者双重治疗,寻找新的检测方法提高术前淋巴结转移的检出率具有重要临床意义。
缺氧肿瘤微环境是实体瘤的常见特征,在肿瘤转移生物学行为中起重要作用[6-7]。课题组前期研究已证实,宫颈癌淋巴结转移与缺氧密切相关[8]。碳酸酐酶Ⅸ(carbonicanhydraseⅨ,CAⅨ)属于一种跨膜蛋白,是肿瘤细胞适应缺氧应激反应的调节基因,可作为肿瘤细胞缺氧的标记物[9]。CD8+肿瘤浸润淋巴细胞(tumorinfiltratinglymphocytes,TIL)是肿瘤微环境中最核心的免疫效应T 细胞,可抑制肿瘤的恶性进展及转移,已在乳腺癌、胰腺癌等多种实体肿瘤中被证实[10]。有研究发现,多种实体肿瘤中,缺氧微环境的改善,可增加CD8+TIL 的浸润,是抗肿瘤治疗的有效靶点[11]。然而,宫颈癌中,两者相关的研究尚未见报道。近期文献报道,宫颈癌组织中上皮细胞激酶(epithelial cell kinase,EphA2)和转录因子Twist 蛋白表达量的联合检测可提高宫颈癌的预后判断[12]。本研究分析CAⅨ和CD8+TIL在宫颈癌组织中的表达分布情况,探讨二者的相关性及联合检测对于宫颈癌淋巴结转移的预测价值,希望为宫颈癌的诊治提供更多的临床策略。
1 对象与方法
1.1 研究对象收集2011年至2014年广州医科大学附属第一院妇产科收治的宫颈癌(按照2014年FIGO分期IB-IIA期)患者75例,无淋巴结转移47例,有淋巴结转移28 例。纳入标准:(1)经病理活检确诊为宫颈鳞状细胞癌;(2)术前经两位有经验的妇科主任医师诊断临床分期IB-IIA 期的宫颈癌患者;(3)既往未接受化疗、放疗等抗肿瘤治疗;(4)所有患者或家属均告知并签署知情同意书。
1.2 主要试剂CAⅨ、CD8 兔抗人多克隆抗体、二抗均购自英国Abcam 公司;免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司。
1.3 免疫组织化学染色组织样本经病理科确诊入组,经4%多聚甲醛固定,常规石蜡包埋、切片、脱蜡、水化后,3%过氧化氢封闭,加CD8 一抗的组织切片先给予2%牛血清蛋白封闭10 min,分别加入一抗(CAⅨ:1∶500,CD8:1∶200),4 ℃孵育过夜,加入二抗(1∶1 000)37 ℃孵育30 min,二氨基联苯胺(DAB)显色,苏木精复染,常规脱水封片。
1.4 结果判定
1.4.1 CAⅨ的判定在高倍视野下(×200)观察,综合阳性肿瘤细胞百分比和染色强度进行判定:百分比评分标准:>75%为4 分,35% ~75%为3 分,10%~34%为2 分,1%~9%为1 分,<1%为0 分;染色强度评分标准:无染色为1 分;染色力弱(浅黄色)为2 分;中度染色(黄棕色)为3 分;染色力强(褐色)为4 分。染色指数(SI)为阳性肿瘤细胞百分比得分与染色强度得分的乘积之和。用SI 评估CAⅨ的表达,SI <8 确定为低表达,SI ≥8 为高表达。
1.4.2 CD8+TIL 的判定根据CD8+TIL 的染色分布,将CD8+TIL 分为癌巢内[Intraepithelial CD8+Tlymphocytes,CD8+TIL(i)]和间质内[Stromal CD8+Tlymphocytes,CD8+TIL(s)]。在高倍镜(× 400)视野下按癌巢及间质分别随机选取3 个视野。对视区内阳性细胞计数三次,取平均值,再取三个视野的平均值,根据CD8+TIL 中位数将患者分为低浸润组(<中位数)和高浸润组(≥中位数)。
1.5 统计学方法应用SPSS 25.0和Graphpad Prism软件进行统计分析。计量资料以中位数及四分位数间距[M(P25,P75)]表示。采用Spearman 相关分析进行相关性分析。组间结果的差异比较采用Mann-WhitneyU秩和检验。计数资料数据以n(%)的形式表示,组间比较采用χ2检验或Fisher 确切概率法。采用logistic 二元回归分析建立宫颈癌淋巴结转移诊断的logistic 回归模型,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,评估各组对宫颈癌淋巴结转移的预测效能。所有检验均为双侧检验,P<0.05 时表示差异具有统计学意义。
2 结果
2.1 CAⅨ和CD8+TIL 的表达及相关性免疫组化染色结果显示:CAⅨ表达位于癌巢肿瘤细胞的细胞膜,呈棕黄色颗粒状。CD8+TIL 位于肿瘤浸润性淋巴细胞的细胞质和细胞膜,在癌巢和间质中均有表达,呈棕黄色颗粒状(见图1A)。观察到,癌巢CAⅨ表达升高往往伴随着癌巢CD8+T 细胞浸润数量减少,间质CD8+T 细胞浸润数量增多(图1A)。利用Spearman 相关性统计分析,结果显示:CAⅨ的表达与癌巢CD8+T 细胞浸润数量呈显著负相关(r=-0.559 7,P<0.001),与间质CD8+T 细胞浸润数量呈显著正相关(r= 0.462,P<0.001,图1B)。
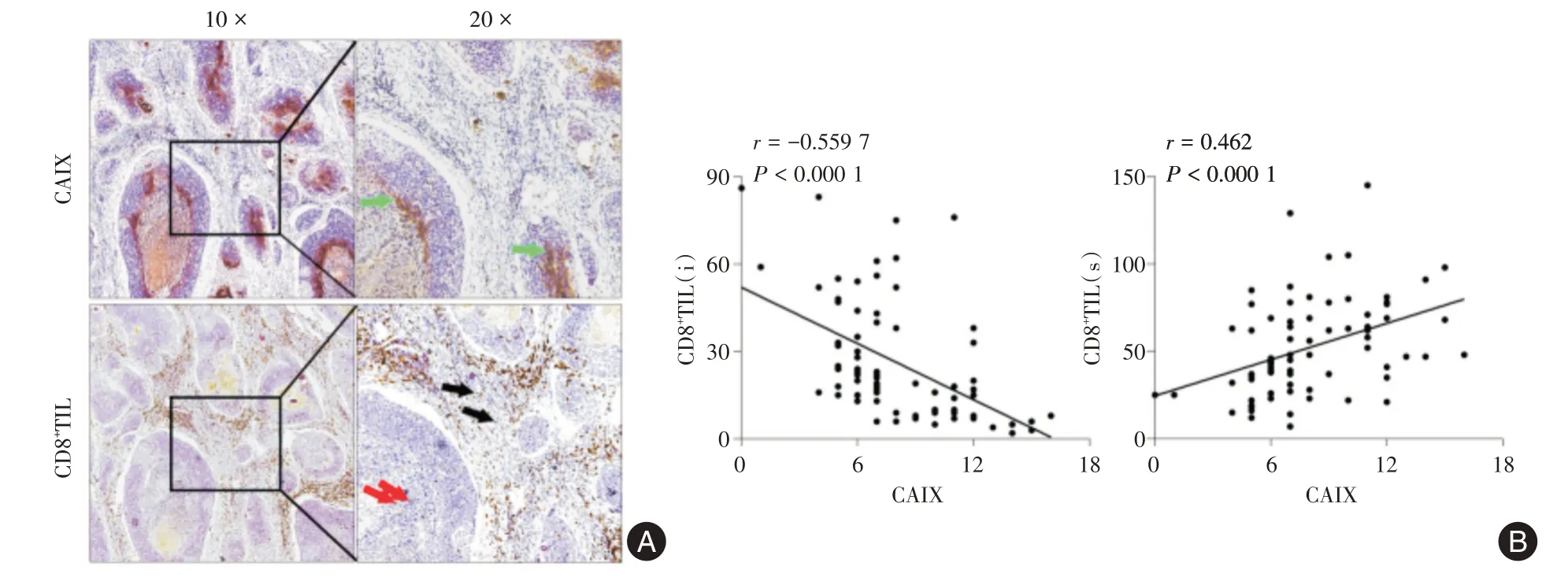
图1 CAⅨ、CD8+TIL 在宫颈癌中的免疫组化染色情况及其相关性Fig.1 Immunohistochemicalstainingandrelativity of CAⅨand CD8+TIL in CC
2.2 CAⅨ和CD8+TIL与临床病理特征的关系利用χ2或Fisher 精确检验分析,结果显示:在宫颈癌组织中,CAⅨ高低与淋巴结转移有关(P=0.024),与患者的年龄、FIGO 分期、分化程度、脉管浸润均无关(P>0.05),癌巢、间质CD8+T 细胞浸润高低与患者的年龄、FIGO 分期、分化程度、脉管浸润、淋巴结转移均无关(P>0.05,见表1)。

表1 CAⅨ或CD8+TIL 的表达水平与临床病理特征的关系Tab.1 Relationship between the expression level of CAⅨor CD8+TIL in CC patientsand clinicopathological features 例
2.3 CAⅨ联合CD8+TIL 对淋巴结转移的预测价值CAⅨ和CD8+TIL 在对应淋巴结有无转移的宫颈癌组织(28 例伴有淋巴结转移,47 例无淋巴结转移)中的免疫得分,利用Mann-WhitneyU检验分析,结果显示:在有无淋巴结转移的宫颈癌组织中,CAIX(P= 0.001)、癌巢CD8+TIL(P<0.001)的差异具有统计学意义,间质CD8+TIL 的差异无统计学意义(P=0.084,图2)。
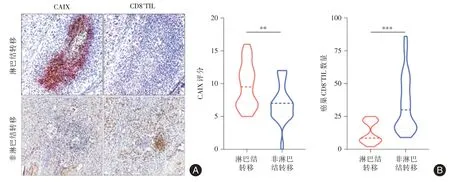
图2 CAⅨ、CD8+TIL 在有无淋巴结转移宫颈癌组织中的表达Fig.2 Expression of CAⅨand CD8+TIL in CC tissues with or without LNM
随后,通过logistic 二元回归分析构建宫颈癌淋巴结转移联合诊断模型。绘制CAⅨ单指标及联合不同分布CD8+TIL 的ROC 曲线(图3),并根据约登指数(Youden index)最大原则得到各参数的最佳诊断截断值(cut off 值)。结果显示:CAⅨ联合间质CD8+TIL 具有最高的灵敏度(78.6%)、阴性预测值(83.3%),而CAⅨ联合癌巢CD8+TIL 具有最高的特异度(100%)、阳性预测值(100%)、准确度(85.3%)以及最大曲线下面积(AUC=0.837)。综合来看,CAⅨ联合癌巢CD8+TIL 的检测在预测淋巴结转移中,具有最高的诊断效能(表2)。

表2 各参数对宫颈癌淋巴结转移的诊断效能比较Tab.2 Comparison of the diagnostic efficiency of various parameters for LNM of CC
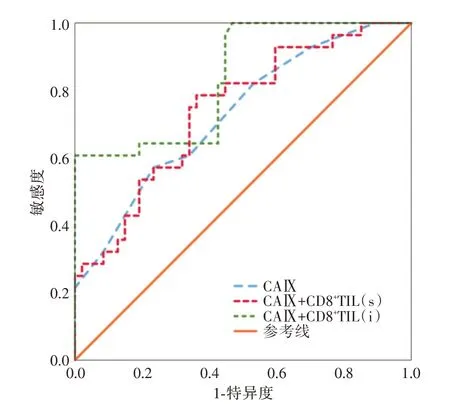
图3 CAⅨ、CAⅨ联合CD8+TIL 预测宫颈癌LNM 的ROC曲线Fig.3 ROC curve for prediction of LNM of CC with CAⅨand CAⅨcombined CD8+TIL
3 讨论
随着FIGO、美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)对于宫颈癌诊治指南的不断更新,术前区域淋巴结有无转移直接影响宫颈癌治疗方案的选择[13]。近年来,随着对肿瘤转移机制的深入研究发现,肿瘤微环境(tumor microenvironment,TME)对于调控肿瘤恶性进展及转移发挥重要作用,缺氧和TIL 是TME 的重要特征和主要免疫应答细胞[14]。本研究通过免疫组化法检测宫颈癌组织病理切片中CAⅨ和CD8+TIL 的表达分布,探讨二者在肿瘤微环境中的相关性,及对淋巴结转移诊断的预测效能,为临床提供更精准的个体化治疗模式,改善患者的预后。
近年来的研究发现,缺氧(hypoxia)是TME中调控肿瘤转移的始动因素。有研究显示,在非小细胞肺癌、乳腺癌、宫颈癌等多种实体肿瘤中,癌细胞CAⅨ的表达与预后密切相关[9]。本课题组前期研究证明,肿瘤微环境中,缺氧促进宫颈癌恶性进展及淋巴结转移[8],与本研究的结果一致,在宫颈癌组织中,CAⅨ的表达水平与淋巴结转移存在相关性(P=0.024),伴有淋巴结转移的组织中,CAⅨ的表达明显升高(P=0.001)。GUO 等[15]研究发现,CD8+TIL 存在不同的亚型,因分布和功能的不同,影响患者的预后。本研究分析了癌巢及间质CD8+TIL的数量,结果显示:宫颈癌组织中,癌巢CD8+T 细胞的浸润数量随淋巴结转移显著减少(P<0.001),提示癌巢CD8+TIL 可能与宫颈癌淋巴结转移相关,这与GORTER[16]等人的研究结果相符合。同时发现,CAⅨ高表达的组织,癌巢CD8+TIL 数量减少,间质CD8+TIL数量增多。既往多项研究表明,缺氧肿瘤微环境发生代谢变化,如癌细胞释放乳酸,腺苷等引起的酸中毒,严重损害细胞毒性T 细胞的功能和增殖[17]。在肺腺癌中,LI[18]团队证实,缺氧肿瘤微环境抑制CD8+TIL的募集及浸润,结合本课题的发现,推测肿瘤微环境中,缺氧可能参与CD8+TIL的调控。
综上,推断CAⅨ和癌巢CD8+TIL 在宫颈癌淋巴结转移中可能发挥相互制约作用。目前,国内外关于缺氧联同CD8+TIL 的研究鲜少,但有研究证实,肿瘤组织中,相较于单一因素的检测,PDL1 联合CD8+TIL 的检测成为患者预后评估更有利因素[19]。因此本研究构建宫颈癌淋巴结转移联合诊断模型,结果显示,CAⅨ联合癌巢CD8+TIL 在预测淋巴结转移中,具有最高的诊断效能,其中特异度、阳性预测值为100%,理论上可避免淋巴结转移的误诊,在一定意义上增强了临床医生诊断淋巴结转移的信心,同时为临床个体化治疗方案的选择提供了理论依据。
本研究作为回顾性研究,仍需通过大规模的临床研究进行验证。同时本研究缺乏患者术后随访资料的统计,不能评估两者的检测对患者预后价值的预测效能。后期研究将加强患者的术后随访,完善生存数据的分析。
综上所述,宫颈癌组织中,缺氧和癌巢CD8+TIL的表达与淋巴结转移密切相关,二者相互制约,联合检测可作为术前淋巴结转移的预测因素。鉴于在宫颈癌组织中,缺氧可能参与CD8+TIL 的调控,影响肿瘤免疫微环境,促进淋巴结转移,研究重点可靶向二者作用的具体机制,为宫颈癌的治疗开发新靶点,这也将是本课题今后的研究方向。

