去泛素化酶组成型光形态发生因子9信号复合体5上调甲硫氨酸腺苷转移酶2A表达促进肝癌细胞增殖
谢培一 陈磊峰 卢虹成 杜栋年 李家娟 邵江华
南昌大学第二附属医院肝胆外科,江西省分子医学重点实验室(南昌330006)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一,全球每年的新发病例中,有51%的病例发生在我国[1]。近年来,虽然肝切除技术及肝癌综合治疗水平明显提高,但是HCC预后仍然不佳[2-3]。其中,肝癌细胞的快速增殖是影响HCC 患者预后的重要原因之一[4]。因此,探讨肝癌细胞增殖相关机制已成为目前的热点。
组成型光形态发生因子9 信号复合体5(constitutive photomorphogenic-9 signalosome subunit 5;CSN5)最初被鉴定为激活蛋白-1(activator protein 1;AP-1)复合体成员c-Jun 的协同激活因子[5]。研究[6-7]表明CSN5 属于去泛素化酶,主要参与细胞DNA 修复、凋亡和增殖。研究[8-9]表明CSN5 表达上调可以抑制抑癌基因的活性,还可以上调多种促癌基因表达进而促进肿瘤细胞增殖。虽然有文献报道CSN5 在肝癌表达增加并且与增殖有关,但是CSN5 促进HCC 增殖的分子机制仍不完全清楚,有待进一步研究[10]。
另外,研究[11-12]已经证明甲硫氨酸腺苷转移酶2A(methionine adenosyltransferase 2A,MAT2A)在肝癌组织中高表达并与肝癌的增殖有关。然而,CSN5 与MAT2A 的表达与肝癌增殖之间的关系仍未见报道。本研究探讨CSN5是否可以调控MAT2A的表达并进而影响肝癌细胞的增殖能力,为临床治疗肝细胞癌提供了分子生物学依据。
1 材料与方法
1.1 细胞及试剂肝癌细胞和正常肝细胞从中国科学院典型培养物保藏委员会细胞库购买。DMEM 培养液以及胎牛血清购自美国Gibco 公司;LipofectAMINE®3000 转染试剂和TRIzol-Reagent 购自美国Invitrogen 公司;兔抗人CSN5 单克隆抗体购自美国Santa Cruz 公司,兔抗人MAT2A 多克隆抗体和鼠抗人tubulin 多克隆抗体购自美国Proteintech公司,免疫组织化学检测试剂盒和DAB 显色液均购自北京中杉金桥生物技术有限公司;含有特异性针对CSN5 基因的shRNA-1、shRNA-2 的干扰质粒(分别命名为shCSN5-1 和shCSN5-2)以及含有阴性shRNA 的对照质粒(命名为shNC)均由上海吉凯基因化学技术有限公司构建。
1.2 肝癌标本收集在南昌大学第二附属医院获得经过肝癌患者切下的肝癌组织和癌旁组织,从2017年6月至2019年7月收治的肝癌患者手术切除标本63 例,其中男46 例,女17 例,患者年龄范围为31 ~75 岁,平均年龄(62±5.1)岁。及时将新鲜的组织妥善存放在保存液中,于-80℃的液氮中保存,部分可放于福尔马林液体中保存,1 周之内进行石蜡组织包埋,用于免疫组织化学等研究。所有患者样本的获取经医院伦理学委员会授权。
1.3 细胞培养及转染人HCC 细胞HCCLM3,MHCC97H,Huh7,HepG2 以及人永生化肝细胞株(HL-7721 等)可用包含10%胎牛血清(FBS,Hy-Clone,USA)的DMEM(Gibco)在37℃恒温无菌培养箱培养,并进行传代或转染处理。将CSN5 shRNA-1(靶点序列为5′-AGCGAGGTAAAGTTGCGTCT-3′)、shRNA-2(靶点序列为5′-AATGCAAAACAGGTTGGCCG-3′)的shCSN5-1/2 干扰质粒和阴性对照shRNA 干扰片段转染至肝癌HCCLM3 细胞。转染实验步骤参照LipofectAMINE®3000 转染试剂说明进行。
1.4 免疫组织化学法HCC组织及癌旁组织用10%福尔马林固定,石蜡包埋,切片,脱蜡。然后,用微波加热抗原修复液(EDTA,pH8.0)25 min 使组织的抗原充分修复,并用山羊血清封闭40 min。进而用PBS 溶液稀释抗CSN5 单克隆抗体(sc135954,1∶500,Santa Cruz)并在4℃下孵育过夜。其次,HRP 结合二级抗体(Boster)室温下孵育2 h。采用DAB 检测试剂盒(Maxim)进行免疫染色2 min,并用TBST 溶液洗涤组织切片3 次。最后,由3 名对病理学家对染色后阳性区域的比例进行半定量评分[13]。
1.5 蛋白质印迹法提取总蛋白后,蛋白质浓度由BCA蛋白质分析试剂盒(Thermo Scientific,Waltham,MA,USA)进行分析。细胞提取液在裂解缓冲液中煮沸20 min,离心后,用十二烷基磺酸钠(SDS)聚丙烯酰胺凝胶电泳分离蛋白。分离的蛋白条带通过电印迹法转移到PVDF 膜(Millipore,Bedford,MA,USA)上,然后与一抗在4℃下孵育过夜。用TBST 洗涤3 次,室温下与第二抗体孵育2 h。主要抗体包括抗CSN5 单克隆抗体(sc135954,1∶1 000,Santa Cruz)、抗MAT2A 多克隆抗体(55309-1-AP,1∶1 000,Proteintech)和Tubulin 单克隆抗体(11224-1-AP,1∶2 000,Proteintech)。用TBST 洗涤3 次,室温下与第二抗体孵育2 h。使用Quantity One 软件(Bio-Rad,Hercules,CA,USA)测量每个蛋白条带的强度[14]。
1.6 实时定量PCR(qRT-PCR)采用TRIzol 法抽提各组细胞的总RNA,用紫外分光光度计测定总RNA 纯度并定量。采用实时定量PCR 技术检测细胞中RNA 水平。cDNA 用PrimeScript RT 试剂盒(Invitrogen,USA)进行反向转录获得,然后使用SYBR Premix Ex-Taq(TaKaRa Bio,Shiga,Japan)按照制造商的说明进行qPCR。本实验所用到的主要引物序列如下CSN5,Forward:5′-AGAGTTTGTTCCCGTGGTGC-3′,Reverse:5′-CGAGGAAGCGGAGAAGTTGT-3′;MAT2A,Forward:5′-CATGAACGGACAGCTCAACG-3′,Reverse:5′-AGCATAAGCAGCTGAACGGT-3′。每个样品均设3 个复孔,设定阈值,测定平均循环阈值(cycle threshold,Ct)。以2-ΔΔCt表示目的基因的相对表达水平[15]。
1.7 统计学方法三个独立实验的所有结果均用均数±标准差表示。两组样本均数的比较采用配对t检验或独立样本t检验;多组样本间均数的比较采用方差分析,对有意义的因素再采用LSD-t检验进行组间多重比较。所有数据用GraphPad Prism 5 软件分析,P<0.05 被认为差异有统计学意义。
2 结果
2.1 肝癌组织中CSN5 的表达水平明显增高通过免疫组织化学法检测63 例(含31 例新鲜标本)人体肝癌标本及癌旁组织中CSN5 的表达情况(图1A)发现CAN5 在肝癌组织中表达明显升高。通过实时荧光定量PCR 和蛋白质印迹法(图1B-D)检测了31 例新鲜标本,结果表明肝癌组织中CSN5的mRNA 和蛋白表达水平均明显高于癌旁组织(P<0.01)。

图1 CSN5 在肝癌组织中表达明显升高Fig.1 CSN5 is aberrantly upregulated in HCC tissues
2.2 肝癌细胞株中CSN5 的表达明显高于正常肝细胞实时荧光定量PCR(图2A)和蛋白质印迹法(图2B)检测不同肝癌细胞及正常肝细胞中CSN5 的表达情况,结果表明:4 种肝癌细胞株中CSN5 mRNA 以及蛋白表达水平均明显均高于正常肝细胞(P<0.05)。
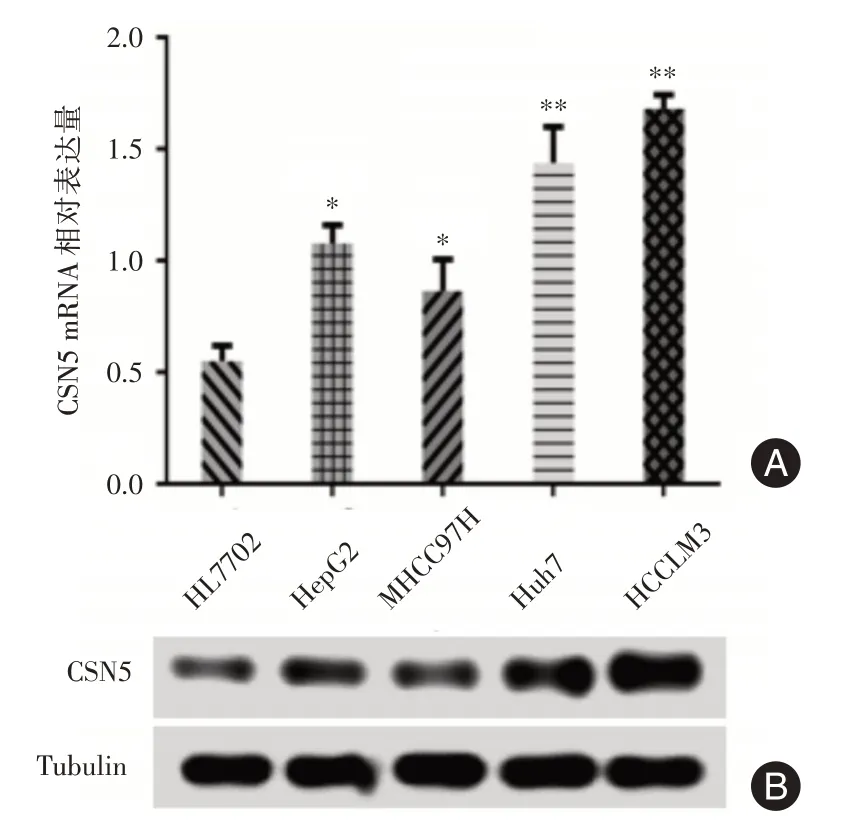
图2 CSN5 在HCC 细胞中的表达明显上调Fig.2 CSN5 expression in HCC cell lines is significantly increased
2.3 CSN5 表达与肝癌细胞的增殖密切相关实时荧光定量PCR 结果和蛋白质印迹法结果(图3A和3B)显示,在HCCLM3 细胞中干扰CSN5 的表达,CSN5 表达明显下调(P<0.001)。EdU 细胞增殖实验结果表明,在肝癌HCCLM3 细胞中,干扰CSN5后EdU 阳性细胞所占百分比较shNC 对照组明显降低(P<0.01,图3C)。
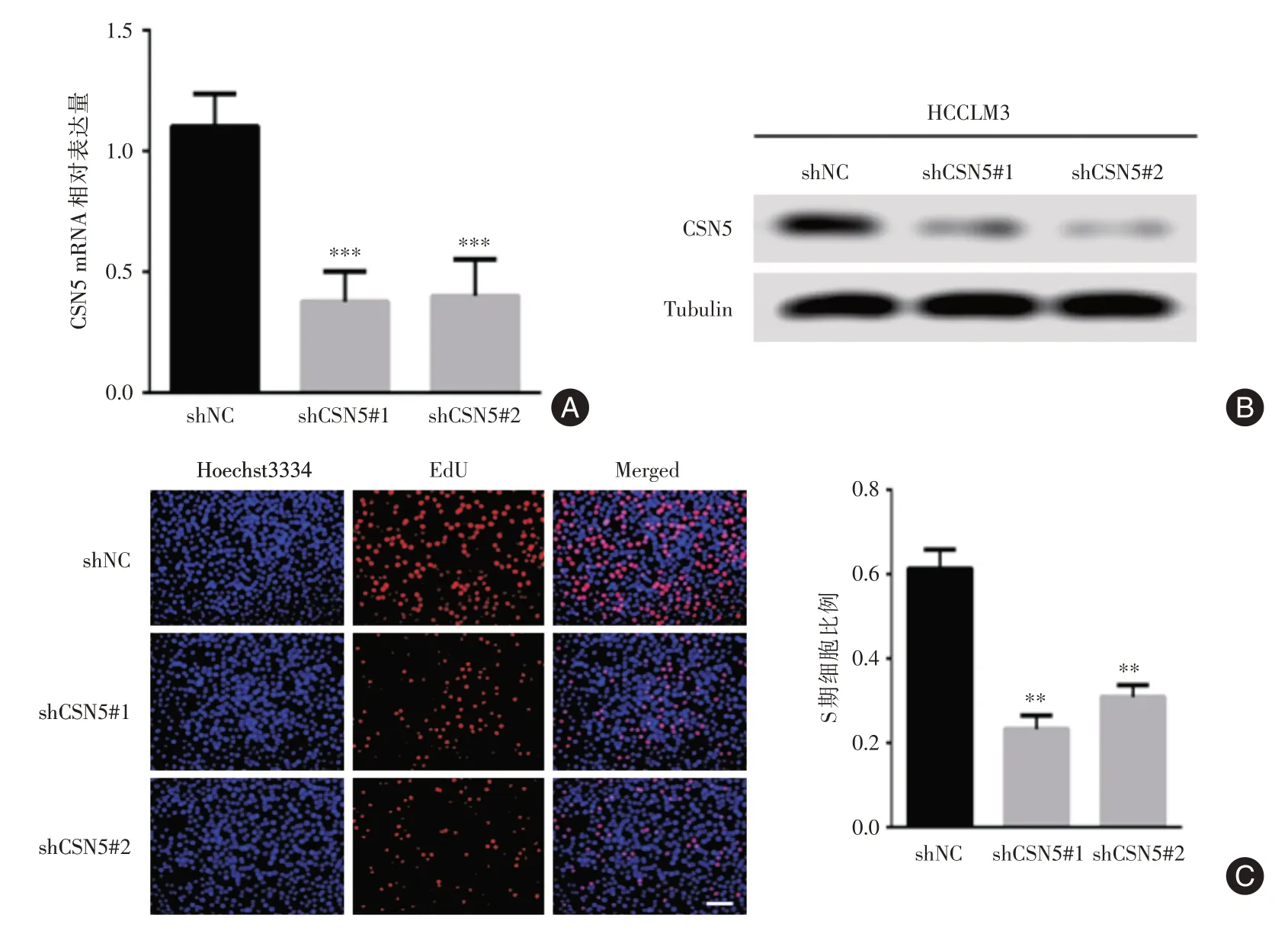
图3 干扰CSN5 的表达抑制HCC 细胞增殖Fig.3 CSN5 suppression inhibited HCC cell growth
2.4 CSN5 通过调节MAT2A 的表达进而影响肝癌细胞的增殖荧光定量PCR 结果(图4A 和4B)表明,在肝癌HCCLM3 细胞中干扰CSN5 的表达,CSN5 mRNA 和蛋白水平下调,MAT2A 蛋白水平也明显下降(P<0.01)。回复实验显示在MAT2A过表达的HCCLM3 细胞中,MAT2A 蛋白的表达明显升高,但是同时干扰CSN5 表达后,可逆转MAT2A 表达升高(图4C)。同时,EdU 细胞增殖试验表明,干扰CSN5 导致的肝癌细胞增殖能力的降低可以被MAT2A 过表达所回复(图4D)。

图4 CSN5 通过MAT2A 调节肝癌细胞增殖Fig.4 CSN5 regulates HCC cells proliferation through MAT2A
3 讨论
肝癌细胞增殖在原发性肝癌发生和发展中发挥重要作用,因此研究肝癌细胞增殖的分子生物学机制或许对肝癌的防治有重要意义。研究已表明CSN5 是一个癌基因并且在多种恶性肿瘤的发生发展扮演重要角色[13,16-17]。本研究通过检测HCC 病人的临床标本发现CSN5 在肝癌中的mRNA和蛋白表达明显高于癌旁组织。进一步研究发现,CSN5 在多株肝癌细胞中表达明显增加,下调肝癌细胞株CSN5 的表达可以明显抑制肝癌细胞的增殖能力。以上研究提示CSN5 在肝癌的发展过程中扮演促癌作用,或许可以作为一个潜在的肿瘤治疗靶点,但是其具体调控肝癌细胞增殖的机制尚未明确,有待进一步研究。
MAT2A 主要在肝脏疾病中广泛研究,并且研究[18-20]表明MAT2A 可以作为快速生长和去分化的标志。研究[21-22]表明特异性蛋白1(specificity protein 1;SP1)和p65 表达增高均可以促进MAT2A 过表达。然而,肝癌细胞中CSN5 与MAT2A 的表达关系仍未见报道。在本研究中,发现CSN5 可以调控MAT2A 的表达进而影响肝癌细胞的增殖。结果显示,通过干扰CSN5 在肝癌细胞中的表达,发现CSN5 下调可以抑制MAT2A 的表达进而抑制肝癌细胞的增殖能力。最后,通过回复实验,证实MAT2A 是CSN5 促进肝癌细胞增殖的关键分子。
综上所述,CSN5 可以通过调控MAT2A 表达促进肝癌细胞的增殖。本研究为进一步研究肝癌的增殖提供了新的理论基础,并为临床上肝癌的基因治疗提供了新的思路。然而本实验还具有一定的局限性,未探究CSN5 在肝癌细胞中调控MAT2A的具体机制,未进一步扩大对临床肝癌标本的检测并对肝癌病人的临床预后进行分析。针对本实验的不足,我们将进一步探究CSN5 通过何种方式调控MAT2A 的表达,进一步增加肝癌标本的检测,并对相关病人的预后信息进行归纳分析。

