党参种子EMS诱变条件分析
赵 塔, 王华磊, 李丹丹, 陈松树, 李金玲, 罗春丽
(贵州大学农学院, 贵阳 550025)
党参(Codonopsispilosula(Franch.) Nannf.)作为中国的一种传统补益类中药,别名臭参、棱子党参、古东根、土党参[1]。2015年版《中国药典》中规定其正品来源是桔梗科植物党参[Codonopsispilosula(Franch.) Nannf.]、素花党参[C.pilosulaNannf.var.modesta(Nannf.) L.T.Shen]或川党参(C.tangshenOliv.)的干燥根。党参味甘,性平,归脾、肺经,具有补中益气、养血生津、健脾益肺的功效。在临床上常用于食少倦怠、气血不足、心悸气短、内热消渴、脾肺气虚、咳嗽虚喘、面色萎黄、津伤口渴等症[2]。党参主要含有糖类、苷类、萜类聚炔类及生物碱等化学成分,具有促进造血机能、调节血糖、抗疲劳、抗肿瘤、增强机体免疫力、延缓衰老、保护胃肠道黏膜及调节胃收缩等多种药理作用[3]。党参在临床方面的应用较为普遍, 一般用于治疗心血管系统疾病、妇科疾病以及缓解应激反应造成的身体不适,还可作为辅助药物提高西药疗效、降低不良反应[4],具有较高的研究价值和开发前景。
诱变技术是实现种质资源创新的有效手段之一,其中化学诱变是指利用化学诱变试剂处理植物的组织器官,造成 DNA的缺失和修补,并借助基因突变或者基因重组引起有机体变异,从而创造新的种质[5]。EMS诱变具有点突变多、诱变频率高等优点,是目前最为有效的植物化学诱变技术之一[6]。 白戈等[7]通过EMS诱导云烟87烟草,从中筛选根系发达的突变体植株,获得了一份可稳定遗传的高烟碱KH 65突变体烟草材料。何佳越等[8]以多肉植物东云系Corderoyi 的花梗为外植体进行不同浓度 EMS 浸泡处理,再诱导分化培养,观察表型变异,进行突变体筛选,得到4类表型变异稳定、具有观赏价值的多肉植物突变体。张桂芳等[9]利用EMS溶液诱变处理广金钱草种子,对M1和M2代进行鉴定和筛选突变体,初步构建了EMS诱变广金钱草突变体库。EMS诱变技术还广泛应用于小麦[10]、豇豆[11]、黄瓜[12]和苦荞[13]等作物中。
目前,国内对党参的研究主要集中在化学成分、肥料以及药用疗效等方面,针对党参优良品种选育的相对较少。汪淑霞等[14]应用重离子辐照生物育种技术辐射诱变渭党1号,选育出党参新品系“渭党3号”;马璐琳等[15]对党参幼苗的上胚轴生长点和中胚轴分别进行三种不同时间的诱变处理,获得党参的同源四倍体植株;而马晓菲等[16]则以EMS 处理轮叶党参的离体叶片和愈伤组织对其进行诱变,选出具有较高皂苷含量的初选植株,并为无性系变异的方法增产轮叶党参药用成分提供了证据。
本试验用EMS诱变技术处理党参种子,开展EMS不同浓度及诱变时间对党参种子萌发影响的研究,确定党参种子诱变的适宜浓度和处理时间,同时得出EMS的诱变对党参种子萌发和党参种子芽生长的影响趋势,为开展党参EMS突变育种提供重要参考依据,为创新党参种质资源以及选育党参新品种奠定基础。
1 材料与方法
1.1 材 料
1.1.1试验材料
党参(Codonopsispilosula(Franch.)Nannf.)种子。
1.1.2EMS溶液的配置
称取Na2HPO4·12 H2O 35.82 g,用ddH2O定容于1 000 mL容量瓶中,作为母液A;称取NaH2PO4·2 H2O 15.61 g,用ddH2O定容于1 000 mL容量瓶中作为母液B。吸取610 mL母液A 与390 mL母液B 于1 000 mL容量瓶中混合,即得0.1 mol·L-1pH值7.0的磷酸缓冲溶液(PBS),以该缓冲溶液作为溶剂,配置成不同浓度的EMS溶液(0,1%,2%,3%,4%,5%)。
1.2 试验设计
以党参种子为材料,用不同浓度EMS(0,1%,2%,3%,4%,5%)处理党参种子6 h、8 h、12 h和24 h,每个处理3个重复,共72个处理。
1.3 试验方法
用水清洗党参种子,水选下层党参种子,每个处理100粒,用无菌水浸泡6 h,用滤纸吸干种子表面水分,分别用不同浓度的EMS溶液浸种相对应的时间后取出,EMS废液用Na2S2O3溶液处理。将党参种子用流水冲洗3 h,吸干种子表面水分,放置在已浸湿滤纸的培养皿中,25 ℃ 黑暗条件培养。
1.4 测定指标
每天观察种子发芽情况,及时补充水分,并去除霉变感菌的种子。7 d计算发芽势,实验结束计算发芽率,测量党参种子芽长。
发芽率(%)=(发芽总数/供试种子总数)×100%;
相对发芽率(%)=(处理萌发率/对照萌发率) ×100%;
发芽势(%)=(7 d发芽种子数/供试种子总数) ×100%。
1.5 数据处理
使用Excel软件整理数据及制表,SPSS 22.0软件分析结果。
2 结果与分析
2.1 不同浓度EMS和诱变时间对党参种子发芽率和相对发芽率的影响
由图1及表1可知,同一处理时间下,随着EMS浓度的升高,各处理的发芽率逐渐减小,相对发芽率逐渐下降,且EMS浓度在2%以上的各处理发芽率和相对发芽率都显著小于对照组。8 h和12 h处理条件下,分别在EMS浓度为2%、3%时,发芽率降为0,而6 h处理EMS浓度为0的发芽率为43.33%,EMS浓度为5%发芽率下降到6.84%,降幅36.49%,相对发芽率降幅84.21%;24 h处理条件下EMS浓度为0的发芽率为43.00%,EMS浓度为5%的发芽率下降到2.41%,降幅40.59%,相对发芽率降幅94.40%。同一EMS浓度处理下,各处理的发芽率随着诱变时间增加先减小再逐渐升高;各处理的相对发芽率(除了1% EMS)随着诱变时间增加先逐渐降低再逐渐升高。1%~5% EMS浓度下,不同诱变时间对党参种子发芽率有显著差异。在3%~5%EMS浓度下,随着诱变时间变化,发芽率随着时间的增加而逐渐降低再逐渐升高。在1% EMS浓度下,不同诱变时间对党参种子相对发芽率影响差异不显著;在2%~5% EMS浓度下,不同诱变时间显著影响党参种子相对发芽率。

图1 EMS 浓度与处理时间对党参种子发芽率的影响Fig.1 Effects of combinations of EMS concentration and treatment time on germination rate of Codonopsis pilosula(Franch.)Nannf. seeds
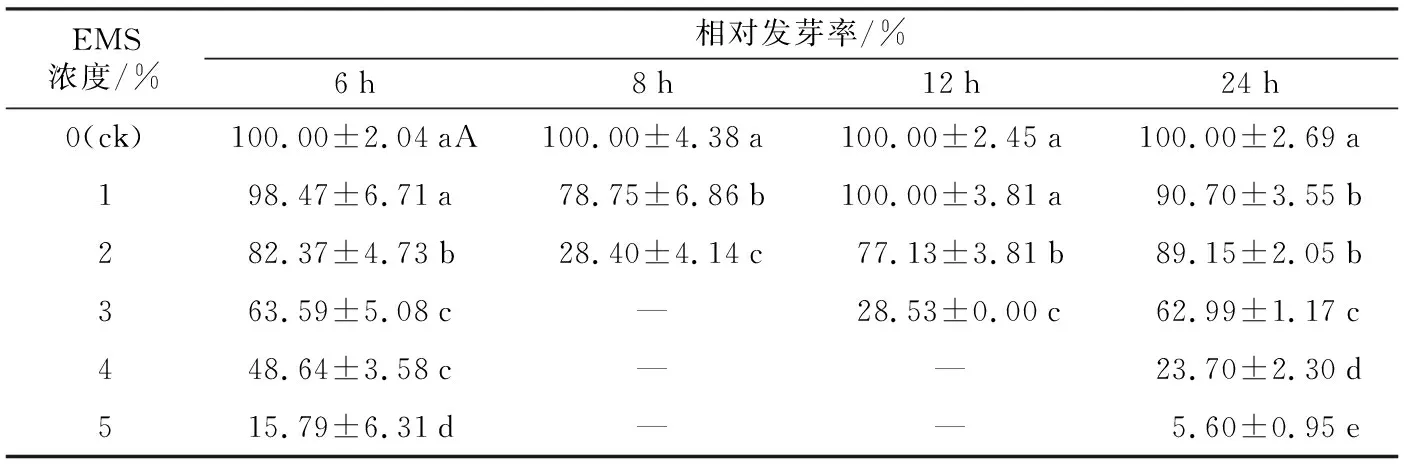
表1 EMS浓度与处理时间对党参种子相对发芽率的影响
由此可见,发芽率和相对发芽率受诱变时间和EMS浓度的影响。其中EMS抑制党参种子的发芽,随着EMS浓度的升高,对党参种子的发芽抑制作用越强,即高浓度EMS(3%~5%)对党参种子发芽抑制作用比低浓度(1%~2%)对党参种子发芽抑制作用强。但是,在同等浓度中,随着抑制作用的增强,也仅有8 h和12 h处理时间下出现发芽率和相对发芽率为0的情况。
2.2 不同浓度EMS和诱变时间对党参种子发芽势的影响
由表2可得,同一处理时间下,各处理的发芽势随着EMS浓度的升高逐渐降低。6 h、12 h和24 h时间处理下,2%EMS浓度或更高浓度时的发芽势均分别显著低于ck,8 h处理时间下各处理的党参种子的发芽势都显著低于ck。同一处理浓度下,各处理的发芽势随着诱变时间的增加逐渐降低再升高。随着EMS浓度的升高,2%EMS浓度处理8 h,3%EMS浓度处理8 h和12 h,4%EMS浓度处理6 h、8 h、12 h和5%EMS浓度各处理时间的发芽势均为0。发芽势可体现党参种子的发芽活力,诱变剂EMS可以降低党参种子的活力,并抑制党参种子的发芽。随着EMS浓度的升高,EMS对党参种子发芽活力降低的程度就越大,即抑制程度随EMS的剂量增加而增大,直至5% EMS浓度各处理时间的发芽势都为0。

表2 EMS 浓度与处理时间对党参种子发芽势的影响
2.3 不同浓度EMS和诱变时间对党参种子发芽进程的影响
同一EMS浓度下,发芽起始时间、发芽持续时间和发芽时间显著受到诱变时间的影响。同一诱变时间处理下,发芽起始时间、发芽持续时间和发芽时间显著受到EMS浓度的影响(图2)。随着EMS浓度的升高,各处理的发芽起始时间逐渐增加,发芽持续时间逐渐减少,所需发芽时间也随之延长。在8 h诱变处理中的3%~5%EMS和12 h诱变处理中的4%~5%EMS处理的党参种子未发芽。本试验中,5% EMS处理党参种子24 h所需发芽时间最长,需13.33 d才开始发芽,相对于ck,延长了12.33 d; 5%EMS处理党参种子24 h的持续发芽时间最短,为1.00 d,相对于ck缩短了9.67 d;而发芽时间最长的是3%EMS处理党参种子24 h,为14.67 d,相对于ck延长了3 d。
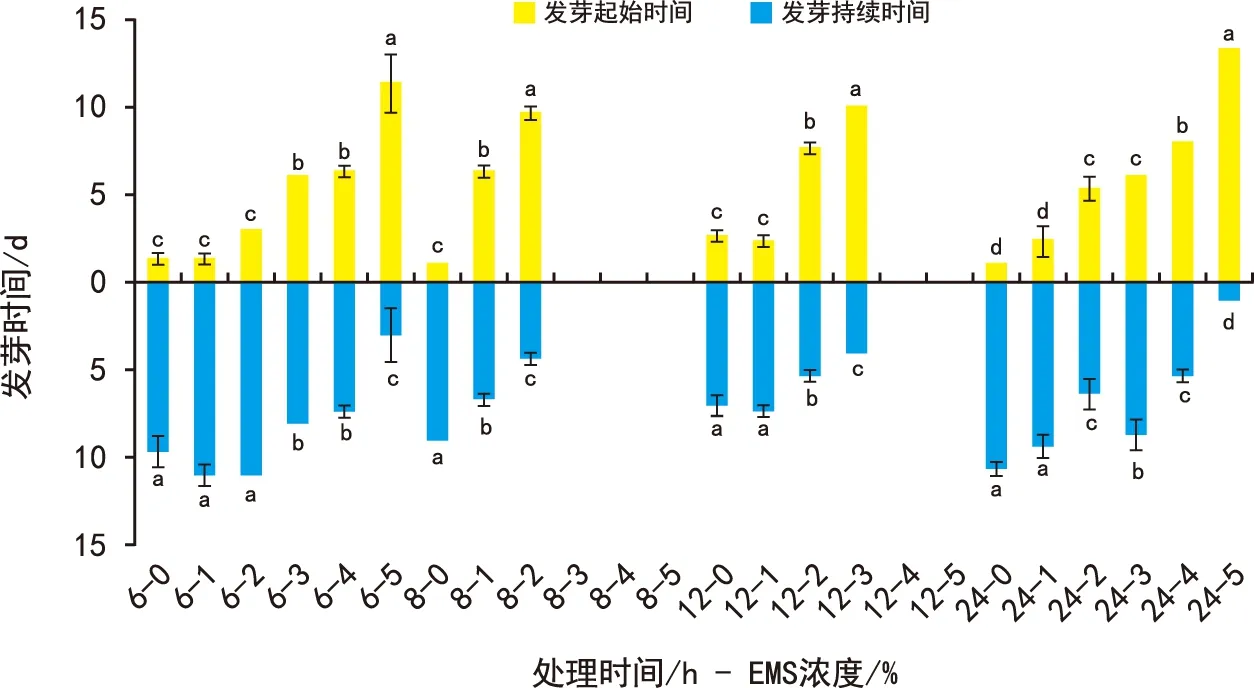
图2 EMS 浓度与处理时间组合对党参种子发芽进程的影响 Fig.2 Effects of combinations of EMS concentration and treatment time on germination process of Codonopsis pilosula(Franch.) Nannf. seeds
由此可得,在EMS浓度和诱变处理时间的作用下,随着EMS浓度的增加,发芽起始时间延长,发芽持续时间减少,发芽时间延长,说明EMS会抑制党参种子的发芽,缩短党参种子的发芽持续时间,延长了党参种子的发芽进程。
2.4 EMS浓度对党参种子芽长的影响
同一处理浓度下(除0 EMS),党参种子的芽长随着处理时间的增加呈先降低后增加的趋势(图3)。同一诱变处理时间下,不同EMS浓度对党参种子的芽长有极显著的抑制作用,随着EMS浓度的升高,党参种子的芽长逐渐降低,并且各处理的芽长都显著低于ck。其中处理时间为6 h对党参种子的芽长影响较小,相对于对照组EMS浓度对芽长抑制作用为60.87%,芽长由27.60 mm抑制为10.80 mm;处理时间为8 h,EMS浓度对党参种子芽长抑制作用最强,在3% EMS的条件下高达100%;而处理时间为12 h,在4% EMS条件下对党参种子芽长抑制作用为100%。

图3 EMS 浓度对党参种子芽长的影响Fig.3 Effects of EMS concentration on bud length of Codonopsis pilosula(Franch.) Nannf. seeds
2.5 不同浓度EMS和诱变时间对党参种子发芽率影响的方差分析
从表3可知,不同EMS浓度对党参种子的发芽率和芽长存在极显著影响(p<0.01),不同处理时间对党参种子发芽率和芽长也有极显著影响,而且EMS浓度和处理时间的交互作用对党参种子的发芽率及芽长也有极显著的影响。EMS浓度、诱变时间以及EMS浓度和诱变时间的相互作用是影响党参种子发芽率、芽长的主体因素,因此在对党参种子进行EMS 诱变时,必须综合考虑 EMS 浓度和诱变时间对诱变效果的影响。
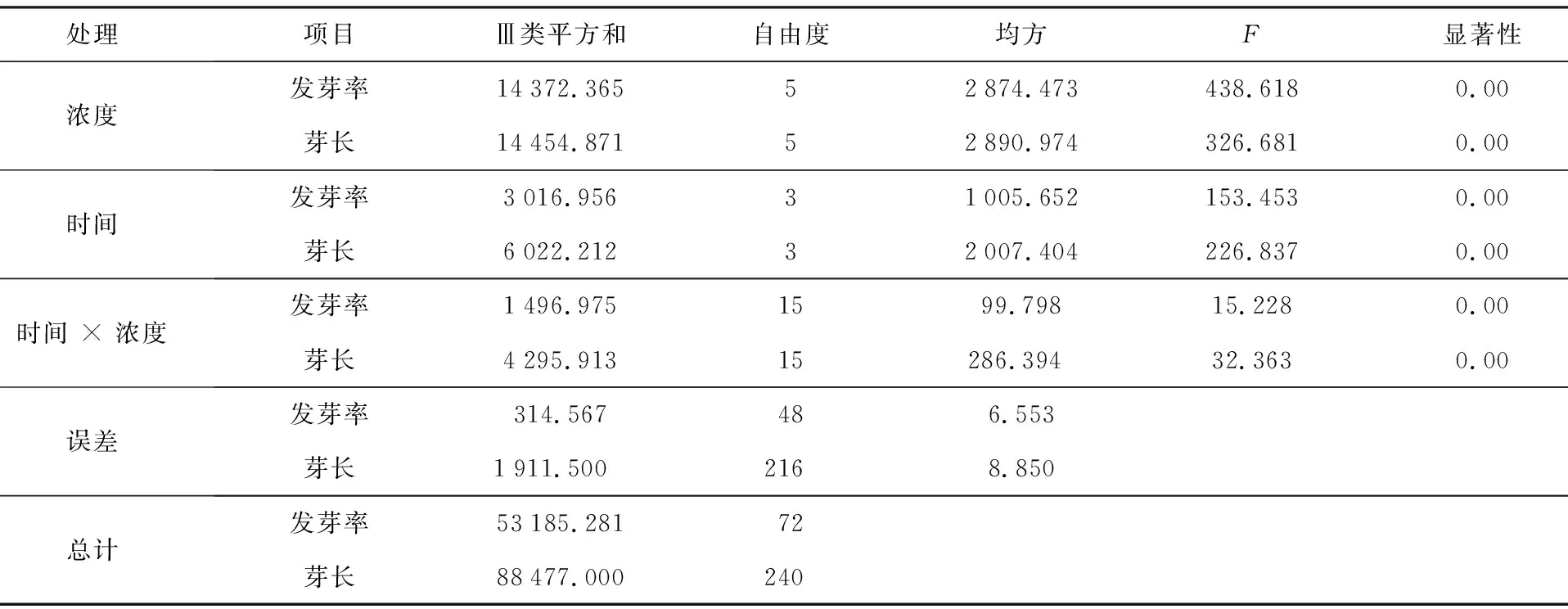
表3 不同浓度EMS和诱变时间对党参种子发芽率、芽长影响的方差分析
3 结 论
用EMS对植物进行诱变育种,选择适宜诱变条件很关键。通过对党参种子进行不同EMS浓度和不同时间的化学诱变,发现EMS对党参种子的发芽有明显的抑制作用,在8 h、12 h和24 h处理条件下,随着EMS浓度升高,各处理的相对发芽率未出现接近50%值,故没有适宜的EMS诱变条件。而在6 h处理条件下,当EMS浓度为4%时,发芽率为21.07%,相对发芽率为48.64%,接近半致死率,故党参种子的最佳EMS诱变浓度和诱变时间分别为4%和6 h。
4 讨 论
EMS会抑制种子的萌发。杨森等[17]研究表明,随着EMS浓度增加,紫苏种子的发芽势和发芽率均呈下降趋势,即诱变剂EMS对紫苏种子的发芽势和发芽率可产生抑制作用。本研究利用不同浓度的EMS对党参种子进行诱变处理,发现EMS显著抑制党参种子的发芽,随着EMS浓度升高,发芽率和发芽势减小,并且发芽起始时间延长,发芽持续时间减少,发芽时间延长,即起始发芽时间和发芽时间与EMS浓度呈正相关,与发芽率、发芽势和发芽持续时间呈负相关,这与安佰义等[18]用EMS诱变白桦种子结论相似,但是不同之处是白桦种子的发芽时间随着EMS浓度升高而降低。其原因有可能是EMS对不同植物种子有不同诱变效应所致,降低党参种子活力,使得党参种子的起始发芽时间延长较长。EMS诱变对党参种子起始发芽时间延长,持续发芽时间缩短,使得党参种子发芽不整齐,说明EMS在一定程度上会抑制党参种子的发芽进程。
同一EMS浓度的条件下,在3% EMS处理党参种子8 h时率先出现发芽率为0的情况,而3% EMS条件下的12 h和24 h的发芽率分别是9%和27.09%;4%、5% EMS条件下8 h和12 h的发芽率都为0,24 h的发芽率分别为10.19%和2.41%,其结果可能是浸泡时间过长导致。水分是影响种子萌发的重要因素之一,在种子细胞中的自由水增加到足够才能使细胞呼吸作用和新陈代谢加快,酶被活化进行反应,从而促进种子的萌发[19-21]。在浸泡过程中,随着EMS逐渐渗入党参种子胚中,对党参种子的发芽却有抑制作用。在两者的综合作用下,水分对党参种子发芽的促进作用强于EMS对党参种子发芽的抑制作用,导致党参种子在3%~5% EMS浓度下诱变处理24 h还能发芽,具体原因还需进一步验证。
目前,EMS诱变技术是一项国内外成熟的植物化学诱变技术,而EMS 作为构建突变体育种的重要诱变试剂,诱变条件选择最为关键[22]。EMS对种子的萌发有抑制作用,不同浓度的EMS和诱变处理时间对种子的发芽率、发芽势有不同的影响,并且EMS对不同种子发芽率、发芽势的影响也不同,故而EMS处理不同材料的最佳浓度和最佳诱变时间也不同。例如杨楠等[23]以知母种子为材料,得出6% EMS 浸种 12 h 和 24 h为知母的最佳诱变浓度和时间;杨森等[17]以奇苏3号紫苏品种为材料进行EMS诱变,得出1.25%浓度处理8 h是诱变紫苏种子的最佳条件;杨玉双等[24]以橡胶草品系CXCH 的种子为材料,对其进行EMS化学诱变,最终确定0.30% 诱变处理12 h为橡胶草种子最适宜诱变条件。本试验研究中党参种子的最佳EMS诱变浓度为4%、诱变时间为6 h。在EMS诱变中,EMS的浓度和诱变时间对植物材料的诱变效应是叠加的,在进行适合浓度和时间的筛选时,可根据实际情况进行挑选。如胡志峰等[25]最终确定,0.9%EMS诱变处理6 h和0.7%EMS诱变处理9 h的组合为金花菜种子最佳诱变条件,在进行诱变时就可考虑自身试验条件,对试验材料进行高浓度的短时间处理或者低浓度的长时间处理。
通过对党参种子不同EMS浓度的诱变研究,表明EMS诱变处理党参种子对其种子芽长有明显的抑制作用,这与伊风艳等[26]的结果类似。而EMS浓度抑制了党参种子的芽长,随着浓度的升高,抑制作用越强,芽长逐渐变短,这与臧辉[27]对羊草种子的研究结果类似。在3% EMS条件下处理8 h和4% EMS条件下处理12 h党参种子不发芽,这可能是由于诱变剂对于不同植物的诱变效应不同造成的。

