干旱胁迫对侧金盏花生理特性的影响
陈翠红,周蕴薇,李家绮,杨丰瑞,白 云,陈丽飞
(吉林农业大学园艺学院,吉林 长春 130118)
0 引言
【研究意义】侧金盏花(Adonis amurensis)是毛茛科侧金盏花属多年生草本植物,分布于我国东北地区,侧金盏花耐寒性强,在冰雪未融化之际便可开放,可作为一种良好早春花卉,其花姿优雅、花色艳丽、花期较长,是园林绿化、美化的良好材料。我国北方多为干旱、半干旱地区,且大部分地区水分供应不足,严重影响了城市园林植物的观赏特性、园林应用价值及正常养护,为此研究植物在干旱逆境中的生态适应性及其评价机制,对干旱地区植被恢复及改善城市生态环境具有重要意义。【前人研究进展】关于植物干旱胁迫研究亦相继展开,例如干旱胁迫会使植株叶片出现气孔闭合、光合作用减弱等反应,从而引发植物体在渗透调节、酶保护体系等方面的变化,使植物体内平衡的自由基稳态遭到破坏[1]。目前关于侧金盏花的研究主要集中在传粉特性[2]、基因获取[3]及药用研究[4]等方面。【本研究切入点】对侧金盏花生态适应性及园林应用方面研究较少,仅有少量的生理生化指标探究,目前缺少对侧金盏花系统的研究,其生理特性以及光合研究特性尚不明晰。【拟解决的关键问题】为此本研究通过盆栽控水试验,研究不同水分条件对侧金盏花形态、生理及光合特性的影响,旨在探讨侧金盏花的耐旱性,为今后侧金盏花的水分管理及栽培利用等方面提供理论依据。
1 材料与方法
1.1 试验材料
试验材料为长白山野生侧金盏花植株,将引种后的侧金盏花植株移栽到塑料花盆中,每盆2株,花盆规格为盆高28 cm,上口径26 cm,下口径24 cm,栽培基质为园土∶草炭∶沙子为3∶2∶1的混合基质。每盆土质量为(1.8±0.2) kg,置于温室内生长,期间进 行正常肥水管理。
1.2 试验方法
试验期间温室昼夜均温分别为23℃、12 ℃,平均相对湿度为37%。待叶片全部展开,选取长势一致、生长良好的植株进行干旱胁迫处理。试验设干旱(试验处理前充足灌水3 d使土壤水分饱和,使其自然干旱,停水0、4、8、12、16 d)、复水(干旱胁迫4、8、12、16 d后对植株进行复水)2个处理,以正常水分管理(70%±5%)为对照(CK)。分别在干旱处理0、4、8、12、16 d和复水处理4 d后进行观测,每个处理50盆,3次重复,相关指标测定均为3次重复。
1.3 测定项目
土壤相对含水量[5];株高、地上和地下部分干重、鲜重;复水后存活率[6](存活植株数量/总植株数量×100%);叶片相对含水量[7]。
生理指标:丙二醛(MDA)含量[5]、相对电导率[8]、脯氨酸(Pro)含量[9]、可溶性糖含量、可溶性蛋白含量、过氧化物酶(POD)活性[5]、超氧化物歧化酶(SOD)活性、叶绿素(Chl)总量[10]。
光合参数:选取晴朗无风的天气,使用CIRAS-2光合仪测定,测定指标为净光合速率(Pn)、蒸腾速率(Tr)、胞间二氧化碳浓度(Ci)、气孔导度(Gs)等光合参数;使用FmS2型脉冲调制式叶绿素荧光仪,测定侧金盏花叶片光适应下的最小荧光(Fo′)、最大荧光(Fm′)、稳态荧光(F′)和可变荧光(Fv′),再进行充分暗适应30 min以上,测定其暗适应下的初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv),并计算光系统Ⅱ(PSⅡ)最大光化学量子产量(Fv/Fm)、PSⅡ潜在活性(Fv/Fo)、PSⅡ实际光化学量子产量(ΦPSⅡ)、光化学猝灭系数(qP)、非光化学猝灭(NPQ)和表观光合电子传递速率(ETR)[11−13]等荧光 参数。
1.4 统计方法
测定相关指标后,使用Excel 2010对数据进行整理 ,采用IBM SPSS 20.0进行数据统计分析。
2 结果与分析
2.1 干旱胁迫下土壤相对含水量的动态变化
由表1可知,随胁迫时间的增加,土壤相对含水量逐渐下降,且干旱各处理差异显著(P<0.05),胁迫8 d后,土壤相对含水量均下降至30%以下,到16 d时仅为20.4%;复水后,干旱各处理均恢复到对照,但由于 控水可能导致土壤结构改变,因此与对照略有差异。

表1 侧金盏花不同水分状况土壤相对含水量的变化Table 1 Variation on relative moisture content of A. amurensisgrowing soil under varied watering conditions
2.2 干旱胁迫及复水对侧金盏花生长的影响
由表2可知,侧金盏花地上及地下部分生物量随干旱胁迫程度的加大而明显下降,干旱4 d时,其地上及地下部分生物量下降较少,当干旱8、12和16 d,与干旱0 d相比,侧金盏花地上及地下部分鲜质量下降33.05%、37.32%、46.9%和21.8%、41.56%、44.18%,地上及地下干质量下降41.53%、47.43%、52.35%和31.3%、50.94%、60.72%,干旱12、16 d地上鲜质量差异显著(P<0.05),干旱8、12 d地下鲜质量具有显著差异(P<0.05)。
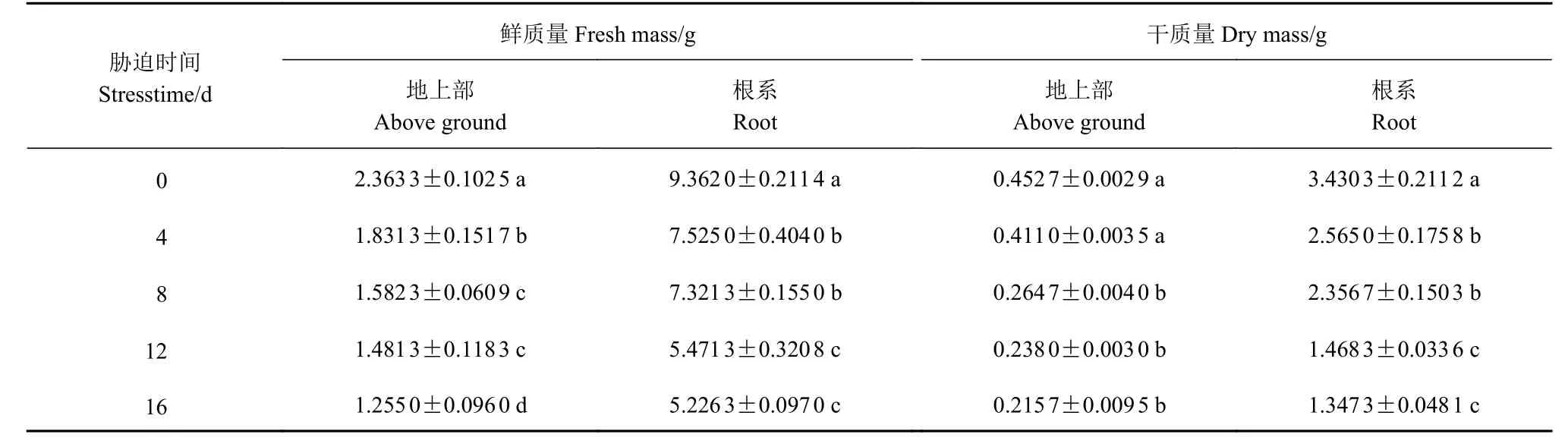
表2 干旱胁迫下侧金盏花生物量的变化Table 2 Variation on biomass of A. amurensis grown under drought stress
由表3可知,当侧金盏花遭受干旱时,随土壤相对含水量的减少,其平均株高呈下降趋势。干旱0~8 d,株高降幅较明显,各处理差异达显著水平(P<0.05),恢复供水后,干旱4 d的株高有所增加,但仍显著低于对照(P<0.05),干旱8、12、16 d复水前后变化不显著(P>0.05)。
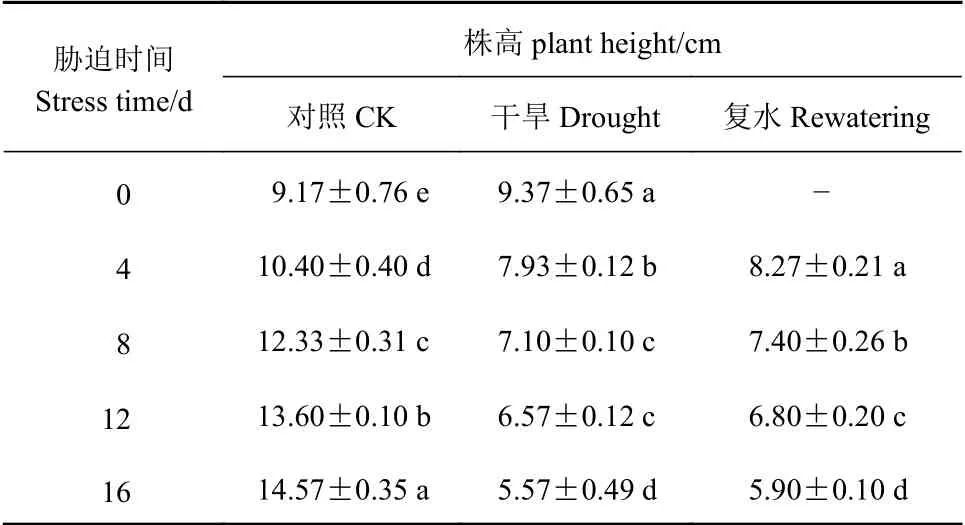
表3 侧金盏花不同水分状况株高的变化Table 3 Variation on plant height of A. amurensis grown under varied watering conditions
2.3 干旱胁迫及复水对侧金盏花形态及复水后存活率的影响
由表4可知,将侧金盏花进行不同程度胁迫处理,其地上部分形态变化主要表现为叶片下垂,边缘卷曲、皱缩和干枯。干旱4 d,叶片表现出轻微萎蔫现象,复水后,其外观形态恢复正常,成活率为100%;胁迫8 d,叶片皱缩并出现萎蔫下垂现象,复水后,外观基本恢复正常,仅茎尖处有少量枯黄萎蔫,复水后,成活率为100%;胁迫至12 d,叶片出现严重皱缩,萎蔫下垂,地上部分出现干枯现象,此时进行复水,部分植株可恢复生命力,成活率为50.67%;干旱16 d,大多数植株死亡,复水后成活率仅为6.35%。
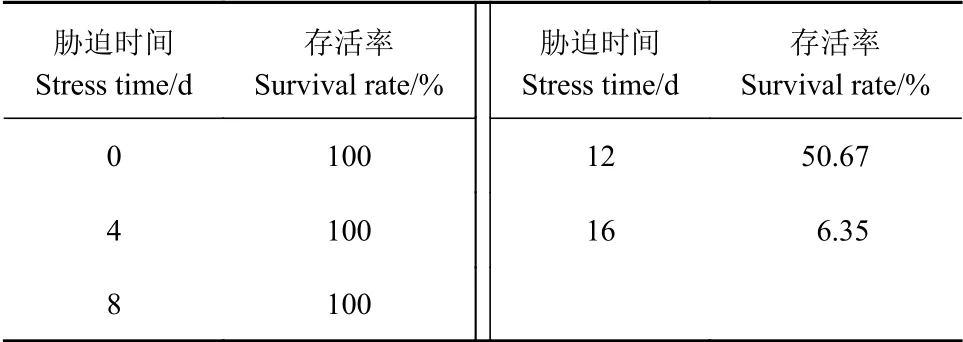
表4 侧金盏花不同干旱胁迫时间复水后存活率Table 4 Survival rate of Adonis amurensis after rehydration under different drought stress times
2.4 干旱胁迫及复水对侧金盏花叶片相对含水量的影响
由表5可知,随干旱程度加深,侧金盏花叶片相对含水量逐渐下降,胁迫第16 d时达到最小值44.62%,比对照显著下降49.62%(P<0.05),干旱8、12 d,与对照相比,叶片相对含水量降低24.86%、42.73%,均显著低于对照和复水处理(P<0.05);复水后,叶片相对含水量均有不同程度的恢复。
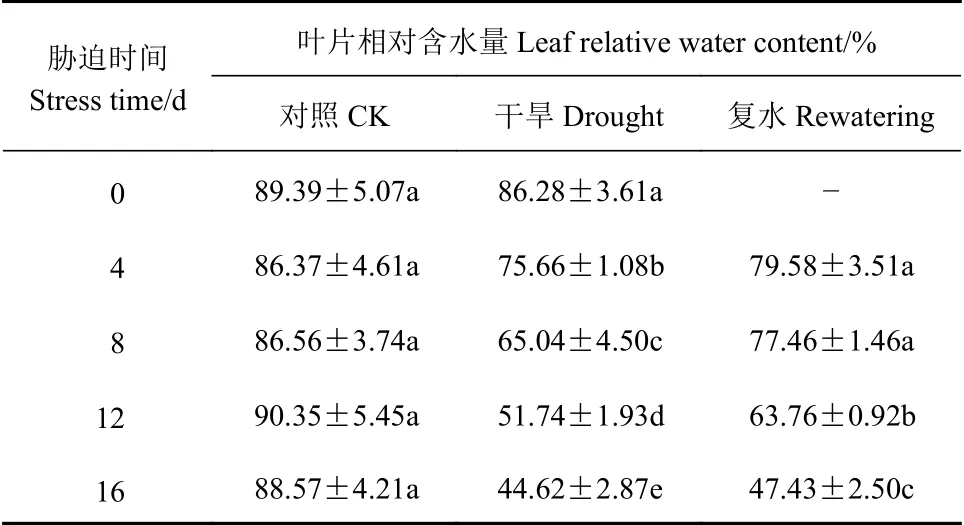
表5 侧金盏花不同水分状况叶片相对含水量的变化Table 5 Variation on leaf relative moisture content of A.amurensis grown under varied watering conditions
2.5 干旱胁迫及复水对侧金盏花生理指标的影响
2.5.1 干旱胁迫及复水对侧金盏花叶绿素总量的影响
由表6可知,随干旱胁迫持续进行,侧金盏花叶片叶绿素总量呈下降趋势,胁迫8~16 d,各处理差异显著(P<0.05)。胁迫4 d,叶绿素总量比对照下降10.07%,显著低于对照(P<0.05);干旱8 d,较对照显著降低14.27%(P<0.05),干旱12、16 d,比对照分别降低25.85%、34.68%;干旱8、12、16 d复水后,叶绿素总量有所上升,比复水前分别上升8.7%、4.81%、4.3%。

表6 侧金盏花不同水分状况叶绿素总量的变化Table 6 Variation on chlorophyll in leaves of A. amurensis grown under varied watering conditions
2.5.2 干旱胁迫及复水对侧金盏花渗透调节物质含量的影响 不同水分处理下,侧金盏花Pro含量不同,由表7可知,干旱处理下,Pro含量呈先升后降趋势,各处理差异显著(P<0.05),干旱至12 d,Pro含量达最大值,干旱8、12、16 d分别比对照增加2.24、2.41、2.27倍,显著高于对照与复水处理(P<0.05);复水后,Pro含量有所下降,干旱4 d复水后其含量恢复至对照,干旱8、12、16 d复水后比干旱处理分别下降16.07%、19.22%、31.15%,表明侧金盏花细胞膜透性得到一定恢复,方差分析表明,干旱8、12、16 d复水后各处理差异显著(P<0.05)。

表7 侧金盏花不同水分状况脯氨酸含量的变化Table 7 Variation of proline content in A. amurensis grown under varied watering conditions
由表8可知,侧金盏花随干旱时间的增加,可溶性糖含量逐渐增大,干旱处理前12 d,各处理差异显著(P<0.05),干旱8、12、16 d比对照分别增加87.60%、100.48%、103.09%;复水后,可溶性糖含量下降,干旱4 d复水后略高于对照,表明质膜受伤害程度减少,胁迫12、16 d复水后,与干旱组相比,可溶性糖含量分别下降8.09%、8.19%。
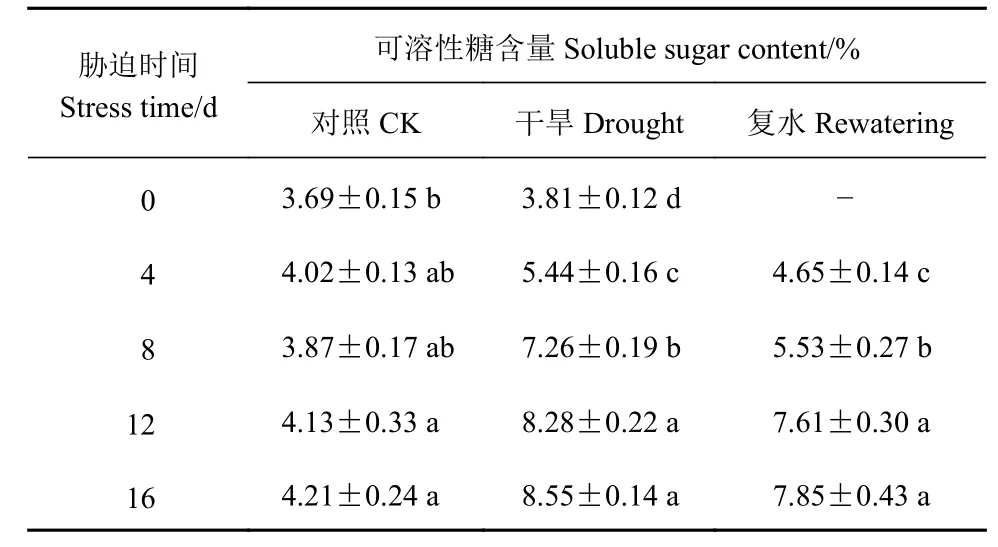
表8 侧金盏花不同水分状况可溶性糖含量的变化Table 8 Variation on soluble sugar content in A. amurensis grown under varied watering conditions
从表9可知,侧金盏花在干旱处理下,可溶性蛋白含量呈下降趋势。干旱16 d,可溶性蛋白含量最低,比对照下降78.15%,复水后其含量恢复至对照的37.86%,说明干旱使蛋白质合成受阻,植物受损严重,而复水使可溶性蛋白含量得到一定恢复。胁迫4 d复水后其可溶性蛋白含量与对照无显著差异(P>0.05),方差分析表明,胁迫12、16 d各处理差异显著(P<0.05)。
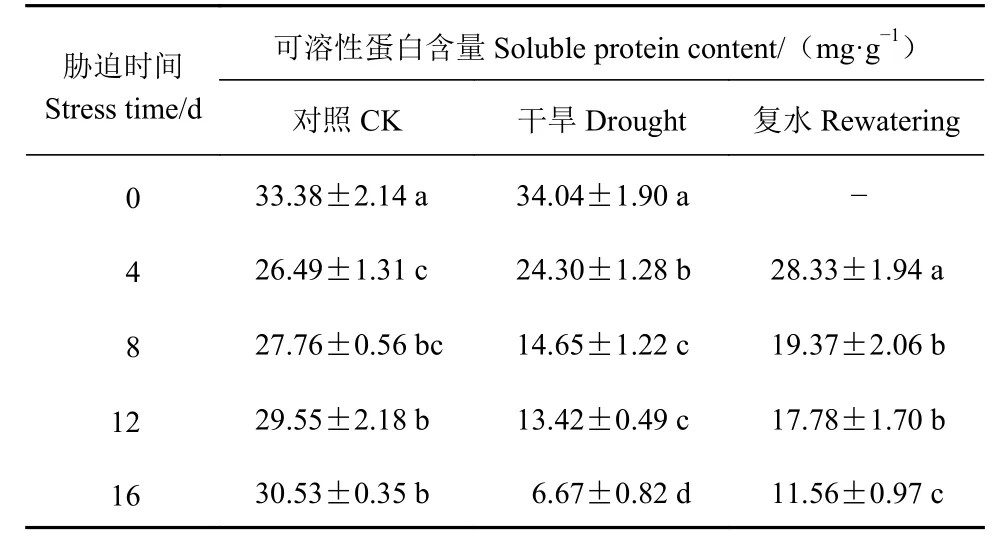
表9 侧金盏花不同水分状况可溶性蛋白含量的变化Table 9 Variation on soluble protein content in A. amurensis grown under varied watering conditions
2.5.3 干旱胁迫及复水对侧金盏花MDA含量、叶片相对电导率的影响 由表10可知,随干旱程度增加,侧金盏花MDA含量逐渐升高,且各处理差异显著(P<0.05)。胁迫至16 d达到最大值,比对照增加2.59倍,显著高于对照与复水处理(P<0.05),复水过程中,MDA含量有所降低,干旱8 、12 d复水后差异显著(P<0.05),胁迫8 、12 、16 d复水后,MDA含量较干旱组分别下降12.31%、31.35%、36.62%,仍显著高于对照(P<0.05),干旱16 d复水后MDA含量为对照的2.28倍,表明干旱胁迫程度严重时,复水虽使MDA含量有所下降,但仍处于较高水平。
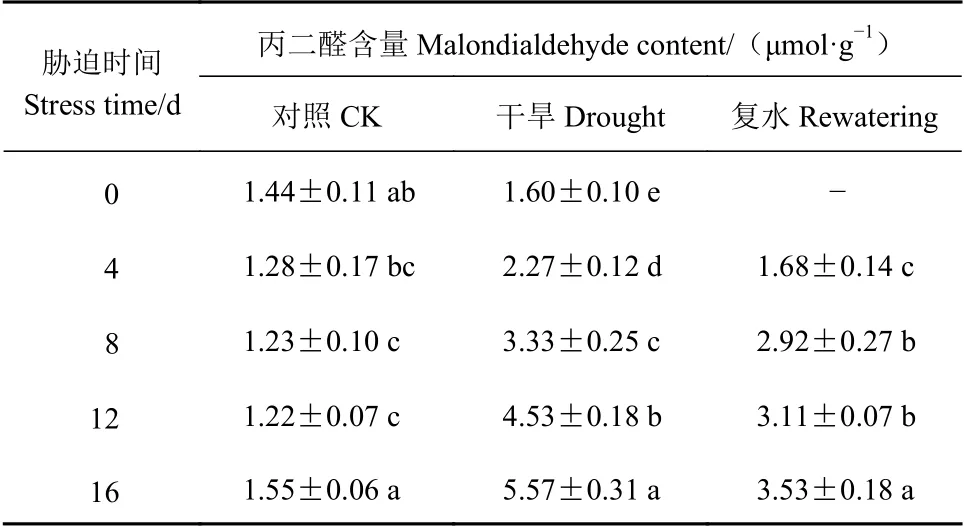
表10 侧金盏花不同水分状况丙二醛含量的变化Table 10 Variation on malondialdehyde content in A. amurensis grown under varied watering conditions
由表11可知,在干旱胁迫下,侧金盏花叶片相对电导率逐渐增加,各处理差异达显著水平(P<0.05),与对照相比,干旱第8 、12 、16 d分别上升51.03%、102.04%和180.78%,均显著高于对照(P<0.05),第16 d时达到最大值;复水后,膜透性均有所恢复,干旱4 、8 d复水后叶片相对电导率略高于对照,干旱16 d复水后是对照的2.09倍,显著高于对照(P<0.05)。

表11 侧金盏花不同水分状况相对电导率的变化Table 11 Variation on relative electric conductivity of A.amurensis grown under varied watering conditions
2.5.4 干旱胁迫及复水对侧金盏花抗氧化保护酶的影响 由表12所示,干旱处理下,POD活性高于对照和复水处理,呈先升后降趋势,各处理差异显著(P<0.05),侧金盏花植株受迫4~8 d时,POD活性上升,胁迫8 d时,比对照显著提高2.3倍,(P<0.05),胁迫12 ~16 d,其活性下降,比对照分别上升121.57%、56.42%,显著高于对照与复水处理(P<0.05);复水后,POD活性降低,各处理差异显著(P<0.05),干旱4 d复水后其活性与对照相比无显著差异(P>0.05),胁迫8、12、16 d复水后,POD活性较复水前分别下降23.60%、25.85%和13.57%,仍显著高于对照(P<0.05)。

表12 侧金盏花不同水分状况过氧化物酶活性的变化Table 12 Variation on peroxidase activity of A. amurensis grown under varied watering conditions
由表13可知,随胁迫程度加大,侧金盏花SOD活性呈先升后降趋势,胁迫0~4 d SOD活性上升趋势不明显,说明前期侧金盏花可通过调节SOD活性来平衡活性氧代谢、保护膜结构,对外界不良环境进行抵御,胁迫12 d达到最大值,比对照显著增加58.31%(P<0.05);复水后SOD活性下降,干旱4 d复水后略高于对照,胁迫12、16 d复水后其活性较复水前下降23.75%、15.11%。
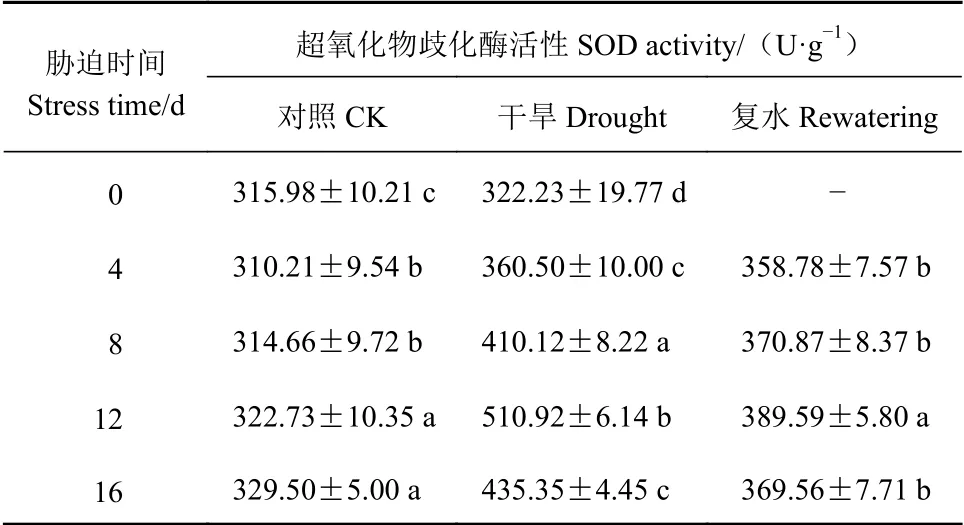
表13 侧金盏花不同水分状况超氧化物歧化酶活性的变化Table 13 Variation on superoxide dismutase activity of A.amurensis grown under varied watering conditions
2.6 干旱胁迫及复水对侧金盏花叶片光合参数的影响
由图1可知,侧金盏花叶片Pn、Tr、Gs、Ci随着干旱胁迫时间的延长逐渐降低。胁迫8、12、16 d,与对照相比,Pn分别下降22.11%、50.46%、53.81%,干旱12、16 d复水后,Pn较干旱处理分别上升17.76%、8.24%;胁迫8、12和16 d,Tr较对照分别下降20.77%、63.58%、82.92%,复水后Tr有所恢复;干旱8、12和16 d时,G较对照分别下降15.23%、42.74%、53.6%,复水后,Gs较复水前分别上升7.6%、12.32%、14.22%,说明复水可使植物得到一定的缓解;胁迫8、12 d,Ci较对照下降12.21%、30.89%,较复水前分别上升7.32%、6.15%。
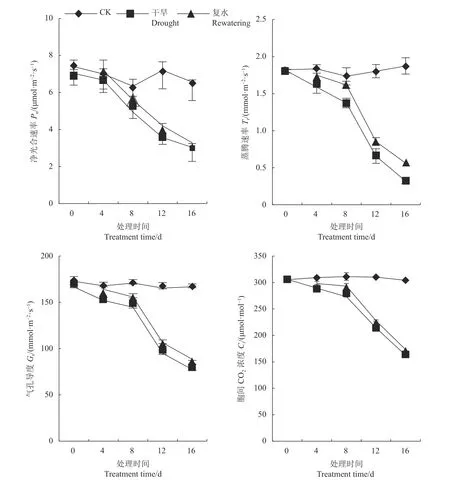
图1 侧金盏花不同水分状况光合参数的变化Fig. 1 Changes in photosynthetic parameters of A. amurensis grown under varied watering conditions
2.7 干旱胁迫及复水对侧金盏花叶片荧光参数的影响
从图2可知,干旱处理下,侧金盏花叶片Fo上升,Fm下降。胁迫8、12、16 d,Fo较对照上升28.67%、37.47%、46.44%;胁迫8、12、16 d,Fm比对照分别下降6.35%、12.93%、20.2%。Fv/Fo、Fv/Fm随胁迫程度加深均表现出下降趋势。干旱8、12 d,Fv/Fo比对照下降31.57%、44.97%,胁迫16 d,较对照下降57.56%,复水后,其值有所上升;胁迫4 d,与对照相比,Fv/Fm下降不明显,胁迫8~16 d,较对照分别下降5.1%、9.37%、13.03%,复水过程中,其值有所上升,干旱4 d复水后F/F恢复至对照。

图2 侧金盏花不同水分状况叶绿素荧光参数的变化Fig. 2 Changes in chlorophyll fluorescence parameters of A. amurensis grown under varied watering conditions
图3表明,干旱胁迫下,各处理ΦPSⅡ、ETR下降。干旱12、16 d,ΦPSⅡ比对照分别下降26.73%、31.2%,均显著低于对照(P<0.05),复水后,其值均增加;胁迫16 d时,ETR值最小,比对照下降31.29%,复水后,其值上升,较复水前升高6.03%。胁迫过程中,qP呈下降趋势,NPQ逐渐上升,干旱4~8 d,qP比对照降低8.76%、22.7%,胁迫12~16 d,qP值下降较快,比对照显著下降28.93%、36.38%(P<0.05);干旱至16 d,NPQ值最大,比对照显著上升58.44%(P<0.05)。复水后,qP、NPQ均有所恢复。

图3 侧金盏花不同水分状况叶绿素荧光参数的变化Fig. 3 Changes in chlorophyll fluorescence parameters of A. amurensis grown under varied watering conditions
3 讨论与结论
干旱胁迫下,侧金盏花的正常生命活动受到抑制。徐苏男等[14]认为,干旱使植物生长缓慢,其干物质量减少,本研究与之结果一致;相关研究表明,复水后成活率和叶片相对含水量是衡量植物脱水耐受性的有效指标[15−16],叶片相对含水量呈下降趋势;叶绿素是光能吸收的主要物质,直接影响植物光合作用[17]。本研究中,叶绿素总量不断降低,可能与植物自身生物学特性等因素有关[18]。
前人研究表明[19−21],渗透调节物质的积累是植物适应干旱胁迫的机制之一,干旱处理下,Pro和可溶性糖含量持续升高,可溶性蛋白含量先上升后下降,本研究与之略有差异,胁迫12 ~16 d时,脯氨酸含量下降,可能是因植物受害严重,导致机能紊乱;可溶性糖含量在干旱16 d达到最大值,表明植物叶片受害程度严重,复水后,其含量下降不明显,说明即使胁迫解除,短期内也未能恢复;可溶性蛋白含量在干旱期间持续下降,复水后有所回升,表明此时植物合成可溶性蛋白的能力增加。由此可知,不同植物在干旱胁迫下其渗透调节物质变化有所不同。
MDA和叶片相对电导率可体现干旱胁迫程度,是植物鉴定耐旱性的重要生理指标[22−23]。本研究中,干旱程度越重,MDA含量和叶片相对电导率越高,说明胁迫时间越长,侧金盏花质膜透性变大,细胞膜功能减弱,这与前人[24−25]研究结果一致。POD、SOD是植物体内的重要保护酶,可缓解脂质过氧化物积累而引起的细胞伤害[26]。本试验中,POD活性在第8 d达到峰值,胁迫0~12 d,SOD活性不断上升,表明此时植物通过增强保护酶活性来清除活性氧自由基,从而维持细胞膜的稳定性和完整性,这与崔颖等[27]研究结果相似。
植物在干旱处理下,叶片Pn、Gs、Ci和Tr在不同时期呈现不同变化。Farguhar[28]认为Pn、Gs和Ci变化一致时,Pn变化是由Gs引起,反之Pn的变化是由叶肉细胞活性决定的。本试验中,侧金盏花叶片Pn与Gs、Ci均下降,变化规律相同,胁迫12~16 dP恢复不明显,推测可能是植物受到严重胁迫后对光系统的伤害程度较大,这与张林春等[29]研究结果相似。此外,植物通过减小气孔开度使Tr降低,这也是植物一种抗旱机制[30]。本试验中,Tr逐渐下降,类似的研究结果也出现在葡萄等植物上[31]。
叶绿素荧光可检测植株在逆境条件下光合作用的真实行为。Fo是PSII反应中心完全开放状态时的荧光强度[32]。本研究中,侧金盏花叶片Fo增加量与受损程度成正比,表明PSII反应中心遭到破坏。前人研究表明[33],Fm、Fv/Fo、Fv/Fm是植物抗旱性主要指标,本研究中,均呈下降趋势,引起其降低的原因是叶片PSⅡ质子醌库(PQ库)容量变小,这与康红梅等[34]研究结果一致;随干旱胁迫加剧,qP、NPQ呈相反趋势,复水后,q升高,NPQ下降,表明光合电子传递得以恢复,植物通过调整NPQ使其对自身光合结构起保护作用,这与Fernandez等[35]在苹果幼树的研究结果相似。ETR的高低在一定程度上反映了PSⅡ反应中心的电子捕获效率的高低[36],本试验中,ETR和ФPSⅡ变化与qP一致,均逐渐减小,ФPSⅡ、qP和ETR显著下降说明干旱减弱QA的氧化能力及PSII的电子传递能力,导致碳同化降低,光合系统受损。
综上可知,当土壤相对含水量低于29.9%,各项指标变化显著,侧金盏花生长受到明显抑制;干旱不超过8 d时进行复水,各指标恢复效果明显,干旱8 d后复水,各指标较对照相比有显著差异。综合分析得出侧金盏花可承受持续8 d(土壤相对含水量为29.9%)的干旱胁迫,因此,侧金盏花在养护管理时,在持续时间低于8 d,土壤相对含水量不低于29.9%时的短期土壤失水时,应及时复水救苗,持续干旱8 d后,土壤相对含水量低于29.9%时,对侧金盏花造成不可逆的伤害。

