花椒籽不同溶剂提取物的活性成分及抗氧化性比较
慕钰文 ,黄玉龙 ,张辉元
(1.甘肃省农业科学院 农产品贮藏加工研究所,兰州 730070;2.甘肃省果蔬贮藏加工技术创新中心,兰州 730070;3.兰州大学 生命科学学院,兰州 730000)
0 引言
花椒(Zanthoxylum bungeanum Maxim.)属芸香科花椒属,是重要的食用香辛料[1-2]。花椒作为一种重要的经济作物,在四川省和重庆市、甘肃省等地广泛种植[3-4]。目前,花椒果皮90%以上以整粒散装形式加工销售,而花椒籽作为花椒生产过程中的主要副产物,约占花椒总量的60%左右,部分作为种子育苗和榨油,大部分作为肥料或当作废料丢弃,造成极大的浪费,严重影响花椒产业的健康持续发展[5-6]。花椒籽中主要有油脂、粗纤维、蛋白质和多酚等有效成分,目前对于花椒籽的研究主要集中于花椒籽油及黑色素等方面的提取[7-9]。其中利用碱提酸沉法提取、大孔树脂纯化得到花椒籽黑色素,证明该黑色素即为酚类物质,具有一定的抗氧化性[10]。但是对其中总多酚、黄酮等活性物质的研究较少。而多酚、黄酮作为植物体内的主要活性成分,具有较高抗氧化能力,已在食品、卫生和医药等领域广泛应用[11-13]。
本文以花椒籽为原料,采用不同极性溶液对其中总多酚和黄酮等活性成分的提取效果进行评价,明确花椒籽中活性成分及抗氧化能力的相关性,旨在综合利用花椒籽资源,扩大花椒产品应用范围,提高经济效益,开发天然抗氧化剂,为花椒籽资源的开发利用提供必要的数据支撑及理论依据。
1 材料与方法
1.1 材料与试剂
材料:供试材料为甘肃天水地区主栽品种“大红袍”,将新鲜花椒果实放入恒温鼓风干燥箱中于45 ℃下烘干至壳籽分离,取花椒籽为试验样品。
试剂:芦丁和没食子酸标准品、福林酚、DPPH试剂、无水乙醇、丙酮、三氯乙酸、铁氰化钾、氯化铁、盐酸、亚硝酸钠、氢氧化钠、硝酸铝、碳酸钠等均为国产分析纯。
仪器:Cary-100紫外分光光度计(美国瓦里安中国有限公司);TGL-16LM冷冻离心机(湖南星科科学仪器有限公司);BT224S分析天平(德国赛多利斯有限公司)。
1.2 试验方法
1.2.1 活性成分的提取
以体积分数分别为0(水)、30%、50%、70%的乙醇溶剂和30%、50%、70%的甲醇溶剂,按料液比 1:10(g/mL)浸提 30 min,然后 10 000 r/min离心10 min,上清液用来进行活性成分及抗氧化性的测定。
1.2.2 总多酚含量的测定
采用Folin-Ciocalteu比色法测定总酚含量[14]。取1 mL提取液与1 mL的Folin-Ciocalteu试剂混合,静置5 min后,加入3 mL浓度为7.5%的碳酸钠溶液,于40 ℃避光反应30 min,于765 nm波长处测定反应液的吸光值。总多酚含量以没食子酸当量表示(mg/g)。
在未来的几十年里,我们不太可能会遇到有意识机器的反叛,但我们可能不得不面对成群结队的机器人。这些机器人比我们的母亲更懂得如何触发我们的情感,并在人类精英的命令下,利用这种不可思议的能力,试图向我们推销某种东西,无论是汽车、政治家,还是整个意识形态。机器人可能会识别我们最深的恐惧、仇恨和渴望,并利用它们来对付我们。我们已经在近期世界各地的选举和公民投票中领略到了这一点,黑客学会了如何通过分析有关选民的数据并利用他们的偏见来操纵个体选民。虽然科幻惊悚片中的末日伴随着大火和浓烟,但在现实中,我们可能只会面对一个由鼠标点击带来的乏味末日。
1.2.3 总黄酮含量的测定
采用三氯化铝法测定总黄酮的含量[15]。取1 mL提取液,加入0.3 mL 5%亚硝酸钠溶液摇匀,静置5 min后加入0.3 mL 10%三氯化铝溶液,静置5 min后再加入2.0 mL 10%氢氧化钠溶液,定容至10 mL,在510 nm 波长处测定反应液的吸光度值。总黄酮含量以芦丁当量表示(mg/g)。
1.2.4 DPPH 自由基清除能力测定
参考Brand-Williams等方法[16-17]。取 2 mL提取液及2.0 mL 20 mmol/L的DPPH溶液,摇匀后置于暗处化学反应30 min,于517 nm测定吸光值。按照下列公式计算DPPH自由基清除能力:
DPPH自由基清除率=[1-(A样品吸光值-A空白吸光值)/A对照吸光值]×100%
1.2.5 铁还原能力测定(FRAP)
参考Benzie等方法[18]。10 mmol/L TPTZ溶液、20 mmol/L FeCl3·6H2O 溶液和 0.3 mol/L(pH3.6)的醋酸缓冲溶液按照体积比1:1:10的比例混合得到FRAP工作液。取提取液0.1 mL,加入2.4 mL FRAP工作液,混匀,在37 ℃水浴10 min,于593 nm测定吸光值。铁还原能力以Trolox当量表示(mg TE/g)。
1.2.6 数据处理
2 结果与分析
2.1 不同溶剂提取对花椒籽总多酚含量的影响
花椒籽中总多酚的含量受提取溶剂的影响,存在较大的差异。由图1可知,用90%的乙醇提取时,花椒籽中总多酚含量最高,达到138.84 mg/g;用蒸馏水提取时总多酚含量为72.83 mg/g,显著低于不同浓度的乙醇和甲醇提取(p<0.05)。不同浓度甲醇和乙醇提取时,总多酚含量呈现相同的趋势,即随着提取浓度的增大而增加;相同浓度的甲醇和乙醇提取时,乙醇提取效果明显。

图1 不同溶剂提取的花椒籽总多酚含量Fig.1 Total polyphenol content extracted with different solvents
2.2 不同溶剂提取对花椒籽总黄酮含量的影响
不同溶剂提取对花椒籽中总黄酮含量的影响如图2所示。

图2 不同溶剂提取的花椒籽总黄酮含量Fig.2 Total flavonoids content extracted with different solvents
用蒸馏水提取的总黄酮含量为57.56 mg/g,显著高于其他溶剂提取时的含量(p<0.05);以甲醇为提取溶剂,浓度在50%~70%时的总黄酮含量显著高于浓度为30%和90%的甲醇提取(p<0.05);以乙醇为提取溶剂,浓度30%~50%时提取的总黄酮含量显著高于70%~90%的乙醇提取(p<0.05)。由此表明,花椒籽中总黄酮在提取时受提取溶剂和浓度的影响明显。
2.3 不同溶剂提取对花椒籽DPPH自由基清除率的影响
由图3可知,不同溶剂提取的花椒籽DPPH自由基清除率在75.20%~91.34%范围内,不同溶剂对花椒籽DPPH自由基清除率的影响差异不大。其中90%甲醇和90%乙醇提取的花椒籽DPPH自由基的清除率最高,分别为89.40%和91.34%;30%甲醇提取时DPPH自由基的清除率为75.20%,显著低于其他溶剂和蒸馏水提取(p<0.05)。

图3 不同提取物清除DPPH自由基的能力Fig.3 DPPH radical scavenging capacity of different solvent extracts
2.4 不同溶剂提取对花椒籽FRAP的影响
由图4可知,不同提取溶剂对花椒籽FRAP的影响差异较大,其中不同浓度甲醇提取液的FRAP显著低于不同浓度乙醇提取液的FRAP和蒸馏水提取的FRAP(p<0.05)。不同浓度甲醇溶液提取的花椒籽FRAP间无显著性差异,不同浓度乙醇溶液提取的花椒籽FRAP中,以50%乙醇提取的FRAP显著高于其他浓度的乙醇提取。因此,提取溶剂对花椒籽的FRAP影响更为显著,选择适宜的提取溶剂对花椒籽FRAP更加明显。
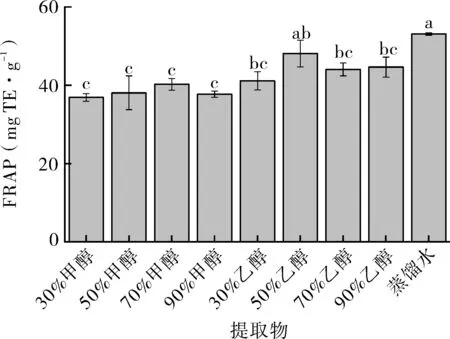
图4 不同提取物铁还原能力(FRAP)Fig.4 Ferric ion reducing antioxidant power (FRAP) of different solvent extracts
2.5 不同溶剂提取的活性物质与抗氧化活性的相关性分析
为进一步明确不同溶剂花椒籽提取物中总多酚和总黄酮的含量与抗氧化活性的关系,对不同溶剂提取物中总黄酮、总多酚含量与DPPH自由基清除率和FRAP进行相关性分析,结果如表1所示。花椒籽不同溶剂提取物的总多酚含量与总黄酮含量呈负相关性,且差异极显著(p<0.01);总多酚含量与DPPH自由基清除率显著性相关(p<0.05);总黄酮含量与FRAP显著性相关,且差异极显著(p<0.01);而总多酚含量与 FRAP、总黄酮含量与DPPH自由基清除率间的相关性均较低。

表1 不同溶剂提取的活性物质与抗氧化活性的相关性分析Tab.1 Correlation analysis of antioxidant activity with activity compounds extracted with different solvents
3 讨论与结论
花椒籽中活性成分和抗氧化活性受到提取溶剂的影响差异显著。其中,用90%乙醇提取的花椒籽总多酚含量最高,用蒸馏水提取的总黄酮含量最高,且总多酚和总黄酮含量呈负相关,差异极显著。对于抗氧化活性而言,DPPH自由基清除率在用90%甲醇和90%乙醇提取时最高,与总多酚含量显著性相关;而FRAP在用50%乙醇提取时活性达到最大值,且与总黄酮含量相关性极显著。
通过本研究发现,花椒籽中总多酚含量与提取溶剂极性大小密切相关,极性较小的溶剂更利于花椒籽总多酚的提取,同时由于花椒籽中多酚种类的不同,其在不同溶剂中的溶解性亦有较大的差异。而总黄酮的含量则在用蒸馏水提取时含量达到最大值,说明黄酮以水溶性成分居多。王桂林等研究了超声辅助不同溶剂(70%甲醇、70%乙醇、70%丙酮和水)提取金银花中的总多酚,发现金银花中多酚以脂溶性为主,即提取溶剂极性小,总多酚含量越高,与本研究的结论一致[19]。赵玉红等对不同溶剂提取的“鲁赫”刺蔷薇叶中总多酚和总黄酮含量进行测定,结果表明60%乙醇提取的总多酚和总黄酮含量达到最高,根据“相似相溶”原理,说明乙醇水溶液对样品中的分类化合物溶解性较好[20]。孟宪华等用70%乙醇对青花椒中的分类化合物进行提取,并利用柱色谱和高效液相色谱等分离技术和核磁共振(NMR)、高分辨质谱(HR-ESI-MS)等结构鉴定技术对所提取的酚类化合物进行分析,发现12个多酚糖苷类化合物,其中包含2个新结构化合物[21]。李杰等通过不同浓度乙醇对花椒黄酮进行提取,发现在乙醇浓度为40%~60%时,总黄酮含量随着乙醇浓度的增大而增加;当乙醇浓度大于60%时,花椒总黄酮含量随乙醇浓度的增大而逐渐降低[22]。通过相关性分析发现,不同溶剂提取的花椒籽中总多酚和总黄酮含量呈负相关(p<0.01),这主要是由于花椒籽中多酚和黄酮在不同提取溶剂中的溶解性不同导致,同时,花椒籽中的花椒籽油含量较高,在提取过程中,花椒籽油可能会对提取溶剂的极性产生一定影响,从而导致多酚和黄酮含量的差异。因此,在对于花椒籽中活性成分的提取过程中,要根据所提取的成分选择适宜的溶剂和浓度。
花椒籽中不同溶剂提取的活性物质的DPPH自由基清除率在用90%甲醇和90%乙醇提取时最高,且与总多酚含量显著性相关;而FRAP在用50%乙醇提取时活性达到最大值,且与总黄酮含量相关性极显著。这可能是由于不同溶剂和不同浓度的提取物中多酚和黄酮的种类和含量存在较大差异,不同活性成分间存在相互协同或拮抗的作用,从而导致提取物具有不同的抗氧化能力。陈静等采用蒸馏水、50%乙醇和无水乙醇为溶剂,从青、红花椒中提取到6种提取物,发现不同的花椒提取物均具有较强的抗氧化能力,且呈现出不同程度的量效关系[23]。徐一鸣等通过对汉源花椒黄酮的提取和抗氧化活性研究,发现汉源花椒总黄酮提取物具有较强的DPPH自由基清除能力和羟自由基的清除能力,同时具备一定的还原力与总抗氧化能力[24-25]。
综上所述,本文通过不同溶剂对花椒籽中活性物质总多酚和总黄酮进行提取,并分析了活性物质的抗氧化能力。研究结果表明,花椒籽中的总多酚和总黄酮含量相对较高,且具有较强的抗氧化活性,可以作为天然的抗氧化剂。同时,不同溶剂对花椒籽中的活性成分含量影响差异显著,在提取时应根据所需要的目标化合物选择适宜的溶剂。

