基于病证结合探讨糖尿病肾病阴虚证大鼠肾损害与自噬的关系*
韩佳瑞,邢玉凤,彭紫凝,商海涛,李新宝,庞欣欣,孙新宇
(1.河南省中医院/河南中医药大学第二附属医院肾病科 郑州 450002;2.河南中医药大学第二临床医学院 郑州 450046)
糖尿病肾病(Diabetic kidney disease,DKD)是糖尿病严重的微血管并发症之一,是终末期肾脏疾病的常见原因[1]。DKD发病机制复杂,近年来研究发现细胞自噬在DKD的发病中发挥重要作用[2]。自噬是指细胞通过溶酶体降解大分子、细胞器、蛋白质等,维持细胞稳态及功能的过程。DKD发生时,各种刺激因素可导致机体内环境紊乱,进而诱发细胞自噬水平的紊乱[3],甚至诱导细胞死亡,进而加重DKD进展[3-5]。
中医认为阴虚是DKD的病机关键,如《临证指南医案·三消》言 “三消一证,虽有上中下之分,其实不越阴亏阳亢,津涸热淫而已” 。临床上多数DKD患者可表现为口渴多饮、多食、潮热盗汗、舌红脉数、体重下降,以及血清阴虚指标值异常等阴虚证的症候[6-8]。近年来,中医学者以阴虚为干预靶点在DKD治疗方面取得了良好效果[9],但具体作用机制尚不完全清楚。有学者认为阴阳平衡与自噬密切相关,其中自噬被抑制能够影响代谢产物或细胞成分降解,进而引起机体阴阳的盛衰、亡失,加重疾病进展[10]。有研究表明[11],具有补阴功效的药物能够通过增强自噬来治疗糖尿病。我们前期在河南省中医药拔尖人才培养项目专项课题的资助下,研究发现以养阴为主要治则的方剂通络地龟汤可以通过提高足细胞自噬水平来发挥对DKD的治疗作用(已录用待发表),推测阴虚证可能与DKD中自噬抑制存在紧密的内在联系。
构建合适的动物模型是探究中医证型阴虚证与西医疾病机制自噬关系的关键。病证结合动物模型指的是在中医学证候及现代医学病因的共同干预下构建模型,使模型同时具有西医疾病与中医证候特征的优势,以便观察中医证侯对疾病的影响[12]。为了深入研究阴虚证和自噬在DKD疾病中的关系,本研究以病证结合理论为指导,通过腹腔注射链脲佐菌素建立DKD疾病模型[13],再结合左甲状腺素钠水溶液灌胃法构建DKD阴虚证病证结合模型,探讨阴虚证与DKD肾损伤以及自噬功能的关系。
1 材料与方法
1.1 实验动物
4周龄SPF级SD雄性大鼠40只,体质量(150±10)g,购于河南省实验动物中心,许可证号:SCXK(豫)2017-0001。
1.2 药物
左甲状腺素钠片(优甲乐,Merck KGaA公司,批号J20160065);链脲佐菌素(Streptozotocin,STZ)购于北京索莱宝科技有限公司(批号S8050)。
1.3 主要试剂与仪器
血清肌酐(Serum creatinine,Scr)检测试剂盒、血尿素氮(Blood urea nitrogen,BUN)检测试剂盒、尿蛋白定量(Urinary protein quantitation,UP)试剂盒均购于南京建成生物工程研究所(批号分别为C011-2-1,C013-2-1,C035-2-1);大鼠皮质酮/肾上腺酮(Corticosterone,Cort)检测试剂盒、大鼠雌二醇(Estradiol,E2)检测试剂盒(货号分别为CSB-E07014r,CSB-E05110r)购于武汉华美生物工程有限公司;环磷酸腺苷(Cyclic adenosine monophosphate,cAMP)酶联免疫吸附测定试剂盒、环磷酸鸟苷(Cyclic guanosinc monophosphate,cGMP)酶联免疫吸附测定试剂盒、游离甲状腺素4(Free Thyroxine 4,fT4)酶联免疫吸附测定试剂盒均购于武汉伊莱瑞特生物科技股份有限公司(批号分别为E-EL-0056c,E-EL-0083c,E-EL-0122c);一抗自噬相关蛋白Beclin-1抗体、P62抗体,纤维连接蛋白(Fibronectin,FN)抗体、α-平滑肌肌动蛋白(Alpha smooth muscle actin,α-SMA)抗体,羊抗兔二抗,内参β-肌动蛋白(Beta actin,β-actin)抗体,抗鼠/兔通用型免疫组化检测试剂盒(二抗工作液,即用型)均购于武汉三鹰生物技术有限公司(批号分别为11306-1-AP,18420-1-AP,15613-1-AP,14395-1-AP,SA00001-2,60008-1-lg,30201912);一抗自噬相关蛋白LC3-II抗体购于艾博抗(上海)贸易有限公司(批号ab48394);Trizol试剂盒购于上海荔达生物科技有限公司(批号RNAA00250);HE染色试剂盒、糖原PAS染色液试剂盒、Masson三色染色试剂盒购于北京索莱宝科技有限公司(货号分别为G1120,G1281,G1340);日本东京JEM-1400 PLUS型电子透射电子显微镜;美国伯乐公司ChemiDoc XRS+凝胶扫描成像系统;美国Sigma Aldrich超速低温离心机;杭州奥盛干式恒温器;日本SANYO超低温冰箱;日本Nikon体视显微镜。
1.4 动物疾病模型的制备及分组
40只大鼠适应性喂养1周,血糖正常、尿蛋白定性实验阴性者进入实验。随机选择8只作为正常组,余32只作为模型组。采用先疾病后证型的思路造模。参照腹腔注射STZ法先建立DKD大鼠模型[13],再根据左甲状腺素钠悬浮液灌胃法建立DKD大鼠阴虚证型[14],以此构建病证结合阴虚型DKD大鼠模型。具体方法如下:①第1步:DKD疾病造模:先建立糖尿病模型,再建立DKD模型。正常组大鼠不接受任何处理,自由饮水和进食。模型组大鼠腹腔注射STZ(55 mg·kg-1),于STZ注射72 h后,禁食不禁水12 h,尾静脉采血测定空腹血糖,检测血糖≥16.7 mol·L-1,即为糖尿病模型成功;于STZ注射12周后,收集大鼠24 h尿标本测定尿蛋白定量,24 h尿蛋白定量(24-hour urine protein,24 h Pro)≥30 mg,即为DKD疾病造模成功。造模过程中,模型组有4只大鼠不满足DKD模型条件,予以剔除,最终有28只大鼠纳入DKD模型组。②第2步:阴虚证型造模。将DKD模型组随机均分为DKD组、阴虚组,每组14只,进行阴虚证模型的构建。造模方法为阴虚组给予左甲状腺素钠水溶液灌胃,500μg·mL-1·kg-1,每日1次;正常组和DKD组给予等体积生理盐水灌胃,每日1次,连续给药4周后处死各组大鼠,分别获取血液样本、尿液标本及肾组织标本。经查阅文献[6],拟定阴虚证造模成功标准,即大鼠出现体质量减轻、急躁易怒、多饮多食多尿等症状体征,同时满足客观指标血清Cort、E2、fT4、cAMP、cAMP/cGMP比值升高,cGMP值下降,提示阴虚证造模成功。
1.5 检测指标与方法
1.5.1 一般状态
观察各组大鼠每天灌胃给药前后的一般情况如精神、毛发、活动、二便、饮水、摄食量等。
1.5.2 血清及尿液相关指标测定
灌胃给药第4周末,处死大鼠,经腹主动脉采血,分离血清,测定大鼠血清cAMP、cGMP、fT4、Scr、BUN的水平。并在大鼠处死前1天收集24 h尿液,按照相关试剂盒说明步骤测定各组大鼠24 h尿蛋白含量。
1.5.3 肾组织病理学变化
大鼠处死后,迅速在无菌下摘取大鼠一侧肾脏,选该侧1/2肾脏置于10%甲醛固定、石蜡包埋,制成薄切片,用于HE、Masson、PAS染色检查。
1.5.4 免疫组化检测肾组织FN、α-SMA、Beclin-1、LC3-II、P62蛋白
将大鼠肾组织石蜡切片脱蜡,经3%H2O2封闭内源性过氧化酶、柠檬酸钠修复表面抗原、山羊血清封闭,分别滴加相应配置比例下的一抗抗体:FN(1∶100),α-SMA(1∶200)、P62(1∶100)、Beclin-1(1∶200)、LC3-II(1∶300),4℃过夜,复温后加入二抗,于37℃孵育30 min后滴加DAB染色,显微镜控制下显色,之后滴加苏木素,逐级脱水后用树胶封片,镜下观察并采图。判断标准:出现特异性棕黄色染色者为阳性,阴性对照无特异性着色。
1.5.5 电镜观察肾脏超微结构及自噬体形成情况
大鼠处死后,迅速在无菌下行对侧肾脏穿刺,将组织置于5%戊二醛溶液中固定,透射电镜下观察肾脏超微结构及自噬体形成情况。
1.5.6 Western Blot检测FN、α-SMA、Beclin-1、LC3-II、P62蛋白表达
大鼠处死后,将在无菌下迅速摘取的另1/2肾脏,用生理盐水冲洗干净后置于液氮中待测。选取部分肾组织标本,按Western Blot操作规程进行操作,其中抗体稀释浓度比分别为Beclin-1(1∶1000)、LC3-II(1∶1500)、P62(1∶2000)、FN(1∶6000)、α-SMA(1∶2000)、羊抗兔二抗(1∶2000)、β-actin(1∶3000),检测自噬相关蛋白Beclin-1、LC3-II、P62及肾脏纤维化相关蛋白FN、α-SMA表达。用酶化学发光法观察蛋白条带,采用Image J软件进行定量分析。
1.5.7 RT-PCR检测FN、α-SMA、Beclin-1、LC3-II、P62转录水平
在样本中加入trizol试剂提取总RNA,鉴定RNA纯度和浓度,保证(260 nm处A)/(280 nm处A)均在1.8-2.0。进行cDNA反转程序,PCR扩增FN、α-SMA、Beclin-1、LC3-II和P62基因片段。以β-actin作为内参基因,反应体系及参数依据Real-time PCR试剂盒说明书设置,反应条件:94℃5 min,94℃30 s,55℃30 s,72℃30 s,40个循环。采用2-ΔΔCT法进行数据的相对定量分析。具体引物序列为:FN上游5'-ACATA‐AAGACATACTCCACAA-3',下 游 5'-CTTCTCCA‐CAACCCTCTGCT-3';α-SMA 上 游 5'-GCTT‐GTCCTATAGAAGCACAAT-3',下游5'-CGTCATTTC‐CACAGCCCTGTAT-3';Beclin-1上 游5'-GAGAG‐GAGCCATTTATTGAAAC-3',下 游5'-CTCCCCAAT‐CAGAGTGAAGC-3';P62上 游5'-GGAACTGATG‐GAGTCGGATAAC-3',下 游 5'-GTGGATGGGTC‐CACTTCTTT-3';LC3-II上 游 5'-AGAGCGATA‐CAAGGGTGAGAAG-3',下 游5'-AGAAGGCTTGGT‐TAGCATTGAG-3';β-actin上 游5'-ACCCTAAGGC‐CAACCGTGAAAAG-3',下 游5'-CATGAGGTAGTCT‐GTCAGGT-3'。
2 统计学方法
采用SPSS21.0统计软件进行统计分析,数据以均数±标准差(xˉ±s)表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 结果
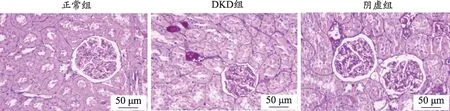
图2 各组大鼠肾组织病理形态学变化(PAS染色,×400)
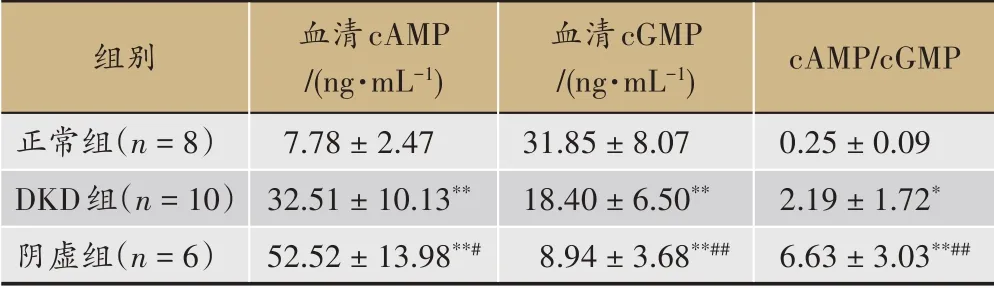
表2各组大鼠血清cAMP、cGMP及c AMP/c GMP表达(xˉ±s)
3.1 一般情况
在先疾病后证型的造模过程中,造模前所有大鼠精神良好,毛色光泽,行动敏捷,饮食正常。在DKD疾病造模阶段,与正常组大鼠比较,模型组大鼠出现精神萎靡、多饮多食多尿、毛发粗糙、体质量增加缓慢、轻度狂躁的现象。在阴虚证型造模阶段,与DKD组大鼠相比,阴虚组大鼠出现毛发粗糙无光泽、急躁易怒、饮食饮水量增加,同时体质量较DKD组明显下降的现象。至造模全部结束时,DKD组大鼠死亡4只,阴虚组大鼠死亡8只,最终正常组8只,DKD组10只,阴虚组6只。
3.2 各组大鼠血清及尿液样本检测结果
与正常组相比,各组大鼠Scr、BUN、24 h Pro水平均升高且有显著差异性(P<0.01);阴虚组大鼠BUN、Scr、24 h尿蛋白水平较DKD组更高且有差异性(P<0.05或P<0.01),提示阴虚组大鼠肾功能损伤较DKD组严重(表1-表3)。本研究选择用血清fT4、Cort、E2、cAMP、cGMP、cAMP/cGMP比值作为阴虚证判定标准[7]。与正常组相比,DKD组与阴虚组血清fT4、Cort、E2、cAMP、cAMP/cGMP比值明显增加(P<0.01或P<0.05),cGMP值下降(P<0.01),提示DKD组与阴虚组存在阴虚证的表现。与DKD组比较,阴虚组血清fT4、Cort、E2、cAMP、cAMP/cGMP比值明显增加(P<0.05或P<0.01),同时cGMP较DKD组降低(P<0.01),差异有统计学意义,进一步表明阴虚组的阴虚证造模成功。
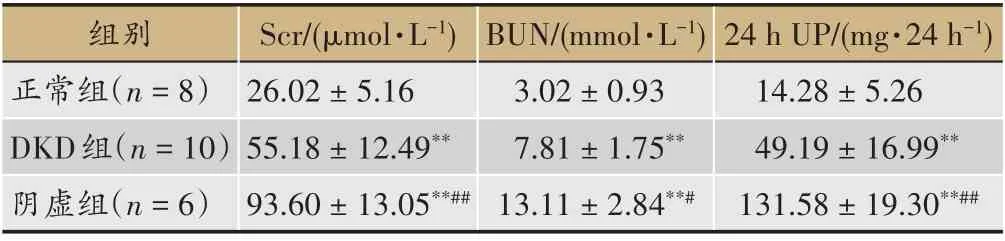
表1 各组大鼠血清Scr、BUN及24 h Pro指标(xˉ±s)

表3 各组大鼠血清Cort、fT4及E2表达(xˉ±s)
3.3 各组大鼠肾脏病理学改变
肾脏组织病理检测是证明大鼠DKD模型造模成功的关键因素之一。对肾组织切片进行HE、Masson、PAS染色(图1-图3)。其中正常组大鼠肾小球、肾小管及间质结构正常均匀而清晰,无病理变化,肾脏组织正常。HE染色显示:与正常组相比,DKD组可见肾小球基底膜增厚,肾小球萎缩;阴虚组较DKD组整体加重。PAS染色显示:与正常组相比,DKD组肾小球基底膜增厚,肾小管基底膜有不同程度的阳性反应,呈紫红色;阴虚组较DKD组出现的PAS阳性物质增多,紫红色分布扩大,表明有大量糖原物质积累。Masson染色显示:与正常组相比,DKD组可见蓝色胶原物沉积,肾小球中可见胶原纤维,肾间质纤维化,肾小球基底膜、系膜可见紫红色物质沉积;与DKD组比较,阴虚组的颜色沉积更为明显,肾间质纤维化表现更重,肾小球胶原纤维增多。首先通过与正常组相比,其余组大鼠的肾脏组织皆发生了不同程度的病理损伤,这些结果表明大鼠DKD的模型构建是成功的,其次通过比较阴虚组、DKD组肾组织的病理损伤程度,进一步提示,阴虚证加重DKD大鼠肾脏损伤。
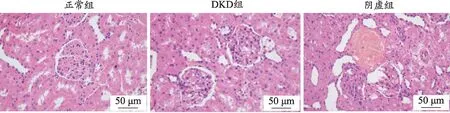
图1 各组大鼠肾组织病理形态学变化(HE染色,×400)
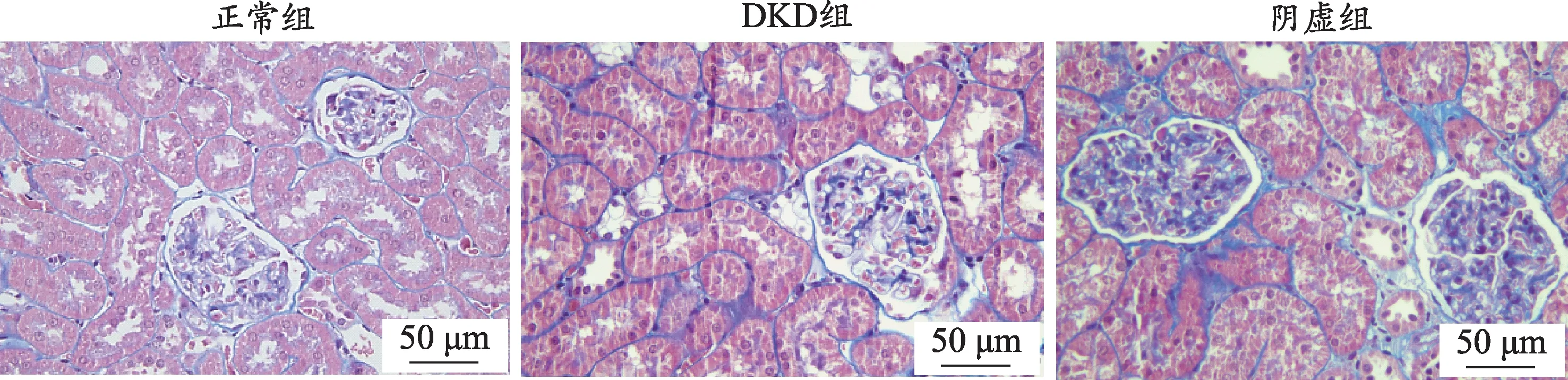
图3 各组大鼠肾组织病理形态学变化(Masson染色,×400)
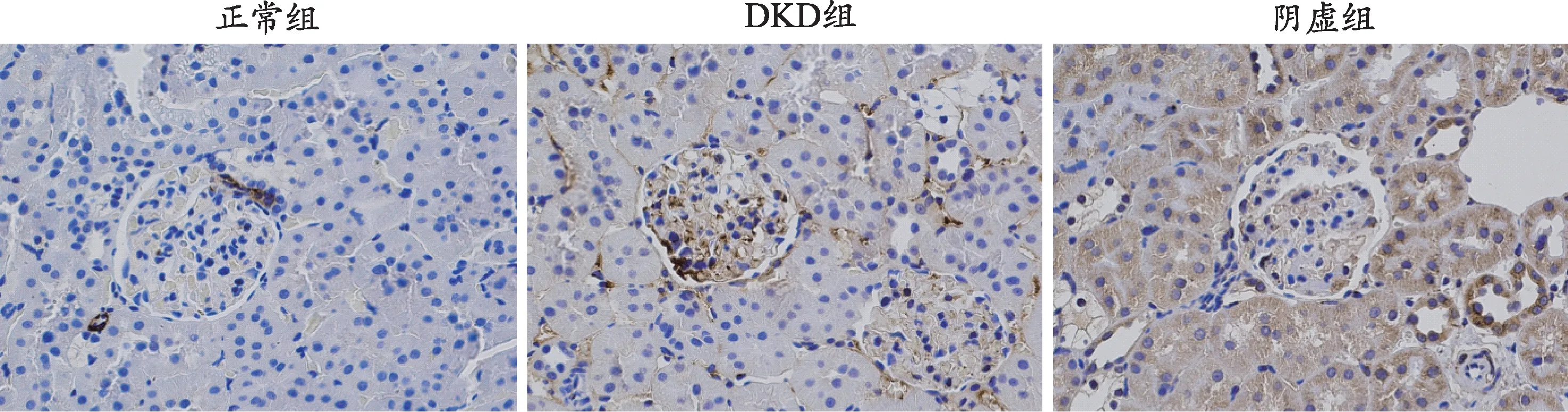
图5 各组大鼠肾脏组织α-SMA蛋白表达(免疫组化染色,×400)
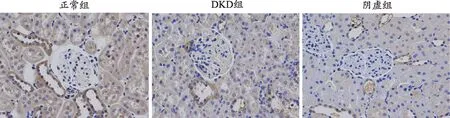
图6 各组大鼠肾脏组织Beclin-1蛋白表达(免疫组化染色,×400)
3.4 各组大鼠肾组织FN、α-SMA、Beclin-1、LC3-II、P62蛋白免疫组化结果
为进一步探究各组大鼠的肾脏损伤情况及阴虚证与自噬的关系,对大鼠肾脏组织的纤维化蛋白、自噬相关蛋白指标进行免疫组化检测(图4-图8)。纤维化蛋白α-SMA及FN、自噬相关蛋白P62、Beclin-1及LC3-II阳性表达均在细胞质,呈棕黄色。与正常组相比,DKD组、阴虚组的α-SMA及FN在肾小管与肾小球中阳性表达增加,可见大量棕黄色物质;与DKD组相比,阴虚组肾小管、肾小球棕黄色物质明显增加,提示阴虚组肾组织纤维化加重。正常组中,P62在肾小管上皮细胞中少量表达,可见少量棕黄色物质;DKD组中,P62在肾小管表达明显增多,且肾小球呈阳性表达,皆可见到大量棕黄色物质;与DKD组相比,阴虚组肾小管、肾小球棕黄色物质则明显增加,表明阴虚组P62表达增加,提示阴虚组自噬降解减弱,自噬受到抑制。与正常组相比,DKD组自噬相关蛋白LC3-II、Beclin-1在肾小球、肾小管阳性表达减少,可见少量棕黄色物质;阴虚组较DKD组整体减弱,仅在肾小管可见阳性表达,提示阴虚组自噬抑制加重。上述结果表明,与正常组相比,其余组的肾脏纤维化加重,同时各组自噬情况也说明,在DKD情况下肾组织的自噬是被抑制的,且阴虚组自噬抑制程度更重。
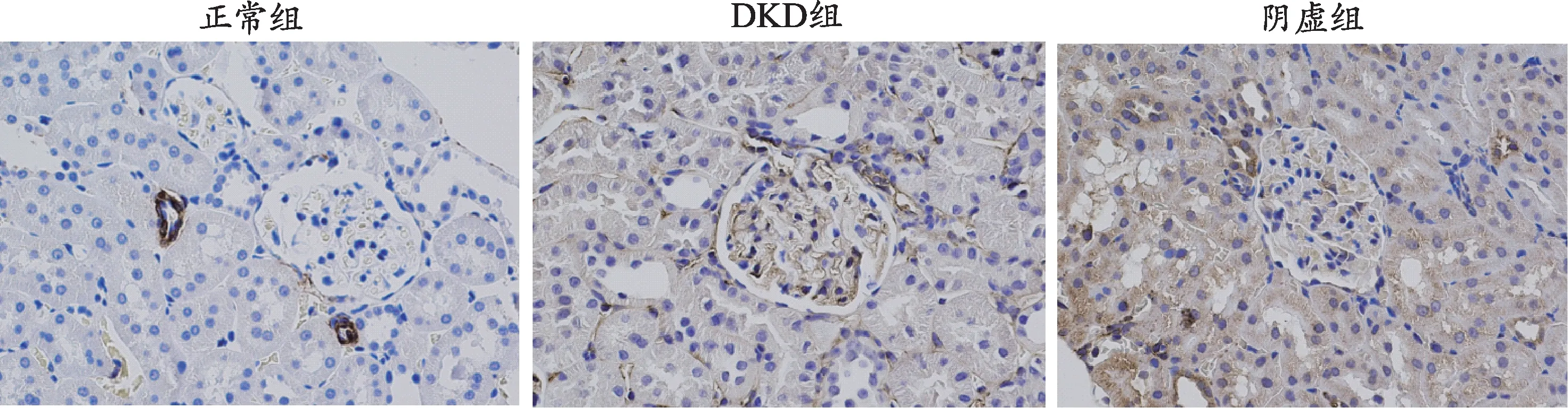
图4 各组大鼠肾脏组织FN蛋白表达(免疫组化染色,×400)

图7 各组大鼠肾脏组织LC3-II蛋白表达(免疫组化染色,×400)
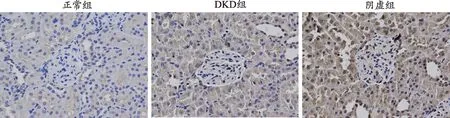
图8 各组大鼠肾脏组织P62蛋白表达(免疫组化染色,×400)
3.5 各组大鼠电镜下肾脏超微结构及自噬情况
电镜是观察自噬的有效手段(图9)。正常组肾小球基底膜结构正常,足突排列有序,线粒体内嵴明显,自噬结构正常;DKD组大鼠足突增宽、部分融合,肾小球基底膜增厚,线粒体内嵴明显,自噬结构减少;阴虚组大鼠足突融合及基底膜增厚较DKD组更加明显,线粒体内嵴明显,自噬结构较DKD组减少。这些结果进一步说明阴虚组的自噬是被抑制的,且自噬抑制程度更深。
3.6 各组大鼠Western Blot及RT-PCR检测结果
为进一步证实阴虚证与肾脏损伤、自噬的关系,又对各组大鼠的纤维化蛋白、自噬相关蛋白进行了Western Blot及RT-PCR检测。
Western Blot检测结果表明(图10):与正常组相比,DKD组与阴虚组的FN、α-SMA蛋白相对表达水平灰度值增加(P<0.05),提示DKD大鼠模型出现肾脏纤维化;其中阴虚组FN、α-SMA蛋白相对表达水平灰度值较DKD组高(P<0.05),差异有统计学意义,说明阴虚证能够加重DKD大鼠肾脏纤维化。与正常组相比,DKD组与阴虚组LC3-Ⅱ、Beclin-1蛋白相对表达水平灰度值降低(P<0.01或P<0.05),说明DKD大鼠模型自噬受到抑制;而阴虚组与DKD组比较,LC3-Ⅱ、Beclin-1蛋白相对表达水平灰度值更低(P<0.05),提示阴虚证可能抑制DKD肾组织的自噬水平。DKD组P62蛋白相对表达水平灰度值显著高于正常组(P<0.01),表明自噬体降解增强,DKD组自噬水平受抑制,与LC3-II蛋白的表达结果统一。而阴虚组与DKD组比较,P62蛋白的相对表达水平灰度值增加(P<0.01),提示自噬处于抑制状态,表明阴虚证加重DKD肾脏病理损伤可能与抑制肾组织的自噬水平有关。

图10 各组大鼠肾组织FN、α-SMA、LC3-II、Beclin-1及P62蛋白表达
RT-PCR检测结果表明:与正常组比较,DKD组FN、α-SMA及P62 mRNA表达水平明显升高(P<0.01或P<0.05),LC3-II及Beclin-1 mRNA表达水平明显降低(P<0.01),表明DKD大鼠出现肾脏纤维化及自噬抑制(图11)。与DKD组比较,阴虚组FN、α-SMA及P62 mRNA表达水平升高(P<0.01),LC3-II及Beclin-1 mRNA表达水平降低(P<0.05),表明阴虚组大鼠自噬抑制及肾脏纤维化加重。
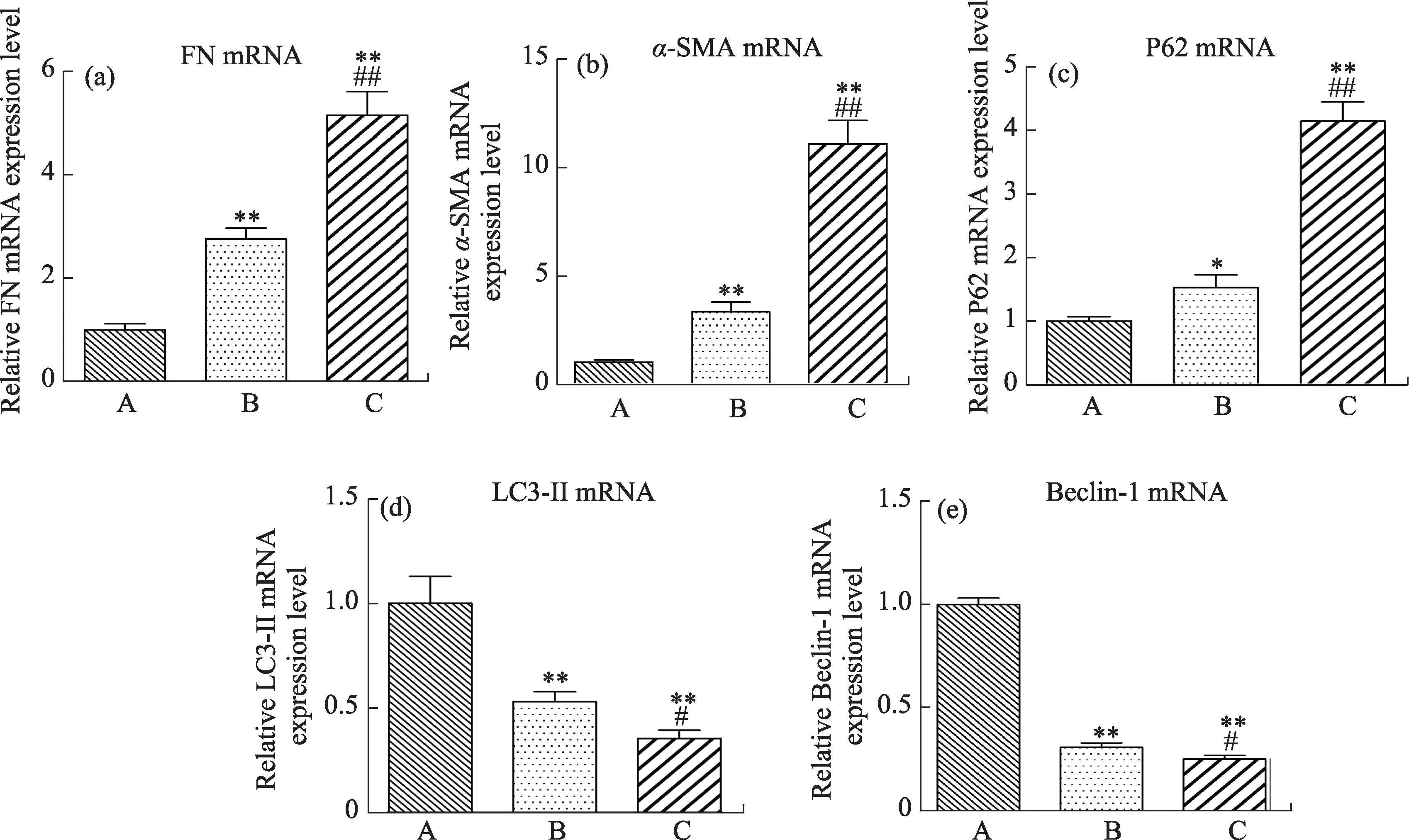
图11 各组大鼠肾组织FN、α-SMA、P62、Beclin-1及LC3-IImRNA表达结果
上述Western Blot及RT-PCR检测结果进一步表明,阴虚证不仅能够加重肾脏损伤,还能加重自噬抑制程度。
4 讨论
中医将糖尿病肾病归属于 “消渴” “水肿” 等疾病的范畴,如《圣济总录》提及: “消渴病久,肾气受伤,肾主水,肾气虚衰,气化失常,开阖不利,水液聚于体内而出现水肿” 。糖尿病肾病的病机复杂难辨,多数医家认为阴虚是其主要病机[15,16],临床上采用阴虚辨证治疗也取得了良好的效果,但其潜在机制尚不明确。相关研究匮乏可能与动物模型的构建有关。目前,关于中医干预机制的基础研究多通过构建动物疾病模型进行,这些普通动物疾病模型不能较好地模拟中医证型。近年来,病证结合动物模型的兴起为解决这一难题提供了新的思路,作为一种新型的疾病模型,其不仅具有疾病与证候兼备的特点,还可用以探索证侯对疾病的影响[17]。
本研究在病证结合理论指导下,先以腹腔注射STZ法制备DKD大鼠模型,后辅以左甲状腺素钠水溶液灌胃法,构建阴虚证DKD病证结合大鼠模型,观察阴虚证对DKD肾脏损害的影响。目前阴虚证的构建标准尚无统一规定,多采用阴虚证症候联合客观指标进行判定。其中阴虚症候主要表现为体质量减轻或增长缓慢、五心烦热、急躁易怒、体温增高等,客观指标则以内分泌功能紊乱相关的阴虚指标为主,如肾上腺、甲状腺、性腺等功能紊乱所致的血清Cort、fT4、E2升高,及cAMP升高、cGMP下降等[6,9,16]。在本次研究中,通过观察各组阴虚指标可以发现,阴虚组大鼠血清Cort、fT4、E2、cAMP水平明显高于DKD组,而血清cGMP下降,这与既往研究相一致。与此同时,阴虚组大鼠均出现体质量下降、多饮多食多尿、急躁易怒等阴虚症候加重情况。基于此,阴虚组大鼠呈现出的一般状态及内分泌各项指标与临床阴虚证研究结论基本一致,进一步表明阴虚证型构建成功。与DKD组相比,阴虚组大鼠Scr、24 h Pro及BUN升高更加明显、肾组织糖尿病肾病的病理学改变更重,表现为肾脏纤维化加重、肾小球基底膜增厚、足突融合等,同时肾脏纤维化指标FN、α-SMA蛋白及其mRNA表达增高,不仅证实DKD大鼠模型构建成功,还提示阴虚证能够加重DKD的肾脏损伤。
自噬是维持机体内环境稳态的机制之一,包括形成双层膜结构的自噬体、自噬体溶酶体融合、降解胞内物质成分3个步骤[18]。正常内环境中,适度刺激,可通过上调自噬相关蛋白Beclin-1表达上调,启动自噬泡形成,激活自噬,发挥对细胞的保护作用。LC3-II是自噬的重要标记物,参与自噬体形成,能够反映细胞自噬功能水平,并且与自噬体数量密切相关[19]。P62蛋白为自噬酶体降解途径的底物,兼具自噬受体蛋白与自噬选择性底物的身份。当细胞发生自噬时,P62蛋白降解;而当自噬活性减弱或自噬功能缺陷时,P62蛋白则在细胞中累积,因此P62蛋白也能反映细胞自噬活性[20]。目前研究普遍认为[21],在DKD的进展中,细胞自噬受到抑制。被抑制的细胞自噬通过促进凋亡等多个途径加重DKD肾脏损伤[22]。在STZ诱导的糖尿病小鼠足细胞中,自噬相关蛋白LC3-II、Beclin-1表达明显降低,足细胞损伤加重[23]。Wu等发现[24],与正常组相比,糖尿病模型大鼠肾脏组织LC3-Ⅱ、Beclin-1的表达降低,同时电镜下,DKD大鼠肾组织自噬体减少、病理损伤加重。本研究结果显示,DKD组及阴虚组大鼠LC3-Ⅱ、Beclin-1表达较正常组降低,且电镜下足细胞内自噬体数量减少,足突发生融合,肾小球基底膜变厚,这表明DKD大鼠的足细胞自噬水平被抑制,肾脏组织损伤加重,与以往研究相符。
本实验中,与正常组相比,DKD组、阴虚组大鼠皆出现了不同程度的阴虚证表现、自噬抑制情况。且阴虚组大鼠的肾脏损伤较DKD组更为明显。与DKD组大鼠相比,阴虚组大鼠自噬相关LC3-Ⅱ、Beclin-1蛋白及其mRNA表达较低,肾组织自噬相关LC3-Ⅱ、Beclin-1蛋白的免疫组化阳性表达减弱,且电镜下肾脏细胞内偶见自噬体,足突明显融合,甚至缺失,肾小球基底膜增厚,这表明阴虚证能进一步抑制肾脏自噬功能。细胞自噬是机体细胞自我清洁的重要方式,该生理过程相对于人体,与肾脏的功能相似。自噬容易受到外界因素刺激而被抑制,而肾脏同样具有 “阴常虚” 的特点。此外,细胞自噬随着年龄增长而减弱,这正如《素问·阴阳应象大论》云: “年四十,而阴气自半也,起居衰矣。” 有研究指出滋补阴方药能增强下丘脑LC3-Ⅱ的表达[11],增强自噬改善糖尿病认知功能障碍,证实养阴药物能增强细胞自噬水平。这都提示自噬功能受损可能与中医的阴虚证相关。
综上所述,阴虚作为DKD的核心病机,以养阴为法的中医药治疗在临床颇为有效,然而临床上DKD患者中医病机复杂,较少单独采用养阴药物治疗DKD,常常与其它中药配伍使用。在DKD的众多发病机制中,细胞自噬的紊乱占有重要地位。通过本研究发现,阴虚证能够加重DKD大鼠肾脏病理损伤,进一步抑制肾脏细胞自噬标记物的表达。我们推测在DKD中阴虚证加重肾脏损伤可能与抑制肾脏组织的自噬功能有关。然而目前来看,基础研究也无法做到准确的辨证论治,这也是本研究的不足之处。此外,关于阴虚证通过哪些方式调控自噬进而影响DKD进展,仍有待更深一步地研究,也为中医药治疗DKD提供了新的研究思路。

