caveolin-1表达在糖尿病大鼠下肢缺血中的作用及其与eNOS/NO通路的关系
毕国善,张侠陵,刘辉,陈洁,罗东阳,熊国祚
(1.南华大学附属第二医院 血管外科,湖南 衡阳 421001;2.湖南省常德市第一人民医院 心血管外科,湖南 常德 415000;3.湖南省益阳市中心医院 血管外科,湖南 益阳 413000)
糖尿病下肢血管病变是糖尿病患者常见的并发症之一[1],约占糖尿病并发症的20%,是导致患者截肢的主要原因,严重影响糖尿病患者的生命健康[2]。而目前无论药物、外科转流术以及介入治疗远期疗效都不能令人满意[3-4]。近年来,通过促血管新生改善缺血部位血液循环,已成为治疗糖尿病下肢缺血重要方法[5-7]。小凹蛋白1(caveolin-1)是一种信号转导蛋白,通过分子表面的“脚手架”区能与多种信号分子相互作用,在多种疾病中起着重要调控作用[8-9]。有研究报道,caveolin-1可促进血管新生,并参与糖尿病病理过程[10-11],笔者推测caveolin-1可能在糖尿病下肢缺血中发挥着重要作用,因此,本研究主要探讨caveolin-1对糖尿病下肢缺血部位血管新生的作用及机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物80 只健康SD 大鼠,雄性,(200±20)g,8~10 周,从南华大学动物实验部购买。
1.1.2 实验仪器SZ-93 自动双重纯水蒸馏器(亚荣,上海);三用恒温水浴箱(中国);Eppendorf 型高速离心机 (5804 型、5804R 德国);ELX800 型酶标仪(BioTEk,美国);微量移液器(Select Bioproducts,美国);OLYMPUS 显微镜与显微摄像系统(BX51 型,日本);Sartorius电子天平(BSA223S,美国);Sanyo -80 ℃冰箱(日本)。
1.1.3 实验试剂pCDNA3.1(+)caveolin-1(南华大学药物药理研究所赠送);链脲菌素(STZ,Sigma,美国);兔抗大鼠caveolin-1 抗体(博奥森生物,中国);兔抗大鼠eNOS 抗体(博奥森生物,中国);NO 检测试剂盒(建成生物公司,中国);DAB 显色试剂盒(艾杰生物,中国);柠檬酸三钠(大茂化学,中国);柠檬酸(大茂化学,中国);青霉素(鲁抗医药,中国)。
1.2 实验方法
1.2.11 型糖尿病大鼠模型建立根据文献[12]方法,大鼠禁食12 h 后,将配好的STZ 溶液(0.l mol/L)经腹腔快速注射入大鼠体内,剂量为50 mg/kg。分别术后第3、7、14、21 天采尾静脉血测空腹血糖,当血糖浓度均高于16.8 mmol/L 为建模成功,最终有44 只大鼠造模成功。
1.2.2 实验分组根据随机化原则,将糖尿病模型大鼠分为4 组:假手术组、手术缺血组(模型组)、手术缺血空转染组(空转组)、缺血+caveilin-1转染组(转染组),每组11 只。假手术组则仅将右侧腹股沟皮肤切开,暴露股动脉后缝合,不离断股动脉;模型组单纯结扎离断股动脉及分支;空转染组在模型组的基础上,通过尾静脉注射不含caveolin-1 质粒的脂质体溶液;转染组为股动脉离断术后,从大鼠尾静脉注射含caveolin-1 的质粒进行转染。
1.2.3 建立糖尿病大鼠急性下肢缺血模型建模方法:各组大鼠应用3% 戊巴比妥钠以(1.5 mL/Kg)腹腔注射麻醉,麻醉成功后,将大鼠固定于手术台,在右侧腹股沟区做一2 cm 纵行切口,逐层分离并游离股动脉的上下端,除假手术组外,各组于股动脉起始部至股动脉末端结扎离断,避免损伤并行的静脉及神经,依次缝合切口(图1)。于术后14 d处死大鼠,取术侧腓肠肌组织进行下一步检测。
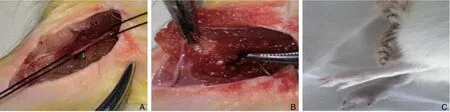
图1 建立大鼠下肢缺血模型 A:分离股动脉;B:结扎股动脉及分支;C:术后大鼠出现肢体发绀Figure 1 Establishment of rat model of limb ischemia A:Separation of the femoral artery;B:Ligation of the femoral artery and the branches;C:Limb cyanosis after operation
1.2.4 Caveolin-1 质粒转染方法备好的质粒和lipofectamineTM2000(Invitrogen,美国) 按1:3 的比例稀释于2 个无血清培养基中,室温静置4 min 后两者混合,再放置20 min 备用。空转染组:尾静脉注射不含质粒的脂质体溶液;转染组:通过尾静脉注射含有caveolin-1 的质粒的脂质体溶液进行转染;每只浓度为caveolin-15×109pfu。
1.2.5 ELISA 法检测肌肉组织中NO 的表达术后14 d 处死各组大鼠后,取出右下肢腓肠肌组织捣碎,高速离心后取上清液100 μL,根据试剂盒说明书,采用硝酸还原酶法检测一氧化氮(nitric oxide,NO)的含量,试验重复3 次取平均值。
1.2.6 缺血组织标本检测术后第14 d 处死各组大鼠取右下肢腓肠肌标本,剥离周围的肌腱和脂肪组织进行 HE 染色;免疫组化检测caveolin-1 和eNOS 蛋白的表达。用不同倍数光学显微镜(40、100、200 倍)观察切片,选取5 个视野观察肌纤维形态学变化,并拍照留下图像。使用Image J1.52V 软件对免疫组化样本图像进行分析,测其平均光密度值(average optical density,AOD)进行半定量分析。
1.2.7 微血管计数(MVD)腓肠肌组织进行CD34 免疫组化检测,以染成棕黄色的单个内皮细胞或内皮细胞簇作为1 个血管计数,在低倍镜下(40 倍)选择微血管密度最高的3 个区域,在高倍镜(200 倍)下计数微血管数,取其平均数为该标本的微血管数。
1.3 统计学处理
采用SPSS 22.0软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,两组间的比较采用独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
大鼠在注射STZ溶液后第3~4天开始出现饮水量、尿量、摄食量明显增加,体质量逐渐减轻、活动量降低、皮毛干燥无光泽。急性下肢缺血模型建立后,大鼠出现下肢皮肤温度降低、紫绀等症状,大鼠后肢屈曲,走路不稳,手术侧肌肉肌肉萎缩,肌张力明显弱于健侧,在观察期间转染组和模型组各死亡1只大鼠,死亡原因考虑为糖尿病酮症酸中毒和(或)切口感染所致。
2.2 HE 染色观察腓肠肌组织形态及炎细胞浸润情况
取各术侧组腓肠肌组织进行HE染色,将玻片放入不同倍数的显微镜下观察,腓肠肌细胞形无明显充血水肿,模型组及空转染组有多量炎症细胞浸润,且肌肉组织萎缩明显,转染组炎症细胞浸润较少,肌肉萎缩不明显(图2)。
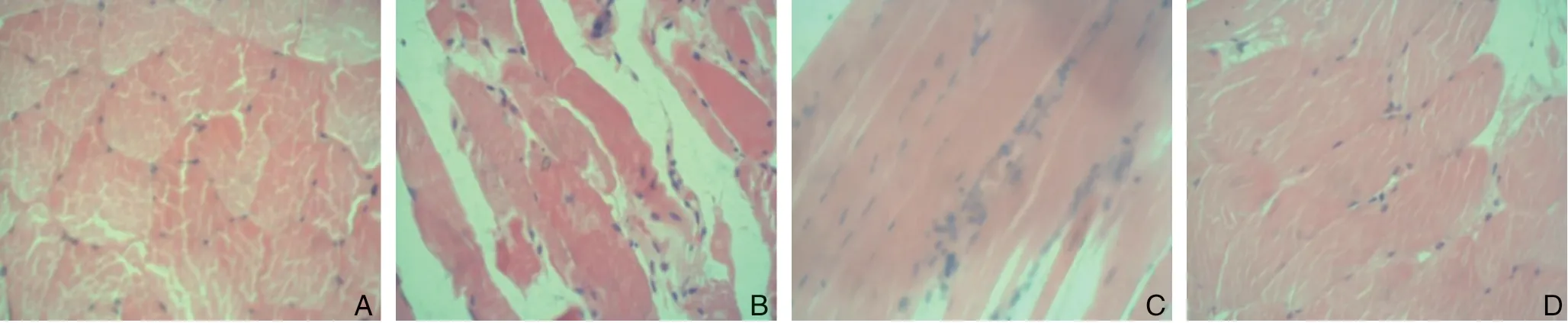
图2 各组腓肠肌组织HE 染色(×200) A:假手术组;B:模型组;C:空转组;D:转染组Figure 2 HE staining of gastrocnemius muscle tissue of each group(×200) A:Sham operation group;B:Model group;C:Empty transfection group;D:Transfection group
2.3 ELISA 检测各组NO 表达变化
NO在各组均有一定程度的表达,其中模型组、空转染组中的NO的表达低于假手术组(均P<0.01);而转染组NO水平明显高于其他各组(均P<0.01),模型组与空转组比较,差异无统计学意义(P>0.05)(表1)。
表1 各组腓肠肌肌肉组织中NO 的浓度(±s)Table 1 Concentrations of NO in gastrocnemius muscle tissues of each group(±s)
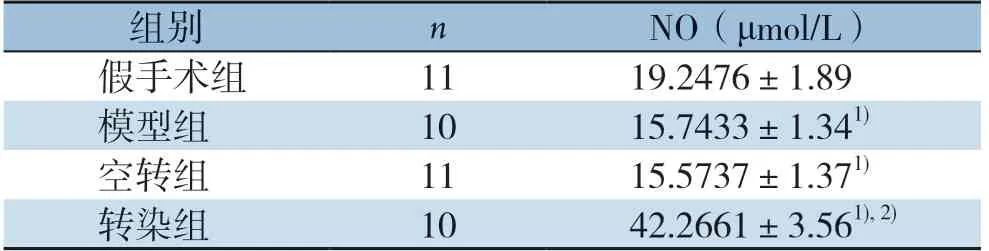
表1 各组腓肠肌肌肉组织中NO 的浓度(±s)Table 1 Concentrations of NO in gastrocnemius muscle tissues of each group(±s)
注:1)与假手术组比较,P<0.01;2)与模型组比较,P<0.01Note:1)P<0.01 vs.sham operation group;2)P<0.01 vs.model group
组别nNO(μmol/L)假手术组1119.2476±1.89模型组1015.7433±1.341)空转组1115.5737±1.371)转染组1042.2661±3.561),2)
2.4 免疫组化染色检测腓肠肌组织中caveolin-1和eNOS 的表达
P 染色法检测各组腓肠肌组织中caveolin-1和eNOS的表达情况,并用Image J1.52V图像分析软件进行半定量分析。结果显示,caveolin-1在各组均有表达,但转染组标本中caveolin-1蛋白的表达水平明显高于其他各组(P<0.01);而与假手术组比较,模型组、空转染组caveolin-1蛋白的表达升高(P<0.01);模型组与空转组比较,差异无统计学意义(P>0.05)(图3)(表2)。同样方法检测eNOS蛋白,结果显示,假手术组、空转染组和模型组的eNOS表达无统计学意义(P>0.05),而转染组的eNOS表达明显高于各组(P<0.01)(图4)(表3)。
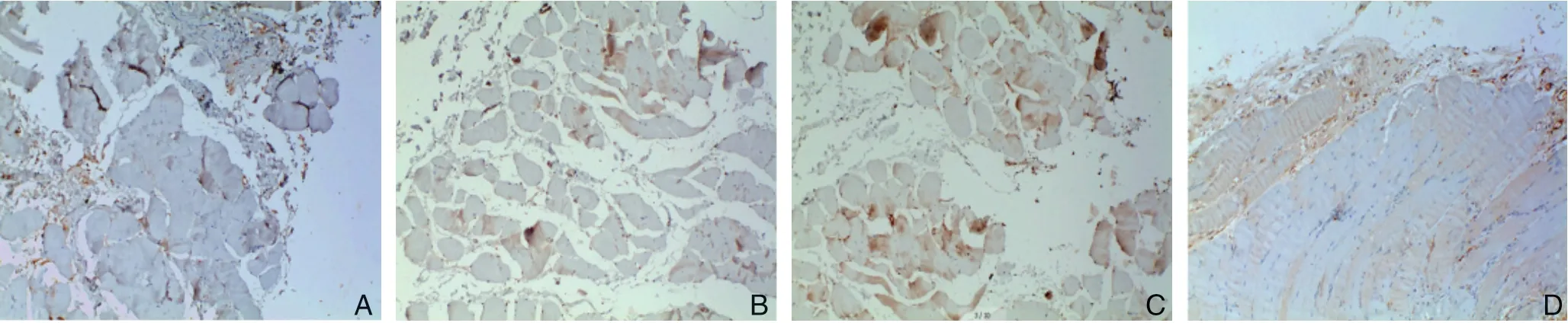
图3 各组腓肠肌组织caveolin-1 免疫组化染色(×100) A:假手术组;B:模型组;C:空转组;D:转染组Figure 3 Immunohistochemical staining for caveolin-1 in the gastrocnemius muscle tissues in each group(×100) A:Sham operation group;B:Model group;C:Empty transfection group;D:Transfection group
表2 免疫组化检测各组腓肠肌组织中caveolin-1 AOD 值(±s)Table 2 AOD values of immunohistochemical staining for caveolin-1 in the gastrocnemius muscle tissues of each group(±s)
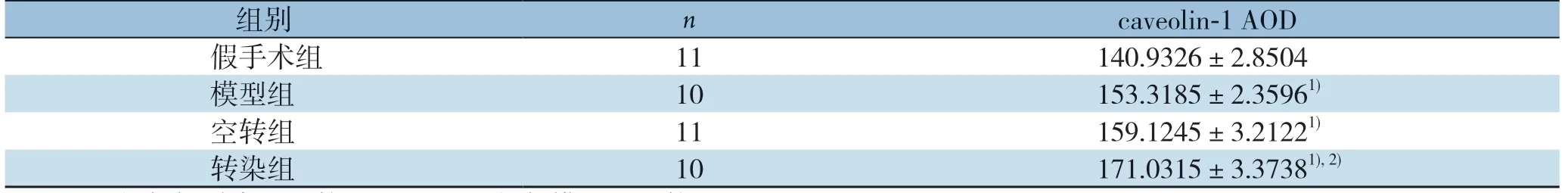
表2 免疫组化检测各组腓肠肌组织中caveolin-1 AOD 值(±s)Table 2 AOD values of immunohistochemical staining for caveolin-1 in the gastrocnemius muscle tissues of each group(±s)
注:1)与假手术组比较,P<0.01;2)与模型组比较,P<0.01Note:1)P<0.01 vs.sham operation group;2)P<0.01 vs.model group
组别ncaveolin-1 AOD假手术组11140.9326±2.8504模型组10153.3185±2.35961)空转组11159.1245±3.21221)转染组10171.0315±3.37381),2)
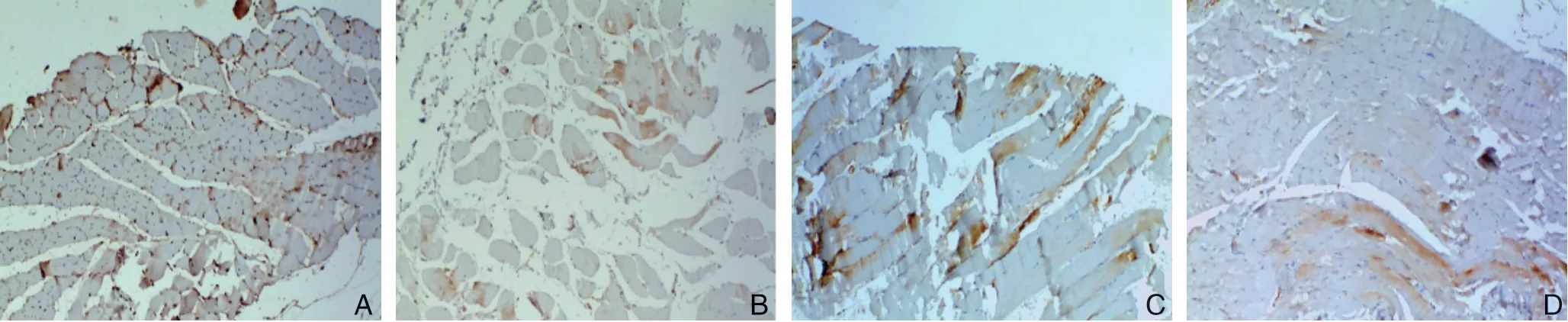
图4 免疫组化检测各组腓肠肌组织中eNOS 表达(×100) A:假手术组;B:模型组;C:空转组;D:转染组Figure 4 Immunohistochemical staining for eNOS in the gastrocnemius muscle tissues in each group(×100) A:Sham operation group;B:Model group;C:Empty transfection group;D:Transfection group
表3 免疫组化检测各组腓肠肌组织中eNOS AOD 值(±s)Table 3 AOD values of immunohistochemical staining for eNOS in the gastrocnemius muscle tissues of each group(±s)
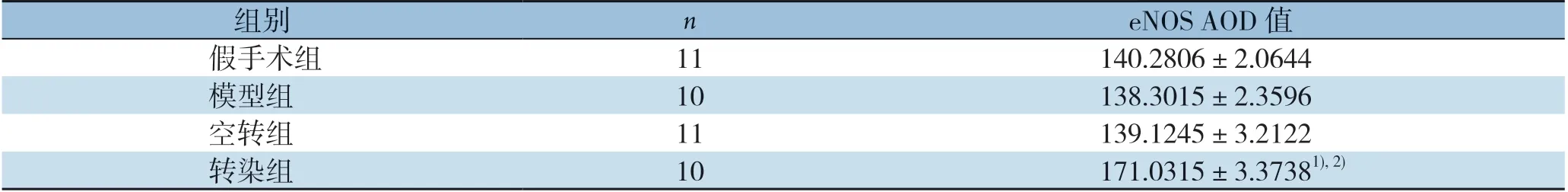
表3 免疫组化检测各组腓肠肌组织中eNOS AOD 值(±s)Table 3 AOD values of immunohistochemical staining for eNOS in the gastrocnemius muscle tissues of each group(±s)
注:1)与假手术组比较,P<0.01;2)与模型组比较,P<0.01Note:1)P<0.01 vs.sham operation group;2)P<0.01 vs.model group
组别neNOS AOD 值假手术组11140.2806±2.0644模型组10138.3015±2.3596空转组11139.1245±3.2122转染组10171.0315±3.37381),2)
2.5 CD34 免疫组化检测腓肠肌组织中MVD
免疫组化检测各组腓肠肌组织中CD34的表达并计数MVD,与假手术组比较,模型组及空转组棕褐色颗粒增加,CD34的表达量明显增加(均P<0.01);与模型组比较,转染组,CD34的表达量明显增加(P<0.01),模型组与空转组比较,差异无统计学意义(P>0.05)(图5-6)。
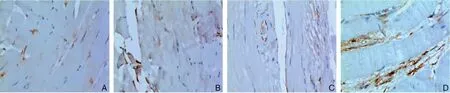
图5 CD34 免疫组化检测各组腓肠肌组织中MVD(×200) A:假手术组;B:模型组;C:空转组;D:转染组Figure 5 Immunohistochemical staining for CD34 marked MVD in the gastrocnemius muscle tissues of each group(×200) A:Sham operation group;B:Model group;C:Empty transfection group;D:Transfection group
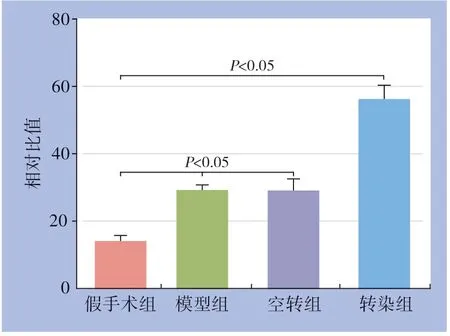
图6 各组腓肠肌组织中CD34 标记的MVD 比较Figure 6 Comparison of the values of CD34 marked MVD in the gastrocnemius muscle tissues among groups
3 讨论
糖尿病下肢血管病变是由于机体内长期处于高血糖环境,引起血管内皮细胞的的脂质过氧化、蛋白质变性及炎性损伤,诱导动脉粥样硬化、中小动脉血栓形成最终导致血管狭窄或闭塞[13-15]。研究显示,糖尿病患者合并有下肢血管病变者高达50%以上[16],其截肢率是非糖尿病患者的15~30倍[17-18]。而目前手术及药物治疗糖尿病下肢血管病变的效果并不理想[19]。因此,如何促进糖尿病肢体血液循环,改善患者生活质量,降低致死致残率发生,是临床急需解决的问题。
caveolin-1是小凹(caveolae)表面的信号传递蛋白能,诱导多种信号蛋白的活化或沉默,广泛表达于血管内皮细胞、平滑肌细胞等细胞中,在心血管疾病中发挥重要的生物学效应[20-21]。研究[22]表明,机体出现组织缺血时caveolin-1的高表达可促进血管新生,并对组织缺血、血流再灌注发挥有益的效应。Jasmin等[23]发现,将被敲除caveolin-1基因的大鼠结扎股动脉后缺血明显加重,肢体出现不可逆的坏死,而提高caveolin-1基因表达后血管再生能力则恢复,下肢缺血得以改善。另外,caveolin-1还参与了糖尿病病变过程,敲除了大鼠caveolin-1基因后,大鼠的血糖明显增高,组织中胰岛素受体水下降可高达90%的[24]。而caveolin-1在糖尿病下肢缺血中的作用如何,目前较少报道,实验通过结扎股动脉建立糖尿病大鼠下肢缺血模型,转染caveolin-1使其高表达,结果显示caveolin-1转染后微血管形成增多,肢体缺血缓解,提示caveolin-1在糖尿病下肢缺血中可诱导血管新生,改善局部血流灌注。
NO是机体内一种作用广泛的气信号分子,可调节血管舒缩[25],抑制血小板聚集[26],促进血管新生[27],减轻氧化应激损伤[28],是重要血管保护因子。NO是由内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)催化左旋精氨酸和氧反应生成,eNOS/NO信号通路在血管新生过程中起着多重促进效应[29-30]。有研究[31]表明,NO的生成及利用率降低引起内皮依赖性血管舒张因子功能障碍是糖尿病周围血管病变重要原因。Caveolin-1是eNOS的“分子伴娘”,eNOS位于caveolae内并与caveolin-1结合形成复合体[32],caveolin-1可以促进AKT的磷酸化,使其eNOS 发生丝氨酸磷酸化,从而增加 NO的生成[33]。那么caveolin-1促进糖尿病大鼠下肢缺血部位血管新生是否与eNOS/NO通路相关?从实验图5可以发现,糖尿病下肢缺血大鼠转染caveolin-1后,eNOS和NO表达明显升高,说明caveolin-1在糖尿病下肢缺血模型中促进血管新生作用是通过活化eNOS促进NO表达其作用。但是,本实验存在很多不足,如仅仅在动物水平阐述caveolin-1对糖尿病下肢缺血大鼠的作用,缺乏细胞水平及其更加详细的分子机制研究,我们将在后续工作中进一步完成。
综上所述,caveolin-1的高表达在糖尿病大鼠下肢缺血部位具有促进血管新生的作用,其机制可能与活化eNOS/NO通路有关,但其具体分子机制仍需进一步研究。

