微氧连续导入沼气发酵系统原位脱硫研究
林春绵,刘 雯,楼毕觉,陈文佳
(浙江工业大学 环境学院,浙江 杭州 310014)
据统计,2018年我国煤能源消耗总量为46.4 亿吨,增速达到5 年来最高水平。其中,天然气消费量增速加快,同比增长约17.7%,达到2 808 亿立方米,创历史新高[1]。国内天然气需求量远大于天然气的产量[2],如何降低煤炭的消费比重,填补天然气缺口,优化能源供应结构是当前能源发展的新方向。沼气中含有CH460%~70%,CO230%~40%,H2S 0.1%~3%,并含有少量的H2O、SO2、H2、N2、CO和卤代烃等[3-4],其中H2S是有毒气体,会对收集管道及设备产生腐蚀作用,其燃烧后生成的SO2不仅会导致环境污染和危害人体健康[5],还会降低沼气的利用率。因此,沼气在拓宽应用领域前需要进行净化(脱硫)处理。
目前常用的沼气脱硫工艺有:干法脱硫、湿法脱硫及其他方法(如生物脱硫、原位脱硫等[6-13])。干法和湿法脱硫都属于传统脱硫方法,都存在脱硫效率低、易产生二次污染和运行管理费用高等缺点,限制其进一步发展。相比之下,微氧原位脱硫是一种向厌氧发酵系统中导入微量的O2,使之与沼气中的H2S反应生成单质硫或硫酸盐的新兴脱硫方法[14]。Fdz-Polanco等[15]将微氧(0.013~0.024 L/L)通入污泥厌氧发酵反应器中,能去除沼气中99%的H2S。结合课题组前期研究可知[16]:在厌氧发酵系统中间歇通入微氧的脱硫技术,通氧组的硫氧化菌体积分数明显高于不通氧组,硫氧化菌利用O2作为H2S氧化的电子受体,将沼气中的H2S氧化成硫磺(约80%)和少量的硫酸根,发酵系统中丰富的C、N等元素为硫氧化菌的生长提供足够的营养。硫氧化菌的存在使得沼气中的H2S及时转化,减轻了H2S对产甲烷菌的抑制作用,从而提高甲烷产量。由于通常实验装置较小,对O2的需求量很小,目前的研究主要采用间歇式通入一定的O2。但是,间歇式供氧不能保证发酵系统O2质量浓度的稳定性,从而影响H2S的脱除效果,乃至对发酵系统产生冲击。笔者搭建一套可连续通入微量O2的小试装置,以草坪干草为发酵底物,探索是否补加底物及通氧量对沼气发酵的影响,为微氧原位脱硫的实际工程应用提供一定的理论基础。
1 材料与方法
1.1 材 料
草坪干草取自浙江工业大学朝晖校区草坪,总固体(TS)为(85.4±0.5)%,挥发性固体(VS)为(80.3±0.7)%,水分质量分数为14.6%,硫质量分数为0.136%,实验前将干草粉碎,粒径大小为20~40 目。沼液取自杭州正兴牧业有限公司,总固体为(4.1±0.8)%,挥发性固体为(2.7±0.9)%,碳质量分数为0.064%,氮质量分数为0.506%,硫质量分数为0.029%,pH为7.26。
1.2 实验装置
图1为沼气发酵实验装置图。采用容积为1 L的发酵瓶发酵,向发酵瓶中加入46.4 g草坪干草、400 mL新鲜沼液和水,控制总体积为700 mL,TS为(8±0.1)%。发酵瓶用橡胶塞密封,橡胶塞上带有取液针的,用氩气置换发酵液上方的空气,营造厌氧氛围。利用蠕动泵向压氧瓶连续注入纯净水,将O2连续压入发酵瓶。发酵瓶置于恒温(35±1)℃水浴锅内,产生的沼气进入浮力式集气桶。根据前日沼气产量和H2S体积分数,通氧量分别为H2S量的1倍、2倍、3倍。当发酵至第8 天(产气量显著降低),取出发酵瓶中的沼渣,并补加等量的草坪干草,继续发酵至第16 天。设置3 组平行实验和不通O2的对照组。在整个厌氧发酵周期中,每日通氧量如表1所示。
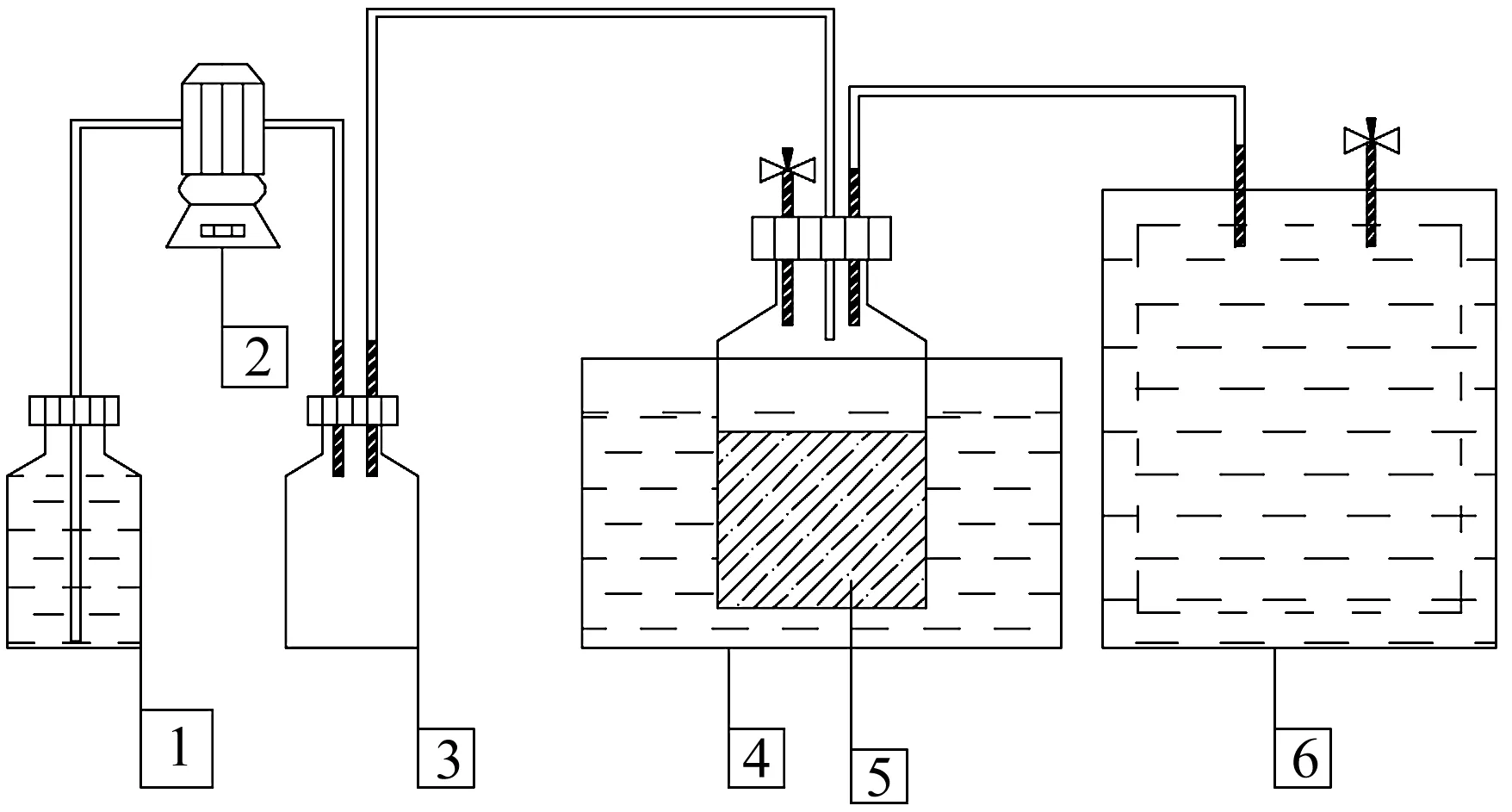
1—纯水瓶;2—蠕动泵;3—压氧瓶;4—恒温水浴锅;5—发酵瓶;6—浮力式集气桶。
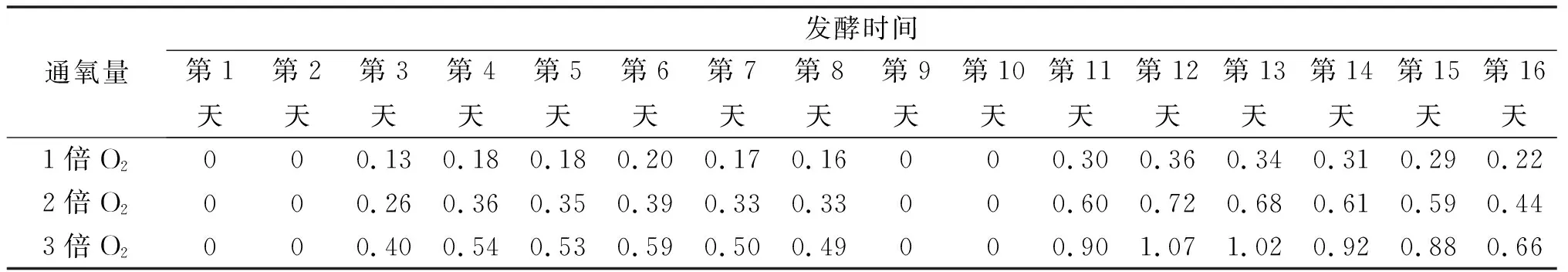
表1 发酵过程通氧量
1.3 分析方法
草坪干草和沼液的TS、VS采用干重法测定;沼气中的CO2和残留的O2体积分数利用气相色谱(GC-1690,科晓)和热导检测器(TCD)测定;沼气中的H2S采用气相色谱(GC-2014,岛津)和火焰光度检测器(PFD)测定;沼液的pH用pH计(雷磁PHB-4)测定;沼液中的挥发性脂肪酸质量浓度(VFAS)采用气相色谱(GC-6890,Agilent)和火焰离子化检测器(FID)测定;沼液中的产甲烷菌落采用高通量测序技术鉴别。
2 结果与分析
2.1 补加干草对沼气的发酵影响
是否补加干草的沼气日产量如图2所示。由图2可知:在整个发酵周期中,不补加干草的沼气日产量总体呈缓慢下降的趋势,第16 天已降至99.9 cm3。相比不补加干草组,补加干草组在发酵前期(即1~8 d)沼气日产量同样呈下降趋势,但第8 天补加干草后,第9 天的沼气日产量明显升高,达到整个发酵周期的最高日产气量1 676.7 cm3,可能是由于微生物经历发酵前期已具有较高的活性,在补加干草后底物充足,促进了发酵产气。发酵第16 天,补加干草组比不补加干草的沼气日产量多将近600 cm3,表明补加干草可以使发酵始终处于高产气状态,提高沼气产量,且补加底物与实际工程应用中的连续投料更加接近,更具优势和指导意义,所以后续实验均在补加底物条件下进行。
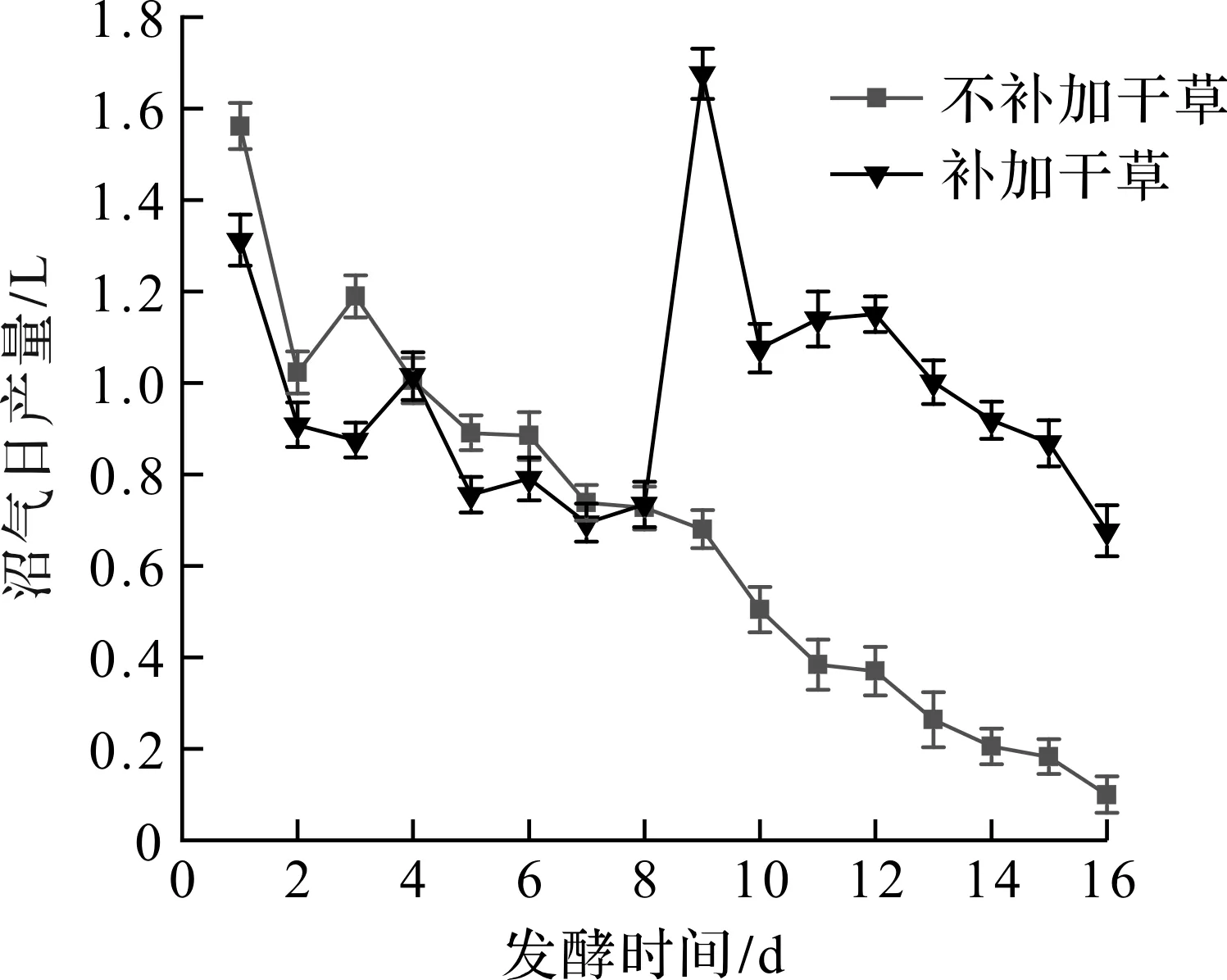
图2 是否补加干草的沼气日产量变化图
2.2 通氧量对沼气中CH4的影响
不同通氧条件下发酵系统中CH4体积分数及日产量如图3,4所示。由图3可知:发酵1~8 d,CH4体积分数先上升后随着底物的消耗而下降,发酵第8 天,补加干草后,发酵体系又进入到水解酸化过程,导致CH4体积分数迅速下降;发酵的9~16 d,实验组和对照组的CH4体积分数均呈先上升后平缓的趋势,基本都稳定在62%左右,可能是微生物活性稳定、发酵底物消耗导致CH4的体积分数也处于平稳的状态。结合图4可知:实验组CH4产量均高于对照组,其中通氧量为H2S量的2倍时,CH4产量明显高于其他几组。有研究指出:H2S会影响产甲烷菌的活性,通入微量的O2后,O2可以作为H2S氧化的电子受体,不仅达到将其从厌氧发酵体系中脱除的目的,同时也降低了其对产甲烷菌活性的抑制作用,从而促进了产甲烷菌对底物的分解,提高了CH4的体积分数[17]。说明发酵体系通入微氧有利于提高产甲烷菌活性,且在此实验条件下,通氧量为H2S的2倍具有较好的产甲烷效果。
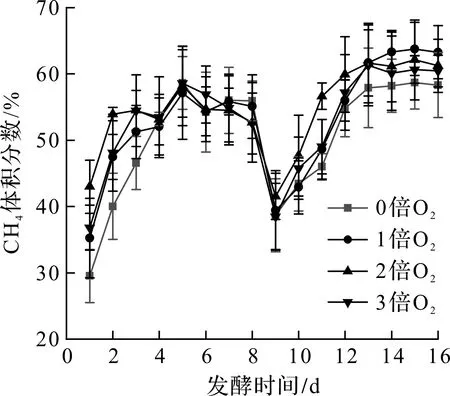
图3 不同通氧量下甲烷体积分数变化图
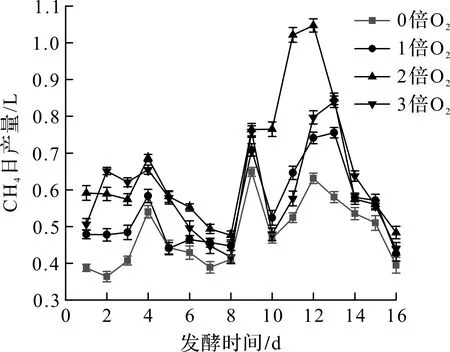
图4 不同通氧量下甲烷日产量变化图
不同通氧条件下发酵系统在不同发酵阶段CH4体积分数如表2所示。在通氧倍数相同的情况下,发酵9~16 d的CH4体积分数高于1~8 d,说明补加干草在一定程度上促进CH4体积分数增加;在发酵阶段相同的情况下,通2倍O2的CH4体积分数都高于其他几组;相比对照组,该组在整个发酵周期中,CH4体积分数高出4.2%,表明通2倍O2的条件对沼气发酵更有利。
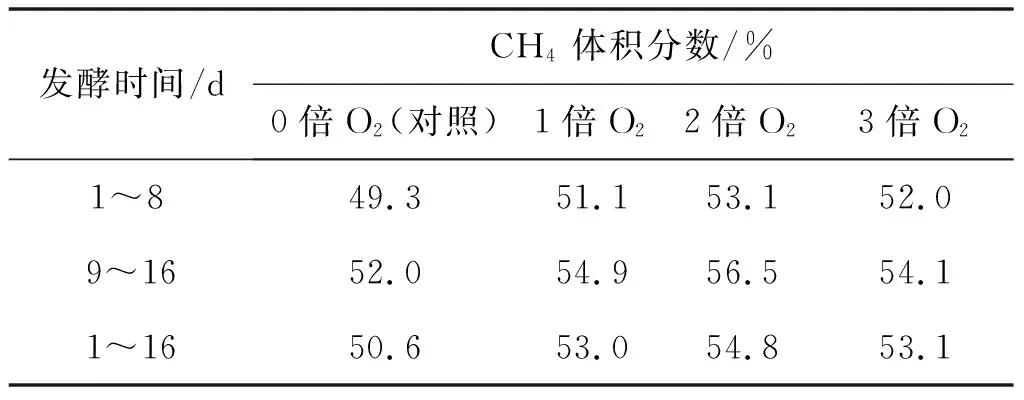
表2 不同发酵阶段各通氧量下CH4体积分数
2.3 通氧量对H2S脱除效果及残留O2体积分数的影响
不同通氧条件下发酵系统沼气中H2S质量浓度随发酵时间的变化如图5所示。发酵初期H2S质量浓度先升高然后逐渐降低,可能是产氢产酸阶段蛋白质水解导致较多H2S产生,随着发酵进入到产甲烷阶段,H2S质量浓度慢慢下降[18];第8 天补加干草后,H2S质量浓度再次呈先升高后下降的趋势,但实验组H2S质量浓度均低于对照组,其中2倍O2组下降最为明显,达到平均每天1 939 mg/m3。Díaz等研究指出[19]:在中温条件下,沼气微氧脱硫方法(每天通氧量为0.013~0.024 L/L)能使H2S去除率达到99%,且微氧运行过程没有对沼气产量和甲烷产率产生不利影响。说明通适量的O2并不影响发酵且有利于H2S脱除。
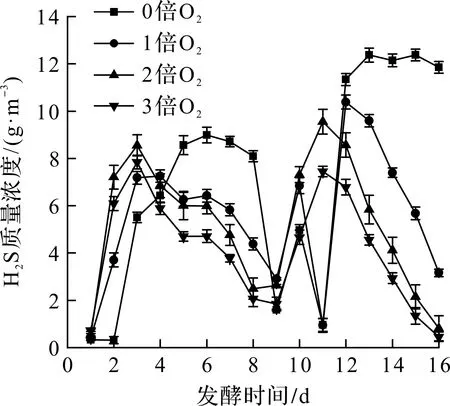
图5 不同通氧量下硫化氢质量浓度变化图
不同通氧条件下H2S质量浓度及去除效果如表3所示。由表3可知:发酵第16 天通1倍O2组H2S去除率仅为73.3%,说明1倍O2量不足以完全氧化沼气中的H2S;通3倍O2组H2S去除率最高,达96.2%,但是3倍O2组较2倍O2组的H2S脱除效果增加并不明显,表明继续加大通氧量,H2S的去除率也不会有明显的提高,可能还要考虑残留O2对发酵体系造成的影响。不同通氧条件下发酵系统中残留O2体积分数如图6所示。发酵第1天体系中O2的体积分数较高,可能是加入发酵瓶中的水或者沼液的溶解氧较高,在中温条件下溶解氧逸出导致的O2体积分数偏高。从第2 天直至发酵结束,O2体积分数因为补加干草有略微波动,但始终未超过0.5%,说明在小试装置中,解除完全密封状态的补加底物并不会对微氧发酵产生抑制作用。
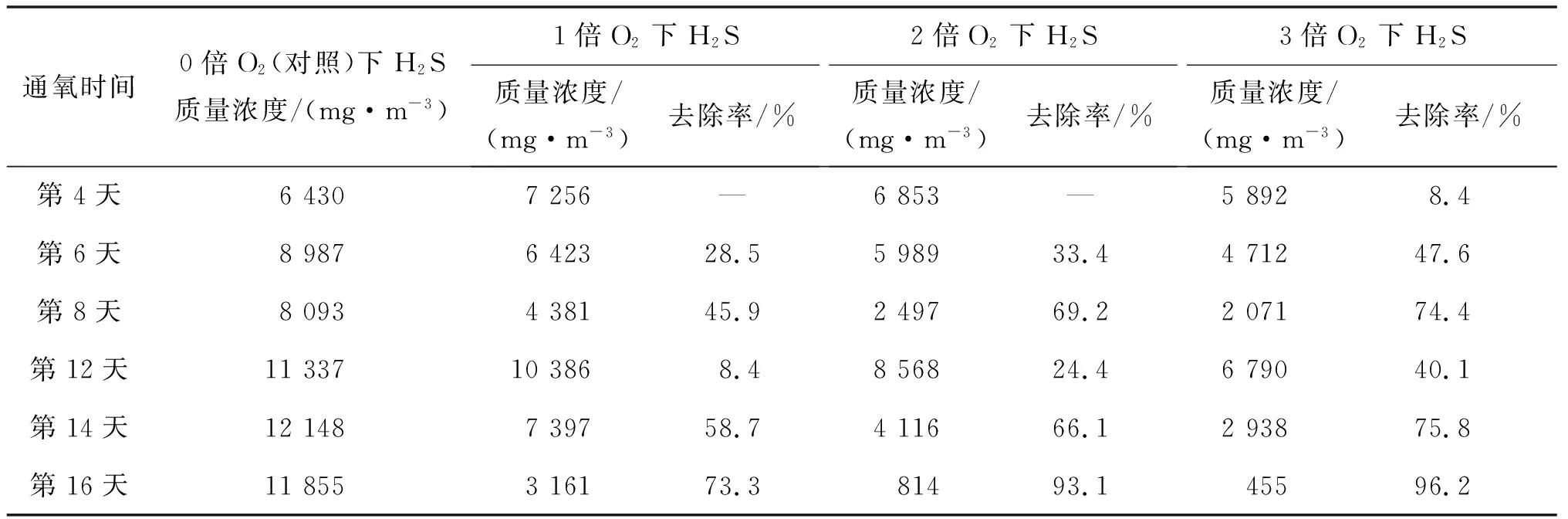
表3 不同通氧量下H2S质量浓度及去除率
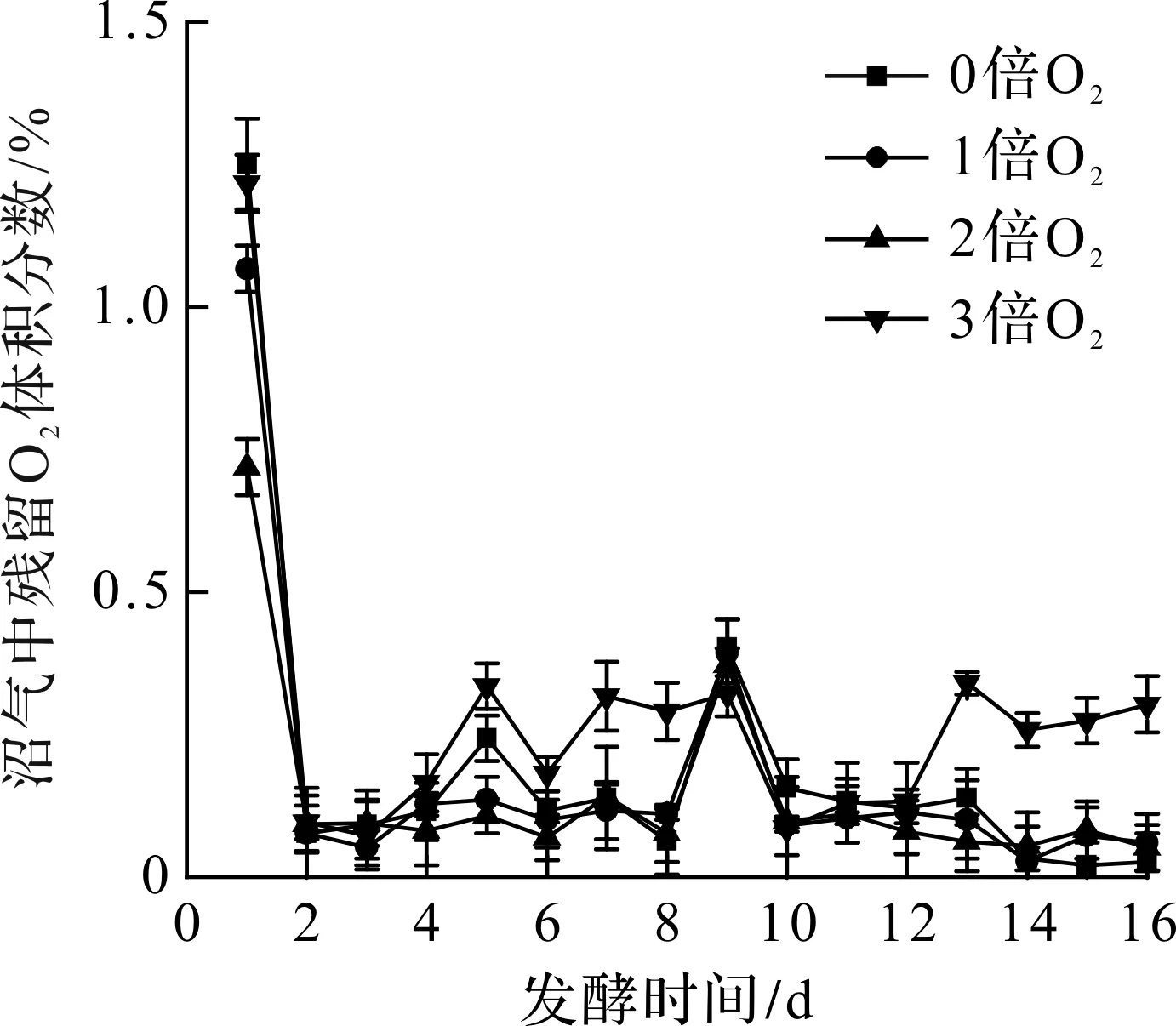
图6 不同通氧量下残留O2体积分数变化图
2.4 通氧量对发酵液VFAs质量浓度和pH的影响
不同通氧条件下发酵液中VFAs质量浓度如表4和图7所示。发酵第4 天,丁酸占较大优势,可能是由于水解酸化产生的挥发性短链脂肪酸(如丙酸、丁酸)等产物[20],未及时被产氢产乙酸菌利用转化为CO2、H2和乙酸[21],导致大量的丙酸、丁酸积累。发酵至第8 天,乙酸、丙酸和丁酸质量浓度迅速下降。重新补加干草后,整个系统再一次经历水解酸化阶段使各有机酸质量浓度升高,但未达到第4 天的质量浓度高峰,可能是因为产氢产乙酸菌保持着较高的活性,迅速将积累的丙酸、丁酸转化为乙酸、H2和CO2等产物,而乙酸则被产甲烷菌利用而消耗。结合图7可知:发酵后期实验组的VFAs质量浓度均略低于对照组,说明通适量的O2并未抑制VFAs降解,可能是因为脱除H2S的同时也解除了H2S对产甲烷菌的毒害作用,促进了VFAs的降解[22]。
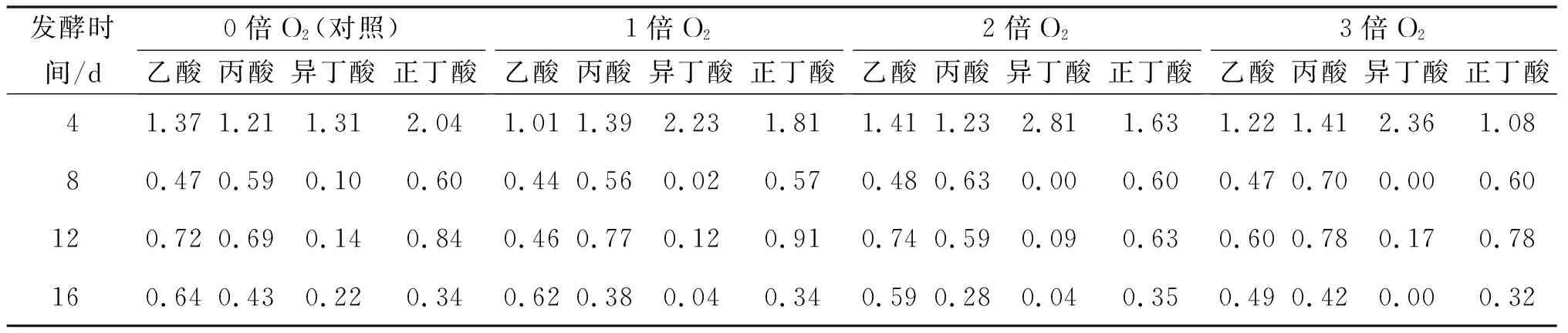
表4 发酵液中的VFAs质量浓度变化表
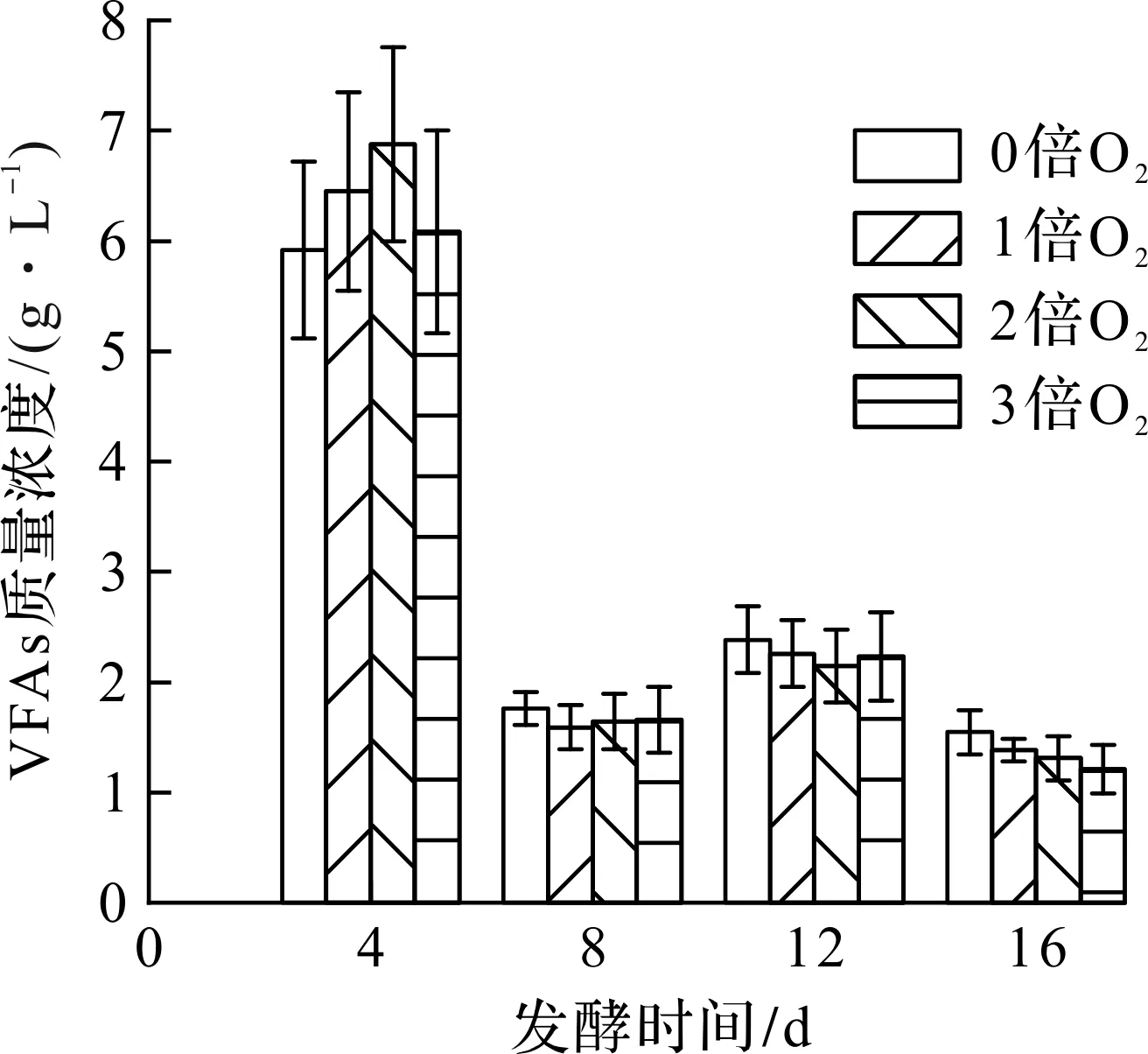
图7 不同通氧量下发酵液中VFAs质量浓度变化图
表5为发酵液pH随发酵时间的变化。如表5所示,发酵液整体的pH变化趋势并不明显,始终介于6.5~8.5。有文献指出,若pH高于8.5或低于6.5,均会对沼气发酵产生负面影响[23],这表明通氧量均未超过发酵系统可承受范围。再结合图7可知:pH随着VFAs质量浓度的变化而变化,发酵初期系统中VFAs大量累积,pH处于较低水平,至发酵后期VFAs逐渐降解,pH也逐渐升高。
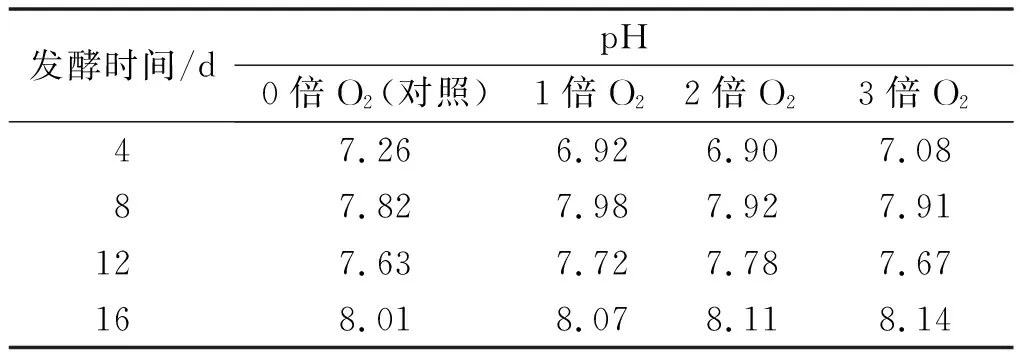
表5 发酵液pH变化表
2.5 通氧量对沼气发酵系统中微生物群落结构的影响
不同通氧条件下发酵液中产甲烷菌在属水平上Alpha多样性指数如表6所示。由表6可知:群落覆盖度Coverage指数均大于99.9%,表明本次测序数据量足够大,测序结果代表了样品的真实情况[24]。对比微生物群落丰度Sobs及Chao指数,实验组产甲烷菌丰度与对照组基本持平,通3倍O2组的丰度略高于对照组,说明通微量O2会使产甲烷菌群落丰度略微提高,可能是因为微量O2的存在使发酵系统中的好氧菌及兼性厌氧菌能够存活下来,从而提高了群落丰度[25]。同样,对比多样性Shannon指数,在发酵结束后,实验组的Shannon指数均略高于对照组,说明微氧通入厌氧发酵体系中并未对其造成不利影响,并且在属水平上略微提高了产甲烷菌的多样性。
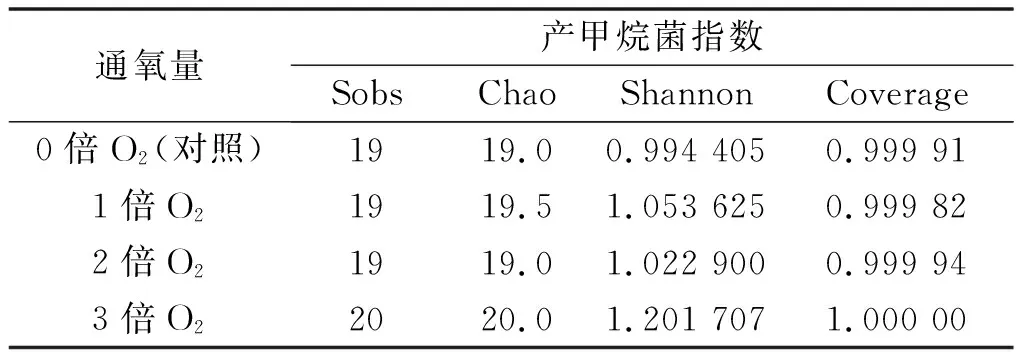
表6 产甲烷菌的多样性指数分析
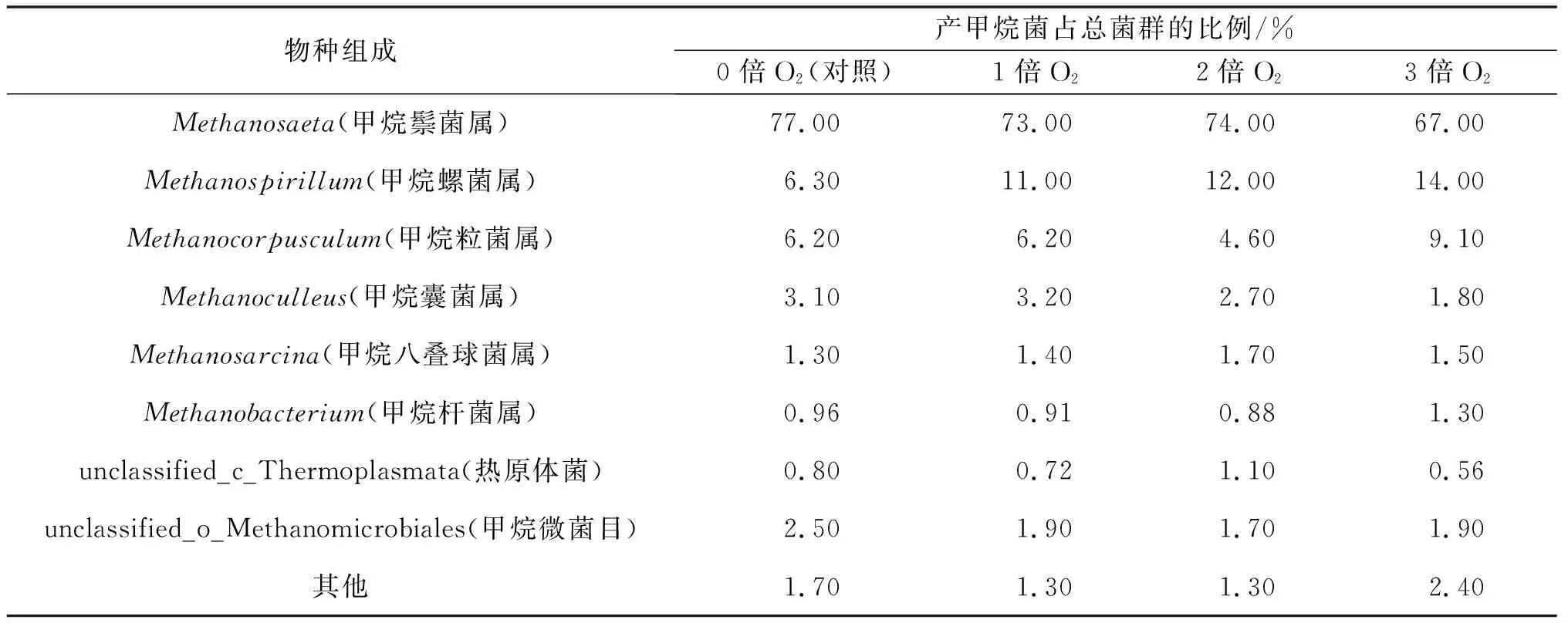
表7 发酵液中产甲烷菌在属水平上的组成
3 结 论
以草坪干草为底物在发酵过程中补加底物可以使发酵一直处于高产气状态,可以提高沼气产量,对工程应用更具指导作用。连续通微氧的实验组甲烷体积分数及日产量从整体上均高于对照组。在发酵末期,通氧量为2倍时,甲烷体积分数达到54.8%,高出对照组4.2%;通氧量为3倍时,甲烷体积分数略低于2倍O2组,但相较对照组高2.4%。表明沼气发酵体系通入适量的O2有利于甲烷的合成。H2S的去除率随通氧量增大而升高。通氧量为2倍时H2S去除率达到93.1%;通氧量提高到3倍时H2S去除率为96.2%,但提高并不明显。实验条件下沼气中氧气体积分数均低于0.5%,符合车用压缩天然气的要求。通入微量的氧气后,并未对VFAs降解产生抑制作用;同时pH随着VFAs的变化而变化,整体呈升高趋势,但始终维持在6.5~8.5。微生物群落分析结果表明:微量O2的通入不仅未破坏产甲烷菌的群落结构,而且增加了产甲烷菌的群落丰度及多样性;Methanosaeta和Methanospirillum属的微生物为优势菌属;微量O2导入发酵系统可有效地扩大Methanospirillum、Methanocorpusculum和Methanosarcina等菌群在属水平上的优势,从而提升甲烷产量。

