动脉瘤性蛛网膜下腔出血血管内介入后迟发性脑缺血情况 及统计分析
陈长兵,贾根来,张 鹏
(南通市如皋市人民医院神经外科,南通 226500)
aSAH指动脉瘤破裂后血液进入蛛网膜下腔后产生以头痛、恶心以及意识障碍等临床综合征,占急性脑卒中总病例数的55~10%,是病情凶险的脑血管疾病。世卫组织一项调查报道显示国内aSAH发病率大约2.0/10万每年,死亡率及致残率较高[1]。血管内介入治疗微创且具有针对性止血效果,在包括aSAH在内的众多急性脑出血中均具有良好的临床疗效。aSAH的高并发症率也是影响其预后的主要原因,其中DCI较为常见,出血后3~14d为发病高峰,黄充等[2]报道急性脑出血后其发病率约为14.24%~48.65%,脑血管痉挛、皮质扩散抑制、血-脑屏障破坏等均可能诱发DCI的形成。虽然DCI较为高发,但积极的干预治疗能有效降低其发病率,而这需要建立在明确其危险因素的基础上[3]。目前国内对aSAH后DCI的系统性logistic回归分析还较为缺乏,因此本研究纳入我院116例aSAH患者,调查aSAH血管内介入后迟发性脑缺血DCI情况及进行多因素logistic分析,为aSAH后DCI的防治提供理论依据,报道如下。
1 资料与方法
1.1 一般资料纳入标准:均符合中华医学会神经病学分会《中国脑出血诊治指南(2014)》[4];急性发病且72h内就诊;入院后均采取介入性血管栓塞术治疗;患者相关病历资料完整;未合并恶性肿瘤、严重心肝肾功能障碍及外伤等其他疾病;排除标准:非动脉瘤导致的脑出血;术后14d内死亡者;术后脑疝形成;开颅手术治疗者;病历资料确实或配合度较差者。本研究纳入对象为2013年8月~2017年8月于我院就诊的116例aSAH患者,所有患者均行血管内介入治疗,将术后发生DCI的患者设为DCI组,其余设为非DCI组。所有患者男性41例,女性29例;年龄36~76岁,平均(58.78±4.54)岁;发病至入院手术时间3~60h,平均(33.23±4.34)h。
1.2 方法所有患者入院后均进行血、尿常规、心电图以及影像学检查等基础检查,在征得患者及家属同意后进行介入性血管栓塞术治疗。术后观察14d内观察DCI发生情况,DCI诊断参照梅涛等[5]标准:(1)意识水平降低,出现新的导致神经功能受损的病灶,瞳孔光反应灵敏性下降,GCS或NHISS评分逐渐降低;(2)排除血管痉挛、脑水肿、再出血;(3)经颅多普勒(TCD)检查中动脉脑血液流速>120mL/s,收缩期>200mL/s;(4)出现症状后12h内CT和头颅CT灌注扫描显示脑梗死、缺血或血流情况不正常。
影响因素调查:查阅相关文献,并结合我院具体情况确定调查内容,包括两组入院改良Fisher分级、aSAH 严重程度Hunt- Hess等功能症状分级以及性别、年龄等病历资料。WFNS分级[6]:参照GCS评分,包括睁眼(4分)、语言(5分)、运动(6分),总分15分,WFNS分级I级GCS评分15分,无运动障碍;II级:13~14分,无运动障碍;III级:13~14分,有运动障碍;IV级:7~12分,V级:3~6分,设为WFNS分级≥Ⅳ级,WFNS分级<Ⅳ级;改良Fisher分级[7]:0级:无出血或仅存在脑实质或脑室内出血;I级:基底池出血;II级::仅见侧裂池或周边脑池出血;III级:蛛网膜下腔广泛出血或伴脑实质出血;Ⅳ级:周边脑池、基底池、侧裂池均存在较厚积血,设为改良 Fisher分级≥Ⅲ级、<Ⅲ级;Hunt-Hess分级[8]:0级~V级分别为动脉瘤未破裂与深度昏迷,去脑强直,生命垂危,设为Hunt-Hess分级≥Ⅲ级,<Ⅲ级;低钠血症:血清钠<135mmol/L;低蛋白血症:表现为总蛋白、白蛋白、血红蛋白减少,血清酶,血胆固醇降低,并伴有黏膜损害,水肿等临床表现;出血至手术时间;动脉瘤位置:颈内、前交通及大脑中动脉;年龄、性别、合并糖尿病、合并高血压;凝血功能:罗氏凝血检测仪检测术后PT、FIB、TT、APTT;记录术后卧床时间;术后治疗方法:抗纤溶止血治疗,升高血压,腰大池连续引流等。
1.3 统计学分析采用SPSS 20.00统计软件,计数资料均以百分率“%”的形式表示,单因素分析行χ2检验,计量资料以均数“”形式表示,组间单因素分析行独立样本t检验,采用logistic回归分析进行多因素分析,当P<0.05时表示差异具有统计学意义。
2 结果
2.1 aSAH患者血管内介入治疗后DCI发生情况116例aSAH患者血管内介入治疗后发生DCI24例,发生率20.69%。
2.2 aSAH患者血管内介入治疗后DCI单因素分析单因素分析显示WFNS分级、改良Fisher分级、Hunt-Hess分级、低钠血症、低蛋白血症、出血至手术时间、动脉瘤位置、PT、FIB、TT、APTT、卧床时间差异具有统计学意义(P<0.05),组间年龄、性别、合并糖尿病、合并高血压、术后治疗方法差异无统计学意义(P>0.05),见表1。
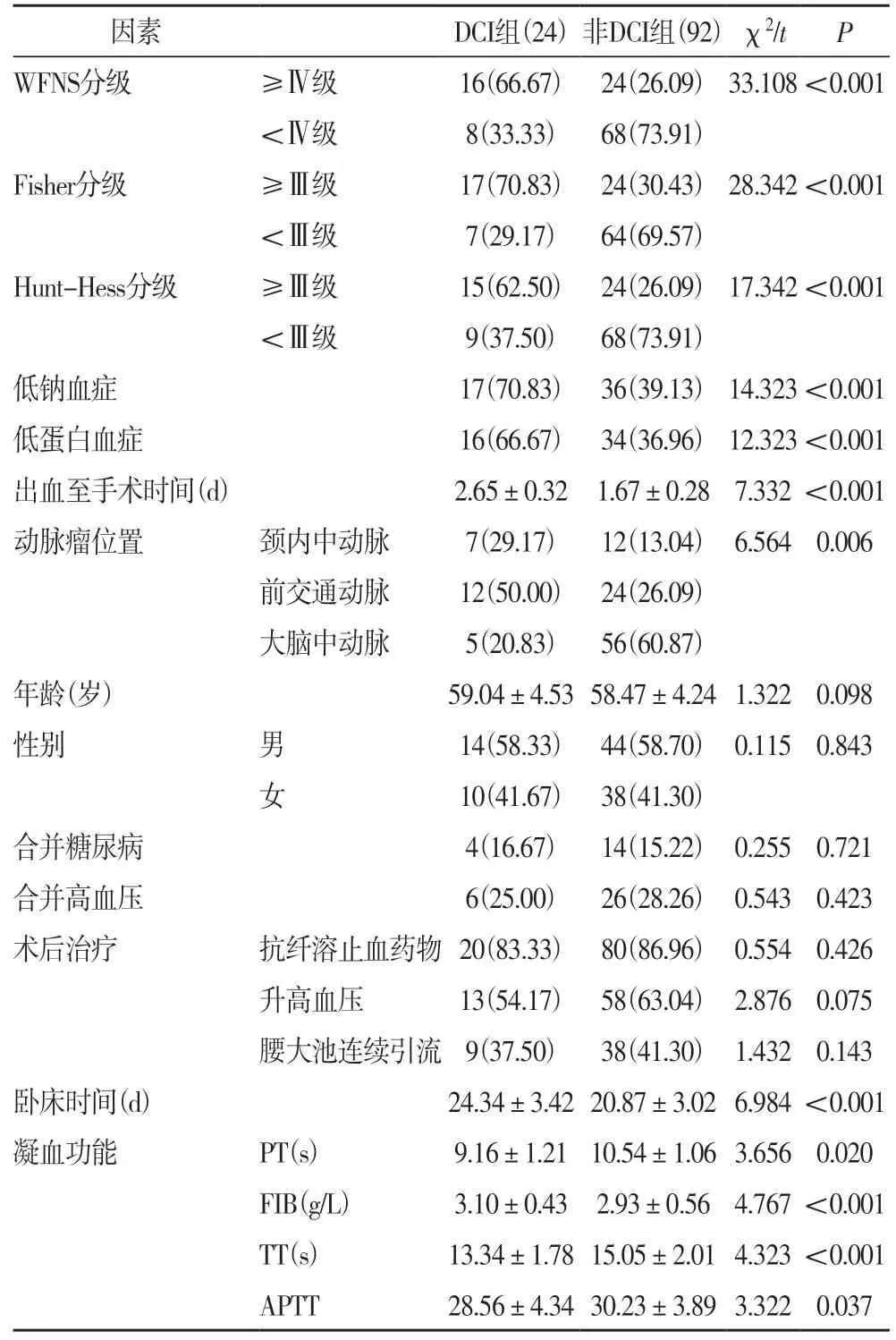
表1 aSAH患者血管内介入治疗后DCI单因素分析
2.3 aSAH患者血管内介入治疗后DCI多因素分析多因素logistic回归分析结果显示入院改良 Fisher分级≥Ⅲ级(OR=4.732)、WFNS分级≥Ⅳ级(OR=4.654)、Hunt-Hess分级≥Ⅲ级(OR=3.879)、低钠血症(OR=5.213)、低蛋白血症(OR=5.277)是aSAH血管内介入后DCI的独立危险因素,见表2。

表2 aSAH患者血管内介入治疗后DCI多因素分析
3 讨论
DCI是aSAH较为严重的并发症之一,也是aSAH患者致死、致残的独立危险因素之一。DCI主要因脑血管痉挛引起,但部分DCI患者血管造影显示无明显见脑血管痉挛,因此考虑aSAH后DCI的发生及发展还受其他因素的影响[9]。对患者病情进行早期评估,进行DCI的预测有利于预防及积极干预治疗,围手术期加强相关危险因素的监测在降低aSAH后DCI的发生具有重要意义,能最大程度地降低致残率、病死率,改善患者预后。本研究116例aSAH患者血管内介入治疗后发生DCI24例,发生率20.69%,与SY Oh等[10]18.23%~46.45%报道结果相一致,表明内介入治疗后aSAH仍然容易并发DCI,因此探寻其独立危险因素对防治策略的建立具有十分重要的意义。
本研究多因素logistic回归分析结果显示入院改良 Fisher分级≥Ⅲ级、WFNS分级≥Ⅳ级、Hunt-Hess分级≥Ⅲ级、低钠血症、低蛋白血症是aSAH血管内介入后DCI的独立危险因素。临床普遍认为普遍认为入院Hunt-Hess分级与aSAH患者的预后具有紧密的联系,I Fragata等[11]报道Hunt-Hess分级与aSAH患者致残率及死亡率具有正相关关系。Hunt-HessⅢ级、Ⅳ级者已经出现了较为严重的意识障碍,对脑组织缺血、出血的耐受性变差,当脑组织血流灌注不足时机体无法对脑组织缺血产生有效的代偿作用,易出现DCI相关症状。改良Fisher分级是用于aSAH患者CT影像评价出血量的指标之一,本研究改良Fisher分级≥Ⅲ级提示颅内血量较大,对脑池、脑沟周围脑组织产生相对更严重的刺激越导致积血、水肿,而积血量与DCI的发生及发展关系密切[12]。脑池、脑沟积血影响脑脊液循环,脑积水等并发症引发颅内压上升及脑血流灌注不足,最终导致DCI发生,本研究改良Fisher分级≥Ⅲ级(OR=3.879)作为aSAH血管内介入后DCI的独立危险因素与RD Stevens等[13]Fisher分级Ⅲ级、Ⅳ级(OR=3.965)报道结果相一致。WFNS分级主要用于GCS评分的分级,其级数越高提示患者昏迷及意识障碍越严重,杨进军等[14]报道脑卒中昏迷越严重者急性炎症反应、电解质紊乱等加重,而炎症反应、电解质紊乱在脑缺血的发生过程中也起到至关重要的作用,因此昏迷及意识障碍越严重的aSAH患者更容易出现DCI。
低蛋白血症患者表现为总蛋白、白蛋白、血红蛋白减少,血清酶,血胆固醇降低,其本身也是急性脑卒中的并发症之一。其中血白蛋白是多功能蛋白,具有黏附中性粒细胞以及脑保护作用,能够诱导合成一氧化氮(NO)合内皮细胞释放舒张因子,改善脑组织血液循环,改善血管痉挛及微血栓面积[15]。低蛋白血症患者脑水肿加重,难以通过有效血容量的维持以改善脑组织微循环,从而增加aSAH后DCI的发生风险。低钠血症直接降低细胞外液体渗透压,细胞外液体量减少可引起血容量降低,从而导致脑缺血的出现,有报道甚至出现aSAH后大面积脑梗死的情况[16]。本研究单因素分析中动脉瘤位置及出血至手术时间为非独立危险因素,有报道认为前交通动脉出血量较大,术后缺血性并发症发生率更高,而这一研究结果尚存在一定争议[17]。
综上所述,aSAH血管内介入后DCI发生率较高,改良 Fisher分级≥Ⅲ级、WFNS分级≥Ⅳ级、Hunt-Hess分级≥Ⅲ级、低钠血症、低钠血症均能增加DCI发生风险。

