指端容积血流脉动波、子宫动脉多普勒联合sFlt-1/PlGF比值对早发型子痫前期的预测
孙秀荣,张杰生,邓宇傲
(暨南大学第二临床医学院附属深圳市人民医院妇产科,深圳 518020)
子痫前期(PE)是以高血压和蛋白尿为主要特征的妊娠期特有疾病,在中国发病率约为9%。早发型PE(妊娠34周以前发病),因发病早,病情重,母婴预后差,近年来,备受关注[1]。因其病因尚不明确,并且缺乏有效治疗措施,故早期对其进行有效的预测显得极其重要。截止目前,仍然没有一种可靠、经济和实用的方法用于PE的筛查。鉴于早发型PE发病机制的复杂性,有学者提出在临床实践中应注意对胎盘-胎儿-母体间进行多角度分析和多方位思考可以反映早发型PE发生发展的各项指标进行联合筛查,为早发型PE的早期干预和治疗提供依据[2]。本研究选取PPG、子宫动脉多普勒以及sFlt-1/PlGF比值,探讨这些联合检测对PE,尤其是早发型PE的预测价值[3]。
1 资料与方法
1.1 研究对象选取 2016年7月~2020年7月在深圳市人民医院建母子保健手册并规律产检的孕妇500例作为研究对象。纳入标准:① 孕11~14周;② 单胎;③ 初产妇;④ 既往身体健康,无内外科合并症。⑤ 同意参加本研究并签署知情同意书。排除标准:① 病史资料不全;② 随访跟踪失联;③ 慢性高血压或PE家族史等。符合上述标准的有效样本共449例。参考《妊娠期高血压疾病诊治指南》(2020)[4]根据妊娠结局将研究对象分为正常对照组、早发型PE组、晚发型PE组。
1.2 研究方法
1.2.1 采用HC2180-D指夹式血流参数检测仪增强版采集同一研究对象孕11~14周、20~24周右手食指的容积血流脉动波形描记(PPG)信号,坐位,静息状态,右手与心脏处于同一水平位置,带上指夹式传感器,至少采集 3分钟时长的PPG信号,保证图形数量不少于200个[1]。根据检测孕周,分别记录为PPG RI:孕11~14周;PPG RI′:孕20~24周。
1.2.2 采用超声(Philips Medical Systems)探头频率为2-5 MHz,经腹部检查,采集同一研究对象孕20~24周双侧子宫动脉血流频谱。孕妇取仰卧位,纵切面确认宫颈位置后,将探头向中轴方向移动,彩超血流显像显示位于宫体与宫颈交界水平处的子宫动脉上行支,调整探头位置及角度,使声束与血管长轴夹角<30°,获得3个以上稳定的多普勒频谱后,测量并记录血流阻力参数UtA PI和UtA RI[1]。相同方法测量对侧,取平均值。
1.2.3 采集同一研究对象孕24~28周静脉血5mL离心取上层血清分装至两EP管,用罗氏Elecsys sFlt-1、Elecsys PIGF检测试剂盒,采用酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)分别检测样品血清中sFlt-1、PlGF的浓度,并计算sFlt-1/PlGF比值。
1.3 统计分析利用 SPSS 19.0统计软件进行数据分析,计量资料以mean±SD表示,组间比较采用单因素方差分析并检验方差齐性。若方差不齐,选择Tamhane's法;若方差齐,选择SNK检验。采用受试者工作特征曲线(ROC)评价不同指标及不同联合方案对PE的预测价值[3]。检验水准α=0.05,P<0.05差异有统计学意义。
2 结果
2.1 三组孕妇的组基本指标和预测指标比较表1结果显示,三组患者UtA PI、UtA RI、PPG RI、PPG RI′、sFlt-1/PlGF比值差异具有统计学意义(P<0.05);较之对照组,早发型PE组及晚发型PE组UtA PI、UtA RI、PPG RI、PPG RI′数值明显升高(表1,P<0.05),sFlt-1/PlGF比值明显升高(表1,P<0.05);较之晚发型PE组,早发型PE组UtA PI、UtA RI数值更高(表1,P<0.05),sFlt-1/PlGF比值更高(表1,P<0.05)。
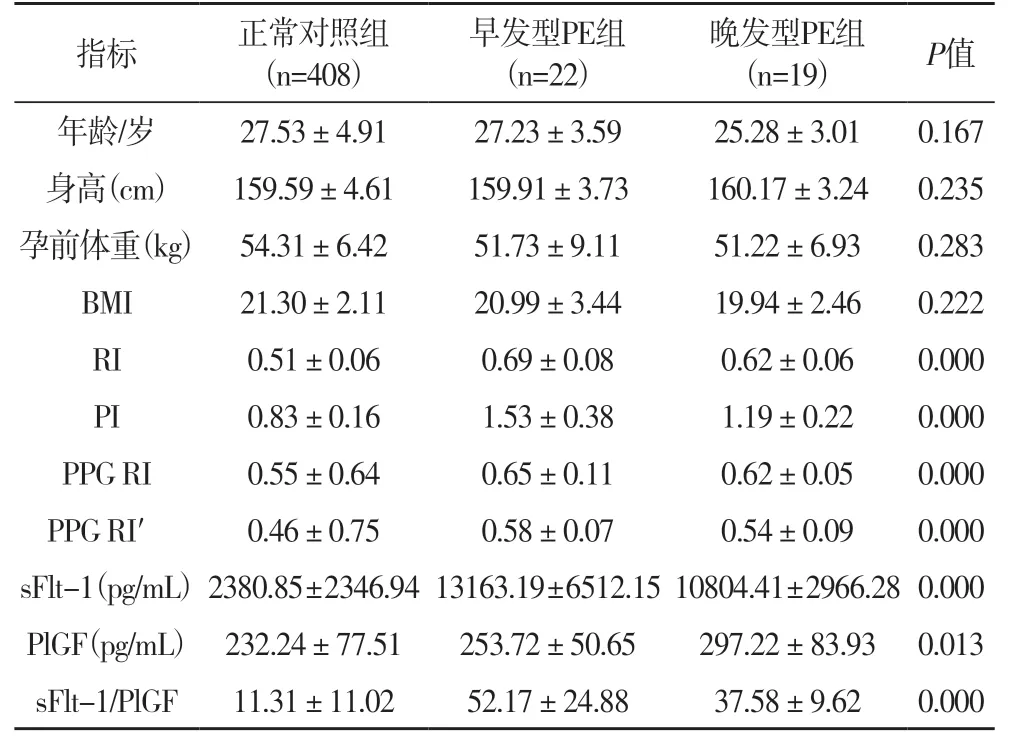
表1 正常对照组、早发型PE组、晚发型PE组基本指标和预测指标比较
2.2 PPG、子宫动脉多普勒、sFlt-1/PlGF单独及联合预测早发型PE 的ROC曲线特征UtA PI、UtA RI、PPG RI、PPG RI′单独预测早发型PE的AUC分别为0.826、0.819、0.798、0.833;4个指标联合预测早发型PE的AUC分别为0.939、0.73、0.95,结果见图1、表2。
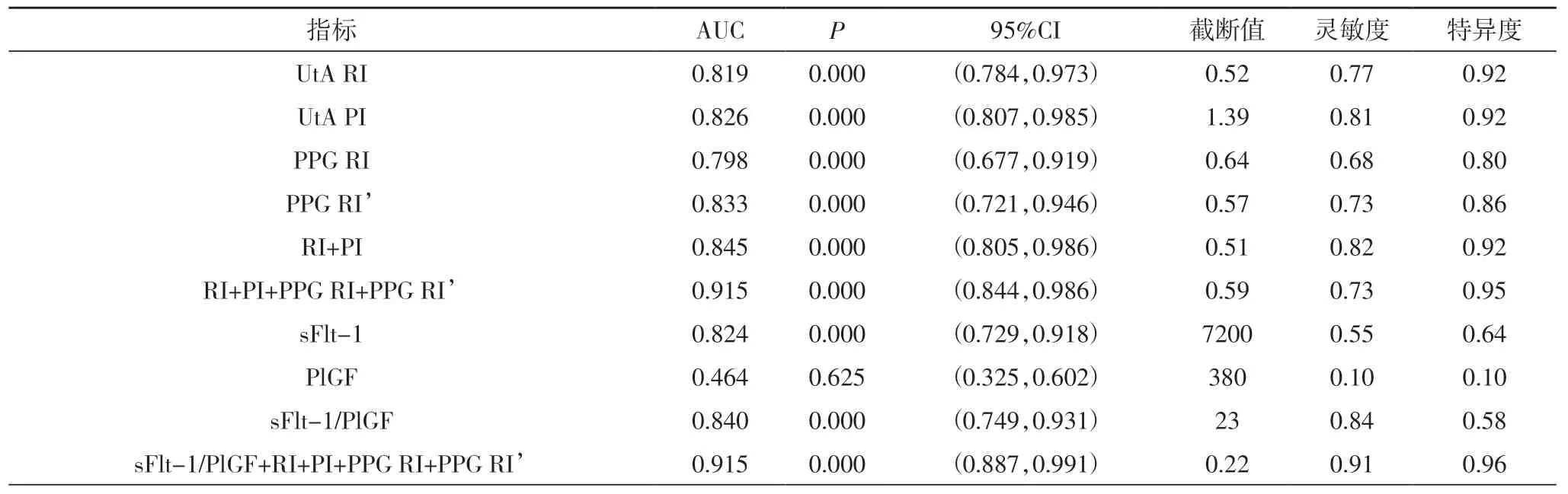
表2 各个指标单独及联合预测早发型PE的ROC曲线特征
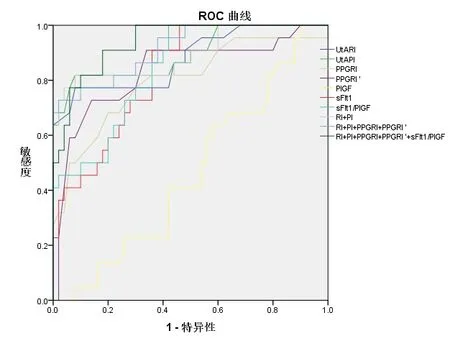
图1 PPG、子宫动脉多普勒、sFlt-1/PlGF单独及联合预测早发型PE 的ROC曲线
2.3 PPG、子宫动脉多普勒、sFlt-1/PlGF单独及联合预测晚发型PE 的ROC曲线特征UtA PI、UtA RI、PPG RI、PPG RI′单独预测晚发型PE的AUC分别为0.743、0.741、0.733、0.685,4个指标联合预测晚发型PE的AUC分别为0.757、0.90、0.73,结果见图2、表3。
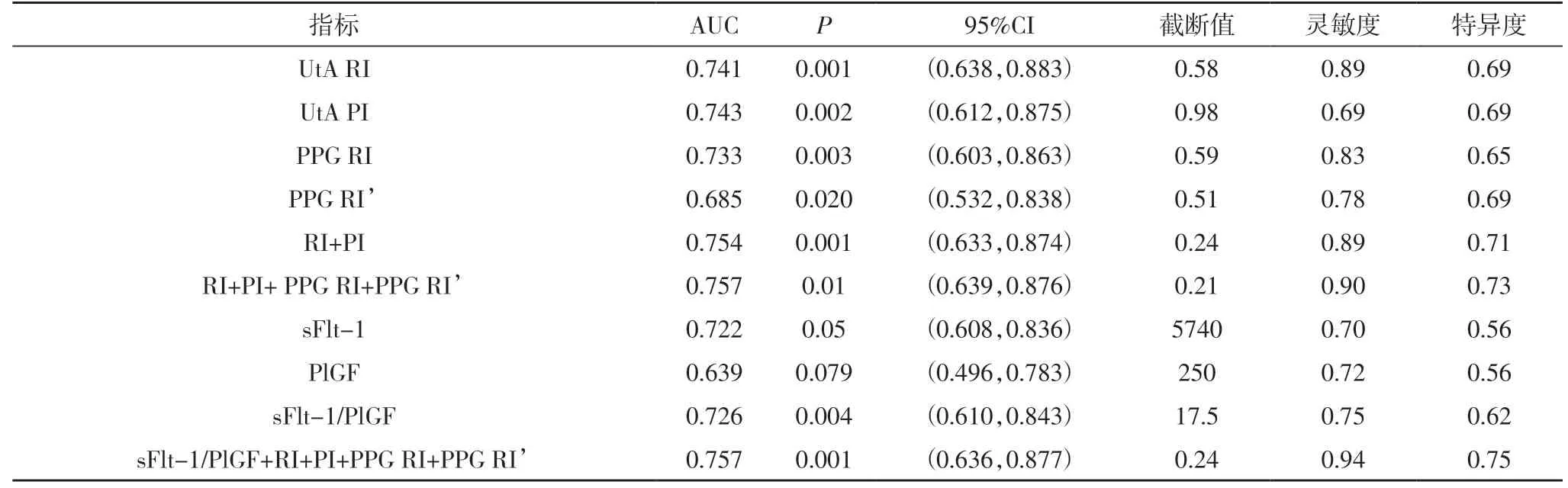
表3 各个指标单独及联合预测 晚发型PE 的ROC曲线特征
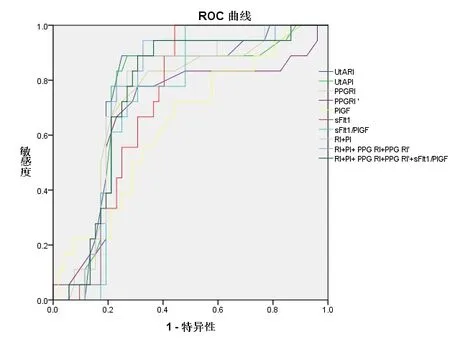
图2 PPG、子宫动脉多普勒、sFlt-1/PlGF单独及联合预测晚发型PE 的ROC曲线
3 讨论
早发型PE有以下特点:(1)病情重,以重度为主;(2)易出现各种严重合并症,可致母体各靶器官的损害;(3)发病时间早,围产儿预后差;(4)再次妊娠再发风险高[5]。尽管子痫前期大部分的发病机制尚不明确,但是近年来,关于子痫前期发病的双阶段理论被普遍接受:第一阶段为胎盘血管形成不良阶段,患者无明显临床表现;第二阶段为功能受损胎盘合成并释放各种可溶性循环因子,导致广泛内皮细胞损害,患者表现为血压升高、蛋白尿等临床综合征[6]。在出现临床症状前,孕妇就可能存在胎盘血管发育不良问题及胎盘激素分泌失调的情况。另外,过度的全身炎症反应会引起血管内皮功能障碍和相关的血管反应性增强,孕期母体适应过程中不同位置的血管功能性改变与PE的发生存在密切关系[7]。因此,在理论上是可能通过早期识别胎盘血管形成不良及外周血胎盘源性循环因子的异常情况而预测子痫前期的发生与发展。鉴于子痫前期发病机制的复杂性,目前尚无有效的单一检测方法能够有效地预测子痫前期的发生。因此,运用血清学标志物、超声、血流动力学等多指标对子痫前期发病机制进行多维度的纵向研究,进而筛选出比当前针对单个因素进行预测更加有效的方法势在必行。
本研究中用到的PPG,是一种结构简单、成本低廉、方便实用的光电信号检测技术,主要用于测量和分析外周微小血管的血液容积变化趋势,可以量化血管张力、评估血管内皮功能状态。我们项目组在前期的研究中发现PPG 反射指数即PPG RI在孕期表现出总体下降的趋势[7]。另外,PE患者子宫螺旋动脉重塑会不同程度受损,表现为子宫动脉阻力下降延缓甚至不降反增,导致子宫-胎盘循环障碍。胎盘血流灌注障碍可导致胎盘滋养细胞功能受损,释放细胞因子进入孕妇血液系统,破坏血管内皮细胞,导致全身性血管病变,表现为子痫前期[8]。因此,在妊娠早中期,尤其是孕20周前后的UtA PI和UtA RI,对PE的预测具有较高的临床价值。本研究结果显示,较之正常对照组,早发型PE组及晚发型PE组UtA PI、UtA RI、PPG RI、PPG RI′数值明显升高;较之晚发型PE组,早发型PE组UtA PI、UtA RI数值更高。本研究进一步利用ROC曲线检验超声及PPG对PE的预测效能,发现UtA PI、UtA RI、PPG RI、PPG RI′单独预测早发型PE的ROC曲线下面积AUC分别为0.826、0.819、0.798、0.833;单独预测晚发型PE的AUC分别为0.743、0.741、0.733、0.685,4个指标联合预测早发型PE的AUC、灵敏度、特异度分别为0.915、0.73、0.95;预测晚发型PE的AUC、灵敏度、特异度分别为0.757、0.90、0.73。结果表明,多指标联合可以明显提高对早发型PE的预测效能。
血管生成因子包括VEGF、PlGF、sFlt-1及sEng等,对胎盘血管的形成具有重要的意义,其比例失衡是PE发病的重要机制之一,有研究表明sFlt-1/PlGF比值能较好的反映抗血管活性,其效果优于单项血管因子指标,具有一定的应用前景[9-11]。本研究结果显示,较之正常对照组,早发型PE组及晚发型PE组sFlt-1/PlGF比值明显升高;较之晚发型PE组,早发型PE组sFlt-1/PlGF比值更高。这表明随着病情的加重,血管内皮损伤也逐渐加重。进一步对其预测效能进行检验后发现,sFlt-1、PlGF、sFlt-1/PlGF单独预测早发型PE的AUC分别为0.824、0.464、0.840,单独预测晚发型PE 的AUC 分别为0.722、0.639、0.726,预测效能较低。sFlt-1/PlGF联合全部子宫动脉超声指标及PPG RI、PPG RI′,对预测早发型PE的AUC可达0.939,对预测晚发型PE的AUC仅为0.786,对晚发型PE预测效能较低,对早发型PE预测效能十分显著。本研究结果提示早发型PE和晚发型PE可能存在不同的发病机制。
综上所述,子痫前期是一种多源性疾病。内皮细胞损伤是PE的主要病理生理基础,血管生成因子是导致内皮细胞损伤的重要因素[12]。鉴于早发型子痫前期发病机制的多源性,临床表现的严重性,对可能反映早发型PE发生发展的各项指标进行联合筛查,有效提高对早发型PE 预测的准确性,值得临床推广。

