肝癌肝切除围术期的规范化营养药物治疗服务模式的研究*
陈大宇,卞晓洁,刘金春,毛 谅,伏 旭,仇毓东,葛卫红**
南京大学医学院附属鼓楼医院 1 药学部;2 肝胆胰中心,南京 210008
肝癌,根据全球癌症发病率统计,位居所有癌症中第6 名,其致死率位居所有癌症第3 名;而我国的肝癌治疗则面临着更大的挑战,肝癌的发病率高居所有癌症中的第3 位,致死率则高居第2 位[1]。而肝切除术(Hepatectomy),即肝癌的外科治疗,则是现今原发性肝癌患者治疗肝癌并获得长期生存最重要的一种手段之一。然而,考虑到肝脏对于人体代谢功能的重要性,以及肝癌病情的严重性、肝脏手术的复杂性与对人体的创伤,对于需要行肝癌肝切除的患者,针对不同病情同样需要进行精准的个体化围术期药物治疗。
营养支持治疗的重要地位,在外科围术期主要体现在对围术期存在营养风险的患者进行营养支持,将对营养导致的术后并发症、临床结局有着显著改善,且已经得到大量研究及指南的支持[2]。
有研究报道称,癌症病人的营养风险发生率在39%~68%[2,3]。据统计,每年全球有200 万癌症患者死于严重的营养不良[4]。癌症的高代谢状况和脏器侵犯使患者营养物质损耗增加、合成削弱,甚至可能会出现口腔黏膜炎症与缺损而导致影响进食;而围术期癌症患者因病症而导致其潜在的出现营养风险,且更容易出现食欲不振、恶心、呕吐、腹泻、便秘等症状,影响到患者的预后。在肝癌肝切除患者中,由于手术的特殊部位,对患者全身的代谢、合成功能均会有较大的影响,此时围术期的营养支持与干预就显得尤为重要。
在肝切除的围术期管理中,肝切除术后肝功能的维护和肝再生的促进一直是备受关注的焦点。由于肝脏外科手术与其他普通外科手术不同,患者往往合并肝硬化、门脉高压等病理生理状态,术后存在缺血-再灌注、失血、肝组织丢失等损伤因素,造成能量和血浆蛋白的大量消耗,而营养支持治疗一直是肝切除围手术期肝功能保护的一项重要措施。
然而,营养治疗也不是多多益善。过量的营养治疗、错误的营养剂型配比、不当的营养治疗方式等,均有可能会对患者造成不良后果。因此,根据患者不同病情需求,选择适合患者的个体化营养治疗方式,是极为重要的。而对于肝脏手术,围术期存在的复杂用药需求,也对临床药师的工作提出了挑战。
1 研究方法
1.1 研究设计
此为单中心回顾性队列研究,所有在南京鼓楼医院肝胆外科收治入院的患者均在术前接受营养支持小组中临床药师的营养状况评估以及营养风险筛查。
在日常工作中,临床药师会根据患者病情,营养状况评估及营养风险筛查的结果,评估患者的营养治疗用药指征,设计营养治疗方案。营养治疗的用药指征在前期研究中经过研究认证[5-7],确立多个指南推荐的营养风险筛查量表(NRS2002)[8-10]及患者主观-全面评价量表(PG-SGA)[11]进行评估。营养治疗的用药方案经过循证医学研究和文献论证,采用高质量的临床证据及指南高级别推荐意见,制定了鼓楼医院院内《肝癌肝切除围术期营养治疗规范化规程》并在药师指导监护下严格遵循,其流程见图1。

图1 肝癌肝切除围术期营养治疗规范化规程
对于非药师监护的,药师仅仅进行了相关的评估,未进行营养治疗管理和用药监护,所有的营养治疗方案均遵从医师判断。
1.2 研究对象
本研究的受试者为2017 年7 月1 日至2019年6 月30 日于南京鼓楼医院肝胆外科收治入院诊断为肝癌或者肝占位(肝癌可能)拟行肝切除术的患者,并符合以下纳入标准:年龄≥18 岁;符合肝癌诊断标准,且需要手术治疗的;既往未进行全身化疗、放疗的患者;术后具有原发性肝细胞肝癌病理诊断的患者;有完整营养评估的患者。
排除标准:同时合并有其他部位的恶性肿瘤的患者;老年痴呆、脑血管疾病急性期及后遗症或病史采集不完整患者;术前存在局部或全身细菌感染且未能有效控制的患者;术前评估后存在手术禁忌的患者;术前存在休克等危重症的患者;术中发现转移灶或不能按照术前进行肝切除、需要扩大、中止手术的患者;术后病理诊断结果为良性的患者;因术后24 h 内出现严重并发症的患者;既往有其他恶性肿瘤病史或行器官移植的患者。
1.3 数据收集
本研究数据通过临床诊疗记录以及患者随访记录收集,包括患者基础病情及手术信息:年龄、性别、诊断及病史、NRS2002 评分、PG-SGA 评分、手术术程、术中出血以及术中肝门阻断时间;患者的各项疗效指标以及血液检查结果:谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TB)、国际标准化比值(INR)、白蛋白(ALB)、腹水状况、C 反应蛋白(CRP)、体重、体重指数(BMI)、前白蛋白(PA)、三头肌皮褶厚度(TSF)、上臂中点肌肉周径(MAMC)、非利手握力[12];患者的各项临床结局指标:术后住院时长、术后并发症等级、出院后30 天内再入院以及出院30 天内死亡;同时收集患者的住院药费、住院总费用。
三头肌皮褶厚度采用皮脂厚度计ABJYM380980 完成,选左侧肩峰和尺骨鹰嘴连线的中点为测量点并标记,测量时用左手的拇指和其余四指将此标记点的皮肤连同皮下组织一同捏起呈皱褶,并用皮脂测量器测量距拇指上方1 cm 处的皮褶根部宽度。非利手握力:采用电子握力计EH-101 进行测定。
1.4 临床结局及疗效指标
考虑手术、检查排期的影响,主要临床结局选用术后住院时长以及围术期并发症等级,围术期并发症采用Clavien-Dindo 分级标准[13](见表1),对并发症的严重程度进行评级。次要临床结局指标为患者的出院30 日内死亡率、出院30 日内再入院率、术后转入ICU 率、其他疗效指标,包括肝损害及肝功能指标:谷丙转氨酶、谷草转氨酶、总胆红素、国际标准化比值、白蛋白、腹水状况;炎症指标:C 反应蛋白;营养状况指标:体重、BMI、前白蛋白、三头肌皮褶厚度、握力。
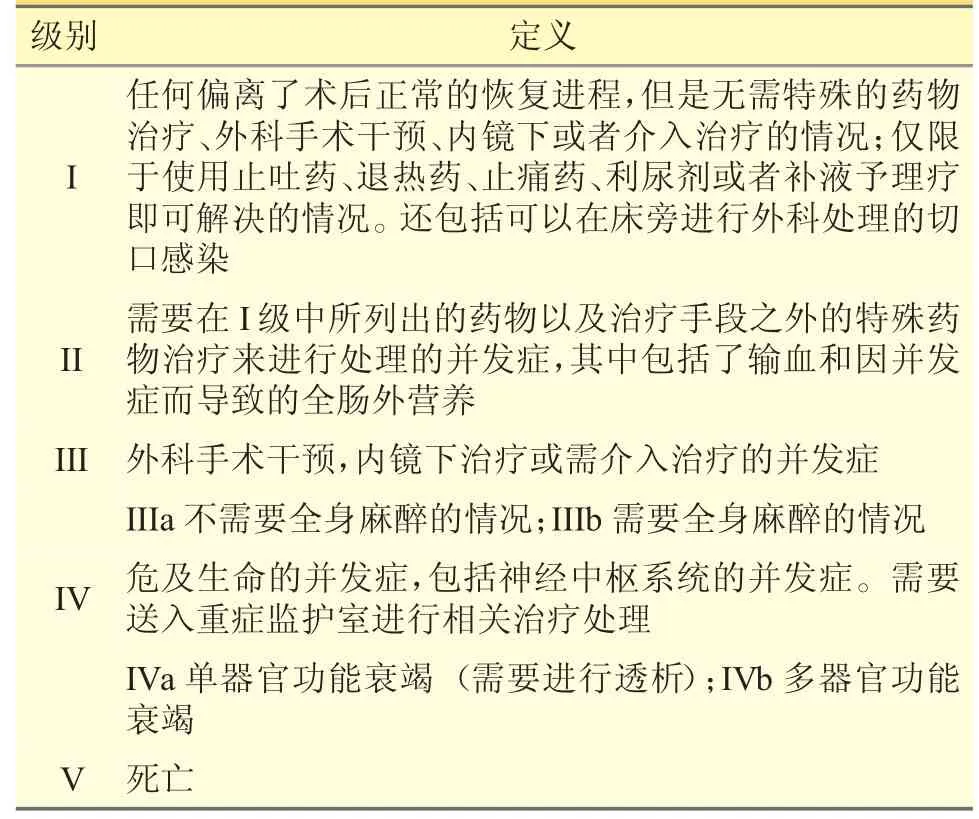
表1 并发症的Clavien-Dindo 分级标准
1.5 统计学分析
采用SPSS SE 22.0 软件对数据进行统计学分析。组间计数资料分布采用卡方检验。计量资料的比较,符合正态分布的数据采用t 检验,数据以均数±标准差(x±s)表示;不符合正态分布的数据采用Wilcoxon 秩和检验,数据以M(P25,P75)表示。以P<0.05 为差异具有统计学意义。
1.6 伦理,信息安全以及质量控制
本研究严格遵守赫尔辛基宣言,并经医院伦理委员会批准实施,伦理批件号为:2020-139-01。采用加密数据库存储相关信息,且数据中不包括可以追踪到受试者的隐私资料,如身份证号、病历号、地址、联系方式等。
为保证测量指标的准确性与客观性,减小误差,测量工具均经过校准,且为同一工具;所涉及的人体营养指标的测量均为同一名资深临床药师操作。
2 研究结果
2.1 患者基础情况
研究期间,共收治患者2912 人,其中符合初始入院评估标准的患者共191 名,其中,32 名存在术前细菌感染,17 名为复发性肝癌,11 名存在其他恶性肿瘤病史,9 名经检查发现其他部位恶性肿瘤,8名为转移性肝癌,5 名病历记录不清,5 名术中发现其他转移病灶,3 名因其他原因取消手术,2 名存在过敏性休克由ICU 转出,2 名术后病理为良性,1 名因术后出血24 h 内进行了二次手术。
最终纳入96 名,药师监护组(A 组)50 人,非药师监护组(B 组)46 人。患者的基础情况无统计学差异,各患者手术状况与术后第一天的生化检查同样无统计学差异。
2.2 临床结局以及疗效指标
本研究的首要临床结局为患者的术后住院时长及并发症等级,未发现两组之间的术后住院时长存在统计学差异;在并发症等级上,发现A 组的并发症等级更低,总的无并发症患者更少,并发症等级也较B 组更低(P=0.02)。
对于次要临床结局,30 日再入院的患者比例,两组间无统计学差异;两组也均未出现出院后30天内死亡病例。对于转入ICU 进行治疗的患者,A组也更低(P=0.049)。见表2。
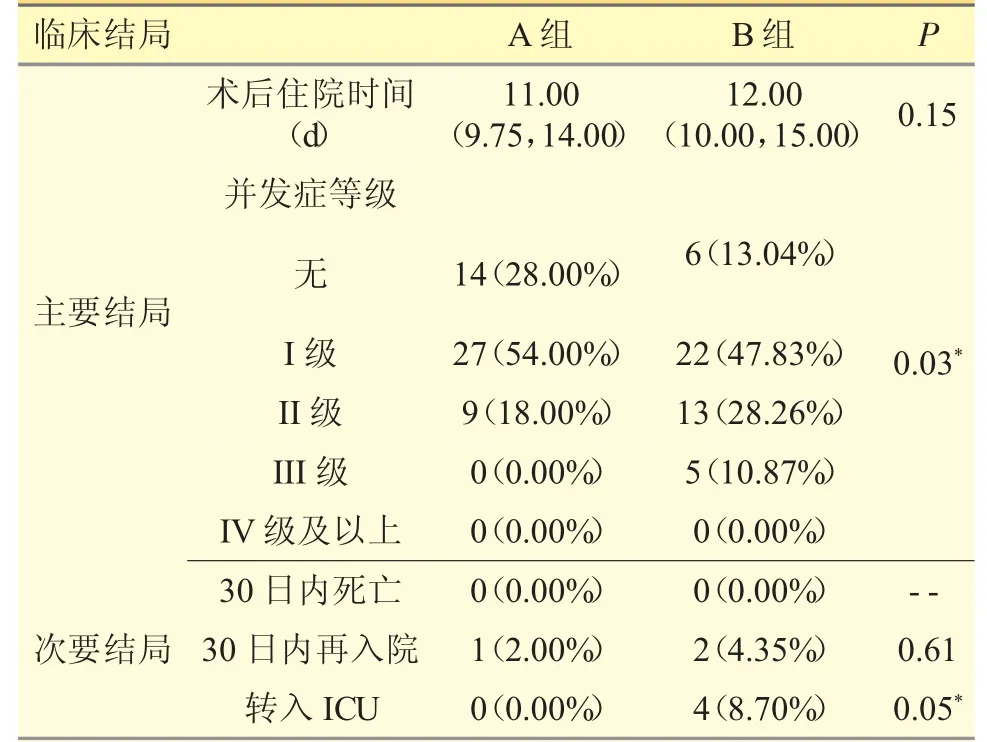
表2 患者临床结局
在术后第8 天的其他疗效指标中,A 组的白蛋白与非利手握力显著高于B 组(P<0.05),而在术后的变化值上,A 组的体重(P<0.001)、BMI(P=0.002)、白蛋白(P<0.05)的术后变化均显著少于B 组,提示营养治疗效果较好。而A 组的CRP 下降显著高于B组(P=0.02),表明A 组炎症应激反应纠正更快。在肝损害的恢复速度和程度上(ALT、AST),两组间并无差异。见表3。
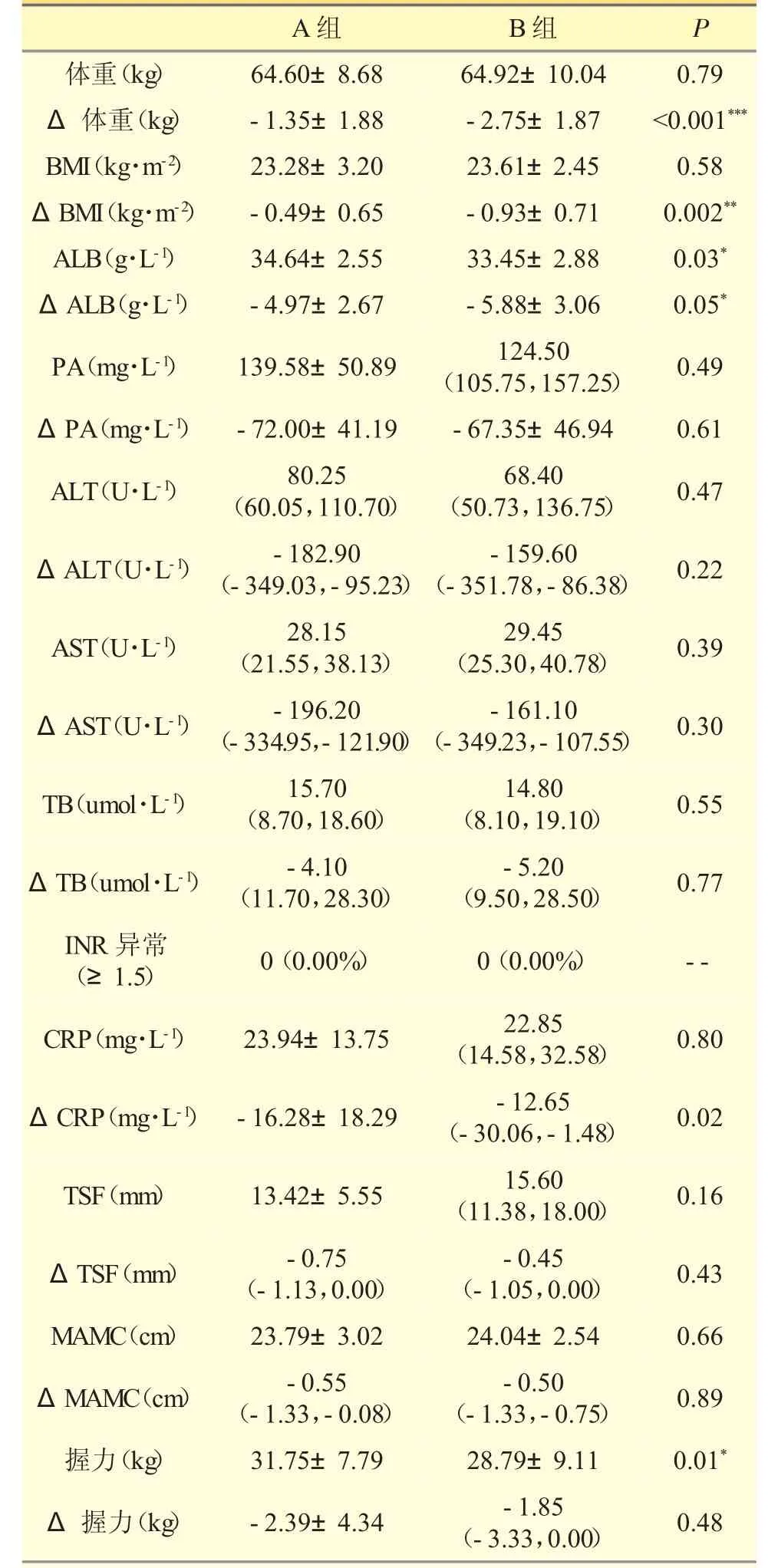
表3 患者其他疗效指标
2.3 对围术期并发症等级的影响
针对本研究中存在组间差异的临床结局并发症等级进行了回归分析,将患者的年龄、性别、是否接受药师监护、术前是否存在营养风险、BMI、生化检查结果(血清白蛋白、前白蛋白、谷丙转氨酶、谷草转氨酶、总胆红素、国际标准化比值、白蛋白、C 反应蛋白),以及营养指标(体重、体重指数、前白蛋白、三头肌皮褶厚度、上臂中点肌肉周径、非利手握力),单因素分析的结果见表4。

表4 围术期并发症影响因素的单因素分析
将手术及术前的患者基础信息作为自变量,运用符合比例优势假说的有序Logistic 回归分析进行影响因素分析,结果见表5。

表5 围术期并发症等级影响因素的多因素分析
平行线检验结果为χ2=13.374,P=0.342,说明比例优势假设存在。Deviance 检验χ2=202.045,P=1.000,Pearson 检验χ2=267.196,P=0.684,均显示模型拟合优度较好。此检验显示,本模型优于只有常数项的模型,χ2=202.045,P=0.002。根据分析结果提示,患者接受药师拟定的营养治疗方案并实施营养治疗的监护较医师自行进行营养治疗监护可减少69%的并发症发生率(OR=0.31,95%CI:0.14~0.71);而经评估有营养风险的患者较无营养风险的患者并发症发生率要高200%(OR=3.00,95%CI:1.24~7.27)。
2.4 经济学分析
经过收集A 组及B 组的住院费用情况,发现A组的用药费用(P<0.001)以及住院总费用(P=0.01)均低于B 组。见表6。

表6 患者的住院费用
从医保方角度看,以主要临床结局中的并发症发生情况进行卫生经济学分析,以无并发症发生作为疗效指标,进行成本-效果分析。本研究的病区共有62 张床位,平均床位使用率为95%。有一名全职临床药师进行临床药学工作,同时有一名临床药学进修生以及一名临床药学专业研究生辅佐之。总的人力成本为C总=C药+C进+C研,以年薪以及所缴税收计算年总成本,按法定工作日计算日成本,在此基础之上纳入患者的医疗支出(不含药师薪资及药事服务费),结果见表7。

表7 以并发症发生为标准的成本-效果分析
根据WHO 关于卫生经济学评价的推荐意见,ICER<0 时不仅从该方案中获益,同时能够节约成本。ICER<国内人均GDP 时,增加的成本完全值得;3 倍人均GDP>ICER>人均GDP 时,增加的成本可以接受;当ICER>3 倍人均GDP 时,增加的成本完全不值得。而本研究的ΔC/ΔE<0,提示从该模式中获益,能够节约医疗成本[14]。
3 讨论
本研究的目的在于探明药师监护下的药物治疗能够给患者带来多少获益,结果提示,在其用药监护服务模式下,营养支持治疗获得了更好的疗效。在经济学收益方面,监护组的用药费用以及住院期间的总费用均较非监护组更低,而治疗收益更高。
根据2013 年的一篇囊括了38 项研究的Meta分析指出,药学服务尤其是基层医疗机构的药学服务,在控制慢性疾病患者的药物治疗效果以及经济型方面有着显著的效果[15]。药师在提供药学相关服务、提升医疗服务质量的同时,还能够通过药物治疗管理模式对众多的药物进行筛选、合并,降低了患者的药费[16]。
本研究着眼于药师在个体化的营养支持与用药监护中的作用。药师干预组的非利手握力水平恢复较非药师干预组好,非利手握力从一定程度上反映了患者的骨骼肌水平,在没有条件检测患者全身的骨骼肌水平时,非利手握力作为一个间接指标与患者的预后密切相关。在ESPEN2015 年推出的营养不良评定指南中,提出了去脂体重指数(FFMI,Fat Free Mass Index)的概念加入到营养状况的评定中,作为传统的体重指数的替代参考指标。而FFMI 同样是评估患者骨骼肌水平为目的的方法之一,这对下一步的营养支持研究也有着很好的启示。在传统的外科治疗围手术期的观念中,营养支持更多地通过肠外营养的形式给予患者补充,而长期的术后禁食对于肠黏膜屏障的恢复并无益处,反而使术后机体蛋白丢失严重,导致细胞通透性增加,肠黏膜屏障失效,更容易继发术后感染。有研究提示,在小肠的正常免疫功能中,肠道上皮细胞积极地参与其中,其能表达MHC-Ⅱ类抗原和某些细胞因子及其受体,如IL-2 及转化生长因子β 等[17]。肠上皮细胞的营养主要需要依靠EN 来提供,PN 则不能有效地为其提供足够的营养。Sedman PC 等[18]研究发现,长期输注脂肪乳剂后,在患者的淋巴细胞培养的上清液中IL-2 含量下降,可能进而导致肠道免疫功能恢复的减缓。
临床药师的个体化营养支持方案的意义不仅仅在于纠正患者的营养丢失,更为重要的是对于机体整体各功能恢复的促进和助益。尽管包括前白蛋白等多项指标虽然组间差异无统计学意义,仍然提示,在临床药师进行营养支持的用药监护下,患者相较对照组有着更多的获益。在卫生经济学中,ΔC/ΔE<0,提示由临床药师管理的肝癌肝切除围术期规范化营养服务模式中,在获得临床收益的同时,还可以节约医疗成本。因此,本研究的结果提示,在临床药师的个体化营养支持给药策略以及用药监护下,更能充分发挥药师的专业特色,为肝癌肝切除患者术后从营养支持治疗中得到更多获益,为患者的用药安全保驾护航。
本研究为单中心回顾性研究,存在着一定的局限性,且纳入的样本量较少,相较于前瞻性研究可能存在一定的不足。对于主要临床结局的术后住院时长并未显现出队列间的统计学差异。本研究未能在卫生经济学评价中选择更多维度和随访数据来证实该模式的更多获益。未来可能需要前瞻性、更大样本量、多中心的研究来证实临床药师在患者营养治疗中的地位和作用;同时推广该药学服务模式至更多的病种,延伸为立体化的临床营养药物的药学服务模式,为更多患者带来更多的益处。

