高效液相色谱法结合主成分分析法分析云芝胞内糖肽中核苷和核碱的组成
张 圆,孙玉娣,石蓓佳,陆益红*
1 江苏省食品药品监督检验研究院 生物技术药品检验一室,南京 210019;2 中国药科大学 药学院,南京 210009
云芝胞内糖肽是运用现代生物工程技术,从杂色云芝菌(Polystictus versicolor(L).Fr.)经深层培养,由菌体提取获得的糖肽类物质[1]。
核碱(Nucleobase)是指一类含氮碱基,是在DNA 和RNA 中起配对作用的部分,包括嘌呤碱和嘧啶碱。核苷(Nucleoside)是核碱与核糖或脱氧核糖缩合而成,是核酸和核苷酸的主要组成成分,参与RNA和DNA 组成。核苷和核碱的组成对于评价真菌类药材及其提取物具有重要的意义。核苷和核碱类成分是生物细胞的基本组成元素,参与DNA 代谢过程、维持生命活动,具有抗肿瘤、抗病毒、基因治疗等生理作用[2]。研究核苷和核碱组成对云芝胞内糖肽质量控制有着积极作用。本文采用HPLC-UV 法,对云芝胞内糖肽中核苷和核碱组成和含量进行了测定[3]。
1 仪器与药品、试剂
仪器:岛津LC20AD-UV 检测器。
对照品:11 种核苷和核碱对照品,见表1。

表1 11 种核苷和核碱对照品信息表
样品:云芝胞内糖肽对照品(批号140692-200301,中国食品药品检定研究院);云芝胞内糖肽原料:A 公司(批号S-30200601),B 公司(批号20200101);C 公司云芝胞内糖肽胶囊(批号190203,含量0.5 g);云芝胞内糖肽胶囊、云芝胞内糖肽片样品共计54 批(含量0.5 g 原料均来自B 公司,制剂处方中无辅料或辅料无干扰)。B 公司提供菌丝体水提醇沉产物(产物1)和培养液滤液醇沉产物(产物2)。A 公司提供的原料中仅含有菌丝体水提醇沉产物。
化学计量学软件:ChemPattern 2020 版,科迈恩(北京)科技有限公司。
2 方法与结果
2.1 色谱条件色谱柱:月旭AQ-C18(4.6 mm×250 mm,5 μm);流动相A 为水,流动相B 为甲醇,按表2 进行梯度洗脱;检测波长:260 nm;柱温:30 ℃;流速:1 mL·min-1;进样体积:20 μL。
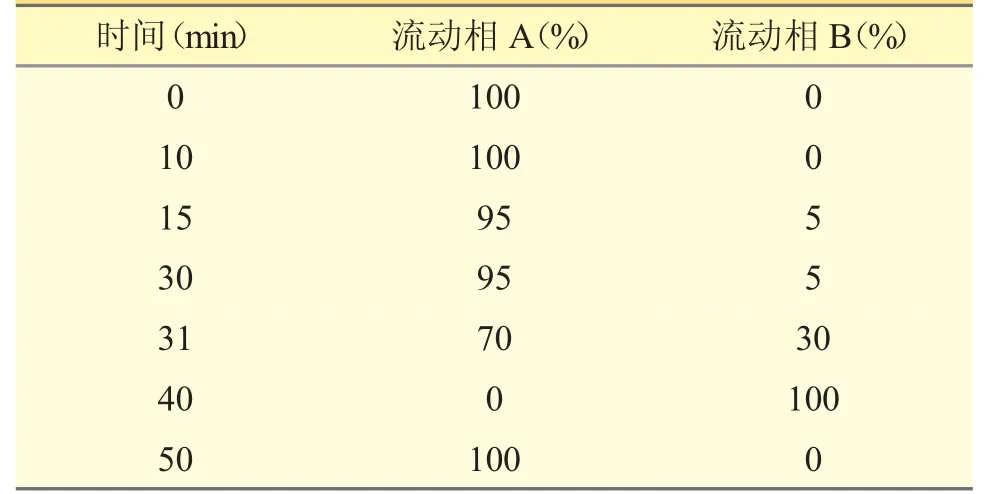
表2 流动相梯度洗脱程序
系统适用性:在对照品溶液(1 μg·mL-1浓度)的色谱图中,理论板数按腺嘌呤峰计算不低于2000,各核苷和核碱色谱峰之间的分离度应>1.5。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取表1 中11 种核苷和核碱对照品适量,加水溶解并稀释成每1ml 中各含1、2、5、10、20、50、100 μg 的系列混合对照品溶液。
2.2.2 供试品溶液 取云芝胞内糖肽胶囊内容物、云芝胞内糖肽片研细,精密称取200 mg,置20 mL量瓶中,加水15 mL,超声振荡30 min,冷却至室温后用水稀释至刻度,5000 r·min-1离心10 min,取上清液,用0.22 μm 滤膜过滤,即得。
2.3 含量测定
精密量取对照品溶液、供试品溶液各20 μL,注入高效液相色谱仪,记录色谱图,以标准曲线法计算出各样品中核苷和核碱的含量。
2.4 方法学验证
2.4.1 线性范围 取11 种混合对照品溶液,用水稀释,配制成含11 种核苷和核碱各1、2、5、10、20、50、100 μg·mL-1的标准曲线溶液,以峰面积(Y)对浓度(X)进行线性回归,得各组成分在1~100 μg·mL-1范围的回归方程和相关系数(r>0.9940)。表明各组分线性关系良好。测定结果见表3;分离图谱见图1。
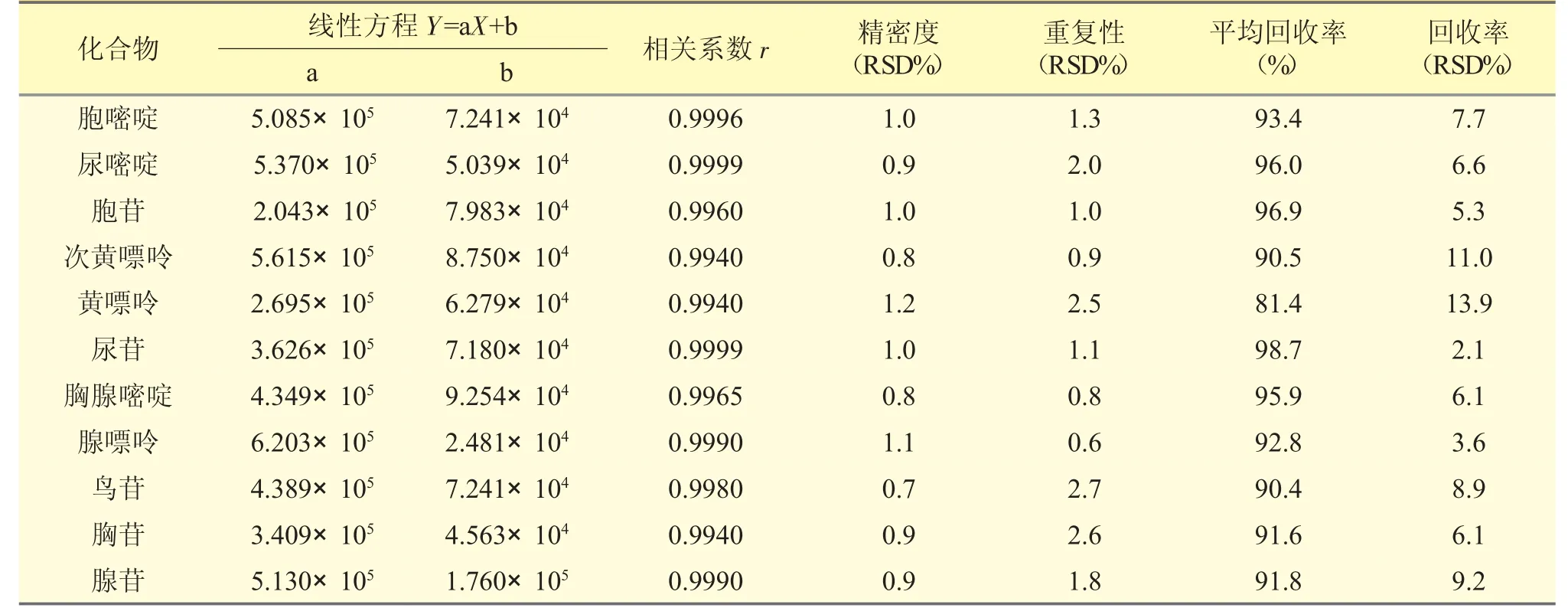
表3 11 种核苷和核碱的分析方法验证结果(n=6)

图1 混合对照品核苷和核碱的HPLC 色谱图
2.4.2 进样精密度试验 取同一浓度混合对照品溶液,连续进样6 次,计算峰面积相对标准偏差RSD%,计算各峰峰面积的RSD%(n=6)。精密度考察结果显示,各峰峰面积的RSD 均<1.0%,精密度良好。结果见表3。
2.4.3 重复性试验 取同一批样品6 份,按“2.2.2”供试品溶液的制备方法,从“加水15 mL 起”同法处理,测定重复性。各峰峰面积的RSD 均<3.0%。结果见表3。
2.4.4 加样回收率试验 取同一批已知含量的样品6 份,精密称取200 mg 置20 mL 量瓶中,分别加入含各核苷和核碱100 μg·mL-1的对照品溶液1 mL,按“2.2.2”供试品溶液的制备方法,从“加水15 mL 起”同法处理,测定其峰面积,按标准曲线法计算加样回收率%和RSD%。各成分回收率分别在81.4%~98.7%。结果见表3。
2.4.5 稳定性试验 取对照品溶液和供试品溶液,分别于0、4、8、12、16、24 h 进样,各峰峰面积的RSD均<0.5%,对照品溶液和供试品溶液在24 h 内稳定。
2.5 各样品核苷和核碱总量见表4。
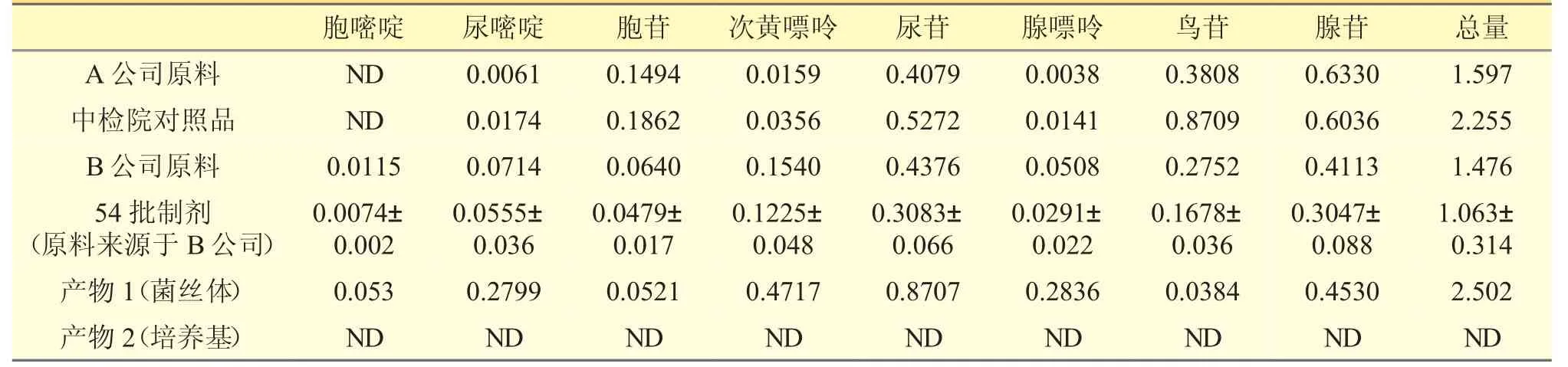
表4 核苷和核碱组成和含量结果(%,云芝胞内糖肽含量)
2.6 检品成分说明
2.6.1 在B 公司原料及54 批云芝胞内糖肽胶囊/片中含有较多的尿嘧啶、尿苷、腺嘌呤、鸟苷、腺苷及少量胞嘧啶、尿嘧啶、次黄嘌呤等。B 公司原料(批号20200101)和C 公司云芝胞内糖肽制剂(批号190203)的HPLC 图分别见图2 和图3。
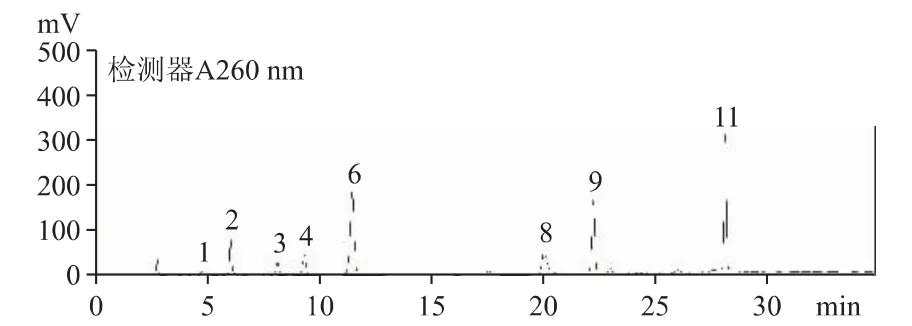
图2 B 公司原料(批号20200101)核苷和核碱的HPLC 色谱图

图3 C 公司云芝胞内糖肽胶囊(批号190203)(原料由B 公司提供)核苷和核碱的HPLC 色谱图
2.6.2 A 公司来源的原料和中检院对照品含有较多的尿苷、鸟苷和腺苷,为优势代谢成分及少量胞嘧啶、尿嘧啶、次黄嘌呤等,中检院对照品核苷和核碱总量约为B 公司来源的原料的两倍,种类和含量均有明显区别,见图4、图5。
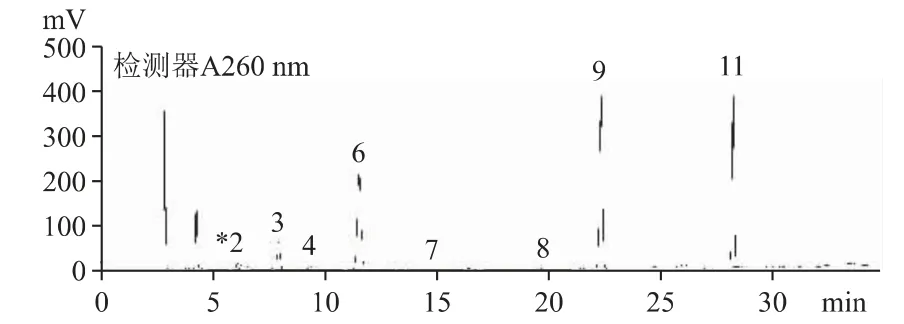
图4 云芝胞内糖肽对照品(中检院,140692-200301)核苷和核碱的HPLC 色谱图
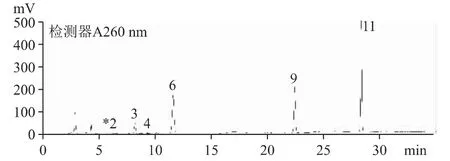
图5 A 公司原料(S-30200601)核苷和核碱的HPLC 色谱图
2.6.3 菌丝体(产物1)中的核苷种类与B 公司原料一致(见图6)。B 公司的培养液(产物2)中未检出核苷,与细胞外无生命活动有关(见图7)。
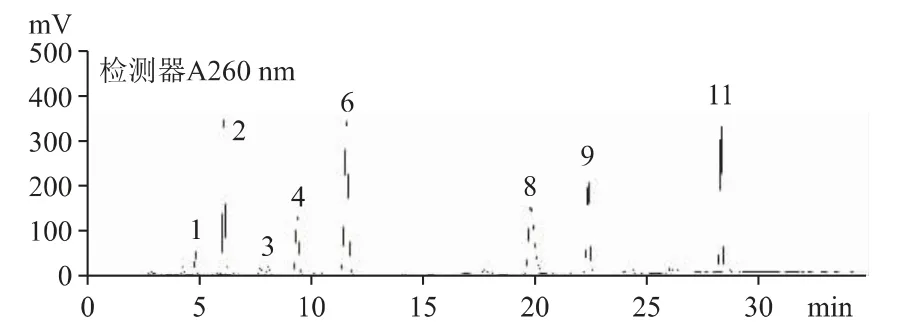
图6 产物1 核苷和核碱的HPLC 色谱图
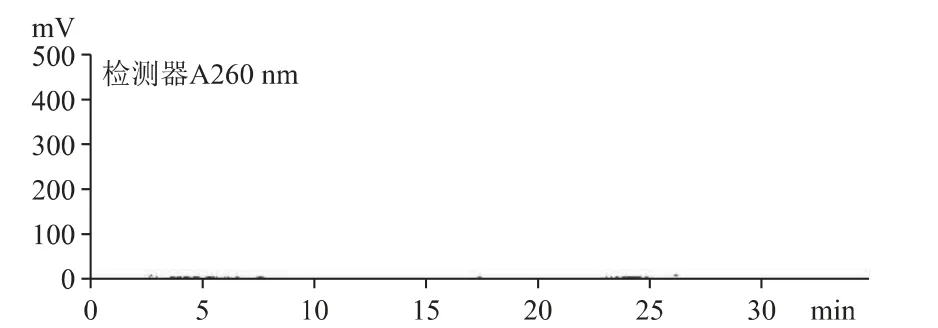
图7 产物2 核苷和核碱的HPLC 色谱图
2.6.4 多元统计分析技术-主成分分析法区分不同生产工艺样品 采用ChemPattern 2020 版软件[4]的多元统计分析技术-主成分分析法,以9 批B 公司胶囊样本中各核苷和核碱的含量建立共有模式,对样本间的相关性和主成分贡献率进行分析。
各样本多元统计分析获得的主成分分析聚类得分图和载荷图(PCA 图)见图8。2D PCA 图显示:其他厂家共45 批胶囊/片样本游离糖组成与自建的共有模式同群,产物1、中检院对照品、A 公司原料、产物2 与自建的共有模式离群。
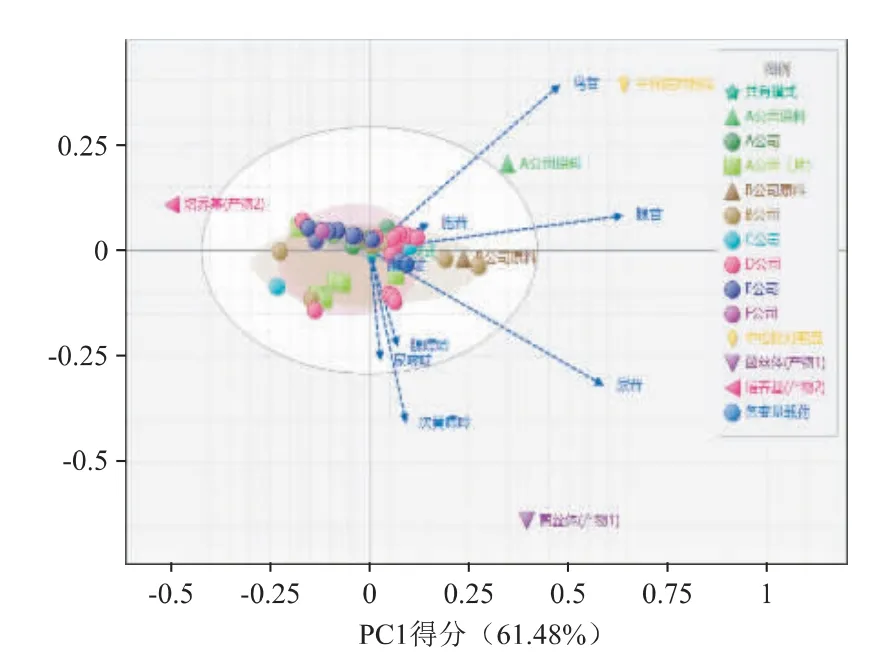
图8 核苷和核碱组成测定主成分分析聚类得分图和载荷图(PCA 图)
结合载荷图可知,尿苷、腺苷为样本识别的主要因素;其次为鸟苷、次黄嘌呤。产物2 因不含核苷成分而离群,中检院对照品、A 公司原料因鸟苷、腺苷等含量高而离群,产物1 因次黄嘌呤、尿苷含量较高而离群。
综合聚类得分图和载荷图的结果,不同原料来源的聚类区分,可在核苷和核碱的含量差异、比例差异上得到体现:如A 公司来源的对照品和原料含有较多的鸟苷和腺苷,产物1(菌丝体成分)含有较多的尿苷、次黄嘌呤、腺嘌呤、尿嘧啶、鸟苷和腺苷。产物2(培养基成分)不含核苷成分,如将其与产物1 混合作为原料,可能导致药效的下降。
3 讨论
3.1 考察了不同色谱柱的耐用性,如月旭AQ-C18柱(4.6 mm×250 mm,5 μm),Luna-C18柱(4.6 mm×250 mm,5 μm),Waters Xbridge C18柱(4.6 mm×250 mm,5 μm),结果各色谱峰分离度均良好。
3.2 对提取溶剂、提取方式、超声时间等进行了考察。结果表明,以水为溶剂,超声提取30 min 时,核苷和核碱提取效率较高,且含量较为稳定。
3.3 对新建立的核苷和核碱检测方法进行了方法学验证,线性关系良好,相关系数均>0.9940,11 种成分的线性均在1~100 μg·mL-1,仪器精密度良好(RSD<2%)、样品回收率在81.4%~98.7%,均能满足云芝胞内糖肽中测定核苷和核碱成分的要求。该方法前处理简单,检测方法灵敏,结果准确。

