淡水环境中微塑料采样及预处理方法研究进展
(1.长江科学院 流域水环境研究所,武汉 430010; 2.华中科技大学 环境科学与工程学院,武汉 430074)
1 研究背景
微塑料(Microplastics)是一种全球新兴的污染物,目前对于微塑料的广泛定义是:粒径<5 mm的塑料微粒[1-2]。淡水微塑料来源分为初生微塑料及次生微塑料。初生微塑料指生产的微小颗粒、微珠等以小颗粒的形式直接排放到环境中产生的塑料(如洗化用品中具有磨砂功能的洗面奶、沐浴露及具有摩擦作用的牙膏等)。次生微塑料指大型塑料垃圾经过物理、化学和生物过程产生分裂和体积减小而成的塑料颗粒。微塑料的危害主要有以下3点:①微塑料可释放出有毒有害物质。在塑料制品的制作过程中往往会添加许多添加剂,以提高其物理性能,如着色剂和阻燃剂,其中一些是众所周知的内分泌干扰化合物,它们可以从塑料碎片中释放到水系统中,并进一步进入食物链,导致生物体内毒素积累[3]。②微塑料比一般塑料更容易吸附有毒有害物质。微塑料表面积大及固有的疏水性[4],使其可作为重金属和持久性有机污染物等化学污染物的重要载体,对环境造成严重污染[4-7],甚至可能会给人类带来严重的健康问题。③微塑料对水生生物有毒害作用,从而影响生态环境及人类健康。对鱼类的一些研究表明,微塑料和相关毒素在生物体内是有累积效应的,会引起生物体肠道损伤和代谢改变等问题[3]。
2004年Tompson等[2]第一次提出“微塑料”这一术语,开始引起科学界的重视,起初研究主要集中在海洋领域,2012年后淡水中微塑料的研究得到了越来越多的关注,最近几年有关淡水中微塑料来源和丰度的研究更是以指数形势大幅增加,但淡水中微塑料的研究技术还不够成熟。用于淡水中微塑料研究的相关技术和理论大多基于海洋中微塑料研究的技术及理论,研究时需注意这2种环境的差异性:①淡水与海水的密度不同,海水密度为1.02~1.07 g/cm3,淡水含盐量低,密度在1.0 g/cm3左右,相较于海洋,淡水中微塑料垂直分布位置可能会偏低一些;②微塑料在淡水与海水中受到的物理力程度不同,如海洋系统中经常出现大的波浪与风速,淡水系统中的微塑料也会经历物理力作用,但相较于海洋,淡水环境的风浪会弱很多,所受物理力较小;③环境条件也有巨大差异,如太阳辐射、降雨、酸碱度和温度,这些外部条件对微塑料有较大影响[8],如Christopher等[9]研究表明,在极度缺乏营养的湖泊中,缺少生物浮体导致高紫外线渗透,塑料碎片容易经历相对强烈的风化。
目前微塑料研究的最大问题是需要协调方法、建立标准。有关淡水中微塑料的研究文献虽已有一定基数,但不同研究之间从采样到样品预处理,至最后的仪器检测,所采取的方式都不一致,未形成一套统一标准,不仅影响了研究结果的可靠性,也给不同文献之间结果的分析比较带来很大困难。如采样方面,部分研究对于采样技术的介绍较为简单,未对外部条件(如天气、水流、时间等)进行描述或控制,选取的采样工具不同,使得采样结果缺乏代表性与重现性,方法学的缺陷被进一步放大。样品分离方面,需不断开发新技术来提高分离效率,确定微塑料的最低粒径以统一滤膜孔径。样品的提纯方面,需找寻高效的消解技术,确定消解液类型与最佳反应条件。
本文基于国内外淡水水体中微塑料的相关研究,选取34篇典型文献[10-43],对淡水水体中微塑料的采样及预处理方法进行分析和比较,讨论了不同方法的优缺点,针对目前存在的问题,提出了未来研究展望。以期使读者对目前淡水环境中微塑料的采样和预处理方法研究有较为系统的了解,并推动淡水水体中微塑料采样和预处理技术迈向标准化。
2 淡水水体中微塑料的赋存状况
研究者在欧洲、澳洲、北美、亚洲的淡水中都检测到了微塑料。从国外淡水环境的数据来看,微塑料已经遍布各国的江河湖泊等淡水水域。无论是人口密集还是位置偏远地区的淡水水域,都有大量的微塑料被检测出。在中国,淡水中微塑料的丰度在不同地区差异较大,污染水平最高的地方是城市河段以及大城市附近的湖泊或水库。从地理位置看,位于人口密集、城市化程度高的内陆水域中微塑料污染更严重,如长江流域、珠江三角洲和三峡水库的上游等[44]。然而,微塑料污染也发生在偏远、人口稀少地区的地表水中,如青藏高原的河流和湖泊[45]。这表明缺乏有效的防控措施时,在径流、季风等因素的影响下,微塑料可能会迁移并扩散到各种类型的水域,最终对淡水环境和人类健康造成风险。
河流、湖泊、水库3种淡水水体中的微塑料赋存情况如下。
(1)河流:河流是微塑料的重要接纳体,同时也是海洋中微塑料的一个重要陆源输入,其微塑料污染情况直接影响了近海海岸的微塑料污染程度。因此,近年来河流中微塑料的污染逐渐成为研究热点[46]。河流也是微塑料研究最多的淡水水体,在国外,英国的泰晤士河、巴黎大城市中的地表水、西班牙的埃布罗河、加拿大的圣劳伦斯河、澳大利亚布里斯班河及维多利亚州的地表水、韩国的汉江及那东河等都有大量微塑料被检测出。在中国,珠江、渭河、海河、黄河下游地表水、长沙和武汉的城市地表水也有着不同程度的微塑料污染。
(2)湖泊:湖泊是一个具有不同水文条件的半封闭系统,由于水动力学相对稳定,可能作为大量微塑料的汇集地。例如在加拿大的温伯尼湖中检测出较高浓度的微塑料,最低值为入流处的53 000个/km2,最高值为出水口附近的748 000个/km2[29];中国洞庭湖中微塑料的浓度范围为900~2 800个/m3,洪湖为1 250~4 650个/m3[36]。
(3)水库:水库是一种介于河流和湖泊之间的半人工半自然水体,又被称为“人工湖泊”,这反映了水库与自然湖泊具有一定相似性,但在某些方面仍有较明显差异。如湖泊水力滞留时间长,几何形态为U形,水动力学特征比较有规律;而水库水力滞留时间短,几何形态为V形,水动力学特征变化大[47]。目前对于水库中微塑料的研究不多,国内最大的水库三峡水库和丹江口水库均有微塑料方面的研究报道。从现有研究数据来看,水库中也含有大量微塑料,污染水平较高。三峡水库中水体微塑料含量范围为1 597~12 611个/m3,沉积物每千克湿重中微塑料含量为25~300个[13]。丹江口水库中水体微塑料丰度为467~15 017个/m3,沉积物每千克湿重中微塑料含量为15~40个[17]。
3 微塑料样品采集
微塑料在淡水环境中的迁移、溯源、归宿、分布和生态毒理效应等方面的研究都涉及多种介质,主要介质有水体、沉积物及生物体。样品的采集方法很大程度上取决于取样环境和微塑料的最小尺寸。
3.1 水样采集
微塑料在水体中的分布取决于其性质,如密度、形状、大小、化学物质的吸附和生物絮凝,以及水的密度、风、水流和波浪等环境条件[7],因此采集的微塑料数量和质量很大程度上取决于取样的位置和深度。由于微塑料在水体中丰度低、尺寸小,通常采用浓缩样本和大体积采样2种方法。
浓缩样本法指采样过程中样品体积会减小的方法,主要通过拖网采集。海洋微塑料拖网可以应用于淡水水体微塑料的采样中。从现有报道来看,目前淡水环境使用的采样网类型主要有蝠鲼网(Manta net)、漂浮生物网(Neuston net)和浮游生物网(Plankton net)。不同类型的采样网特征不同,采样位置也不同。蝠鲼网前端有一对像翅膀的金属箱,这使其能够漂浮在水面上;漂浮生物网连接在一个大的矩形框上。这2种采样网可用于表层水样的采集。浮游生物网的头部是圆柱形的,身体呈圆锥形,常用于中层水取样。3种不同类型的拖网外观见图1。采用拖网采样的优点主要有:易于使用;可以对大量的水取样;可以覆盖较大的采样区域,提取大量微塑料样品,并减少采样体积[48]。缺点主要有:设备昂贵;需要船;样品可能受船只及拖缆污染;网孔孔径大,较小的微塑料会通过网格被漏掉[49]。已有文献报道中拖网孔径为112~333 μm不等。

图1 常用的淡水微塑料采样网
大体积采样法指不减少水的体积,一般用散装取水器(包括取水容器)或用泵采集淡水水样。使用散装取水器采完样后需立即送入实验室进行筛分。其优点主要有:不需要专门的设备和船;易于收集样品;样品大小齐全,可用于收集较小的微塑料。缺点主要有:费时费力;需将水桶人工转移到实验室;采集水样量较小;所涵盖的取样区域有限,数据可能不具有代表性(因为微塑料的空间分布是高度可变的)。泵采集样品优点主要有:可对大量的水取样;省力;允许选择取样时过滤筛网大小。缺点主要有:需要设备;工作时需要能量;仪器可能造成污染。
不同的采样方法会造成样品代表性的不同,在选取的34篇文献中,涉及水体采样的文献共有28篇,其中,用拖网采集的共有9篇,泵采样的有8篇,采水器采样的有8篇,不同采样方式优缺点比较见表1。泵和采水器结合的有1篇,有2篇文献将拖网和泵结合使用,目的是为了采集不同深度的水样。目前,拖网法、散装取水器采样法、泵采样法在国内均有普遍应用。具体采样方法的选择主要受采样区域与已有设备限制,实验人员可根据客观条件来灵活选择自己的采样方式。
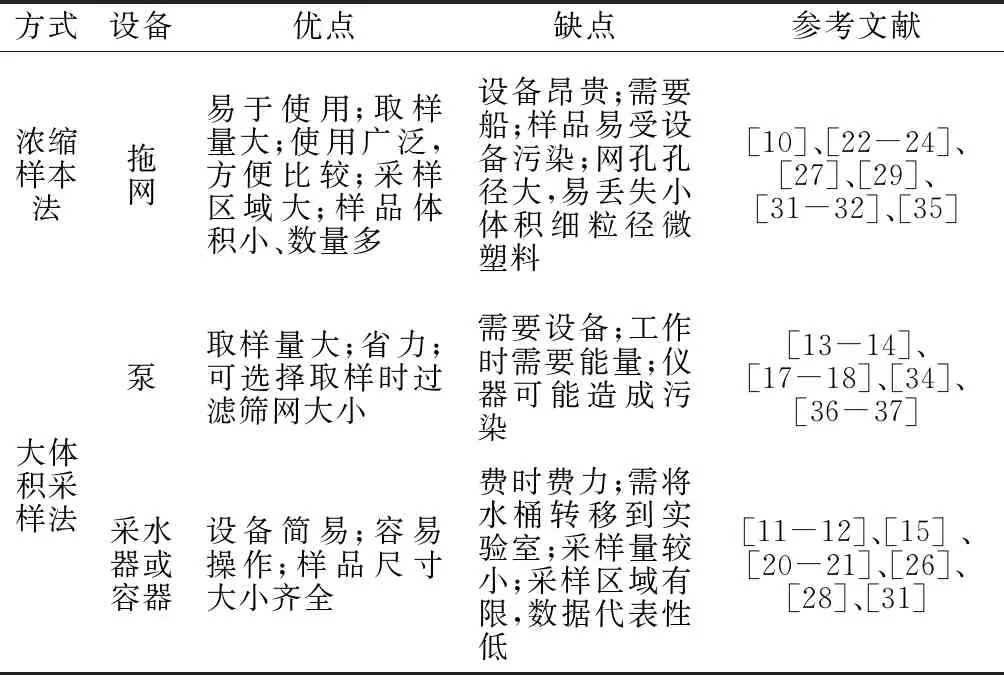
表1 不同采样方式优缺点的比较
3.2 沉积物样品采集
沉积物在淡水水体污染中同时扮演着“源”和“汇”的角色。一方面,微塑料表面的静电力易吸附水体悬浮颗粒物,并通过物理、化学和生物沉降作用随着颗粒物进入沉积物;另一方面,在环境条件发生变化时,沉积物中的微塑料会通过絮凝、沉降、解吸等过程再次释放到水体中。一旦进入沉积物,微塑料就会经受低温和低氧,避免了紫外线的破坏和机械风化,从而促进了其在水环境中的持久性,增加了其在水环境中的污染程度。在全世界范围内,每千克干重或每平方米的淡水沉积物中微塑料含量在几十到几千个不等,如葡萄牙的Antua河,每千克干重的沉积物中有56~1 265个微塑料[18],甚至在圣劳伦斯河中微塑料丰度最高的采样点达到7 562个/kg[15]。
沉积物中微塑料的分布是不均匀的,会受微塑料自身性质和环境因素的影响,且由于局部区域可能含有较高浓度的微塑料,试验结果很大程度上取决于采样区域和深度,因此,在取样时应保证随机性,从而使得取样具有代表性。沉积物的采集由于采样位置的不同,使用的工具也有所不同。河底沉积物一般选择岩心取样器、抓斗或箱式采泥器,岸边泥土可采用镊子、不锈钢采样铲或不锈钢勺采样。采集后的样品需用铝箔包裹放入塑封袋运回实验室,在4 ℃下保存。以上采样工具都得到了普遍应用,目前国内应用最多的为VV抓斗式采样器。
3.3 生物样品采集
微塑料的粒径较小,容易被水中生物误食,继而在其体内引发一系列毒理效应,因此研究微塑料在生物样品中的分布十分必要。虽然水生生物摄入微塑料在世界范围内已被广泛报道,但这些研究大多集中在海洋生物上,而淡水生物摄入微塑料的信息较为匮乏。在世界范围内,每个个体淡水生物和海洋生物中微塑料的含量从数个到几十个不等[44]。例如太湖中蛤蜊软组织的微塑料含量为0.2~12.5个/g[22];澳大利亚古尔本河的淡水虾中,36%的个体含有微塑料,平均丰度为24个/g[26]。
微塑料生物样品采集种类主要有浮游生物、底栖生物及鱼虾类。浮游生物的采样可分为2种方法:一种是直接采用垂直拖网,例如先用Bongo网拦截,再选择合适的淋洗液(常用10%福尔马林溶液)冲洗拖网获得样品;另一种方法是用洁净容器采集一定体积水样,再提取水样中的生物体进行后续分析。底栖生物可以通过拖网采集。大型生物类如鱼类通常利用渔网直接采集或从当地市场进行购买,也有部分研究者从当地渔民或垂钓爱好者处购买[50]。
4 微塑料样品分离
部分研究采用直接挑选法来分离微塑料个体,但由于肉眼识别率低、类型难以分辨等,此方法得到的结果往往受到质疑。因此,如何从样品中将微塑料分离出来并进行定量分析和表征是样品处理非常重要的一个环节[51]。目前较为常见的微塑料分离方法主要有过滤、筛分及密度分离法。
4.1 过滤或筛分
过滤或过筛是分离水样中微塑料的最常用方法,也是分离沉积物样品上清液的常用方法。筛分可将微塑料从环境基质中提取出来,并细分成不同大小的类别。它通常作为一个初始提取步骤,在此步骤中,样品可以湿筛或干燥后筛,以减少后续处理的体积。筛孔尺寸的选择,决定了要定量的微塑料的尺寸范围。过滤是一种固液分离技术,可通过该技术将微塑料从初始水样、密度分离或消解后的溶液中分离出来[52]。使用最广泛的滤纸是玻璃纤维滤纸,其次是硝酸纤维素滤纸和尼龙网。
滤纸的孔径或筛孔可以有很大的变化,其决定了检测到的微塑料的最小尺寸。然而,较小的孔径或筛孔也可能导致有机质和矿物质快速阻塞。本文选取的34篇文献中,孔径或者筛孔的大小各不相同,为0.22~1 600 μm不等,有1篇文献缺少该信息,1篇未采用该步骤。可以看出,由于研究对象的目标尺寸不同,不同研究对滤纸孔径的选择差异也较大,所以应该定义一个标准化的孔径或筛孔大小,以便于不同文献之间结果的比较。
4.2 密度分离法
在分离淡水中微塑料时可以利用密度差,向样品中加入饱和盐溶液,使得微塑料密度低于溶液,从而上浮进行分离。利用盐溶液进行密度分离的一般操作方法是:向样品中加入饱和盐溶液,充分振荡、搅拌使之混合均匀,随后静置沉淀直至重组分脱离水相体系重新沉降,而微塑料继续保持悬浮状态或漂浮于溶液表面,最后收集上层溶液中的微塑料。由于微塑料的密度依赖于聚合物类型、添加剂浓度,甚至吸附的物质和生物体,所以普遍认为用于提取微塑料的盐溶液密度应>1.4 g/cm3[53]。目前,所有用于淡水样品预处理的提取方法几乎全部是利用盐溶液进行密度分离的。主要有以下几种饱和盐溶液。
(1)饱和NaCl溶液(密度1.2 g/cm3):是实现这一分离过程最常用的溶液,80%~100%的微塑料颗粒可以通过搅拌饱和NaCl溶液分离得到,成本低,对人体无毒。缺点是对于高密度聚合物的回收率较低[3]。在试验过程中推荐使用试剂级纯度的NaCl,因为它的密度稍高,对稍重的聚合物具有更高的分离效率。
(2)饱和NaI溶液:NaI溶液的密度高达1.8 g/cm3,可分离出密度较大的微塑料。缺点是有毒性,对环境有害,价格昂贵,建议循环使用。且由于NaI与纤维滤纸反应会使其变黑,使视觉识别变得复杂,因此应避免与纤维滤纸同时使用。
(3)ZnCl2溶液(密度1.6 g/cm3)[38-39]:可分离出密度较大的微塑料,效率高。缺点是对环境有害,为了将环境污染降到最低,有必要对ZnCl2进行回收再利用。
(4)其他盐溶液:如密度为1.4~1.5 g/cm3的聚钨酸钠(SPT)溶液,SPT作为一种无毒的分离盐,多年来一直用于液体分离,然而与其他盐相比,价格昂贵[15];密度为1.3 g/cm3的氯化钙(CaCl2)溶液,但有研究证明了CaCl2是不合适的,因为它会对测量造成干扰[54];甲酸钾(HCOOK)溶液[23-24,40],化学性质稳定且相对便宜,但对环境可能有害。
为了达到更好的效果,有研究使用双密度分离法:第一步先使用NaCl溶液将低密度微塑料浮选出来,再使用NaI溶液或ZnCl2溶液将高密度微塑料浮选出[13,17],不仅能提高效率还能节省二次浮选时所用的价格昂贵的盐溶液。还有研究开发出空气溢流法(air-induced overflow,AIO):先在NaCl溶液中通入空气使样品流化后溢出,以减少待测样品体积,再用NaI溶液进一步浮选。该法回收效果好,回收率在91%~99%之间[55]。
4.3 其他提取方法
(1)慕尼黑塑料沉积物分离器[56]。它结合使用ZnCl2溶液,对于较大的微塑料颗粒回收率可达96%~100%,对于较小的微塑料颗粒回收率可达96%,其主要用于沉积物样品中的微塑料分离。
(2)通过加压流体萃取法(Pressurizd Fluid Extraction,PFE)分离土壤/沉积物中的微塑料[57]。通过优化PFE条件,塑料可以从土壤/沉积物样品中分离出来。虽然小至30 μm的塑料颗粒可以被有效提取,但使用该方法的挑战在于:①无法很好地确定微塑料尺寸分布;②微塑料萃取后的形貌发生变化。
(3)淘析法[54]。在自行设计的洗脱浮选装置中,通过向上的水流和曝气将轻质微塑料保留下来,然后在孔径35 μm的筛上进行收集。该方法提取效率为94%~98%,可以有效地分离沉积物中的微塑料。它的局限性在于不太适用于含有高浓度有机物的水体。这是由于微塑料与这些基质中自然存在的颗粒之间的密度差可以忽略不计,淘析法难以实现。
(4)油提取法[58]。利用微塑料的亲脂特性,将微塑料微粒与油充分混合,使其被油包裹而降低密度,从而可以浮到上层,再将油与剩余溶液分离,反复提取2次。该方案成本低、效率高,不会对聚合物造成损害且经过酒精或特定洗涤剂清洗后也不会干扰后续的仪器分析。但是油提取法在淡水中微塑料的研究没有得到广泛应用,收集的34篇文献中只有1篇文献使用了该方法。
本文选取的34篇文献中,21篇涉及沉积物样本预处理,只有2篇没有使用盐溶液密度分离法,其中:NaCl溶液4篇;ZnCl2溶液7篇;NaI溶液1篇;HCOOK溶液3篇;偏钨酸锂溶液1篇;1篇缺少所用盐溶液的详细信息。有2篇采用双密度分离法:先使用NaCl溶液再使用NaI溶液。未采取盐溶液密度分离法的2篇文章中,1篇采用直接过滤[42],1篇采用油分离法。而在涉及水样预处理的28篇文献中,只有9个水样使用了盐溶液密度分离法:NaCl溶液5篇;ZnCl2溶液2篇;偏钨酸锂溶液1篇;1篇缺少所用盐溶液的详细信息。1篇采用显微镜直接分拣法,其余18篇采用直接过滤法。每种提取方式使用频率占比见图2。

图2 选取的文献中水体和沉积物中微塑料的提取方式占比
5 微塑料样品消解
环境样品中含有的生物物质常与塑料混淆(如颜色较深的藻类碎片),导致对微塑料浓度的过高估计,并增加了需要进一步分析的颗粒数量。因此,有必要创造一种简单的消解方法,能够在不影响聚合物结构或化学完整性的情况下减少有机物含量。目前,国内外常用的消解方法主要分为4种:酸消解(HCl、HNO3)、碱消解(NaOH、KOH)、氧化剂消解(H2O2、芬顿试剂)和酶消解。选定消解方式后,还需选择合适的消解时间与温度才能达到较好的消解效果。如Prata等[4]比较了H2O2(30%)、HNO3(35%)、KOH(10%)、十二烷基磺酸钠(SDS,10%)、芬顿试剂(Fe(II)+30% H2O2)5种消解液的消解效果,证明芬顿试剂与KOH最适合用于有机物的消解,在50 ℃、消解1 h的条件下消解效率最高,不会导致合成聚合物的失重和视觉变化(硝酸纤维素除外),不会影响对聚合物类型的红外识别。
然而,消解的必要性取决于样品中有机物的多少。比如本文选取的文献中并非都有消解的步骤:21篇涉及沉积物的研究中,4篇没有消解步骤,13篇使用H2O2(30%),4篇使用芬顿试剂;28篇涉及水体的研究中,3篇没有消解步骤,18篇使用H2O2,1篇使用HCl,1篇使用H2O2+HCl(5%~10%),5篇使用芬顿试剂。每种消解方式的使用占比见图3,不同消解方式优缺点的比较见表2。

图3 选取的文献中水体和沉积物中有机物的消解方式占比

表2 不同消解方式优缺点比较
5.1 化学药品消解
5.1.1 酸消解
无机酸可以用来降解有机物,使用较多的是硝酸和盐酸。然而,一些聚合物(如尼龙、聚酯(PET)等)对酸的耐受性低,特别是在高浓度和高温下,很可能被降解,所以必须在合理的时间内采用最佳的浓度和温度来去除生物材料。其中硝酸(HNO3)广泛用于生物化合物的消解,消解率在94%~98%之间,但硝酸可能会留下油质残留物或组织碎片,导致尼龙和聚苯乙烯(PS)的溶解;盐酸(HCl)并不能消解所有有机物,消解率不高,处理效果不理想[59],所以不推荐单独使用。
5.1.2 碱消解
碱消解是替代酸消解的一种很有潜力的方法。然而,碱消解也可能对微塑料造成损害或使其变色,使油性沉积物、生物体的骨碎片或二次沉积物重新到塑料表面,改变待测粒子光谱使特征识别复杂化。其中KOH和NaOH对有机物有很好的消解作用,而且回收率较高,被认为是非常有效的消解措施,常用于去除动物组织。但这2种药品仍然存在碱消解的固有缺点,且生物硬质体和脂肪可能无法完全被碱消解。此外,NaOH会造成不同类型的聚合物的降解及变色[60]。可以将酸碱消解一起使用(如NaOH和HNO3),生物物质消解良好,回收率高。
5.2 氧化消解
5.2.1 过氧化氢(H2O2)
H2O2是一种去除有机物的高效氧化剂,已被广泛用于去除水和沉积物中的有机物。当使用30%的H2O2时,聚合物只发生了轻微的变化,变得更透明、更小或更薄[61],能比NaOH和HCl更有效地消解有机物,且几乎不降解聚合物。但其在消解过程中会产生泡沫,导致微塑料回收率降低,需采取措施减小泡沫对微塑料回收率的影响。且目前H2O2消解的最佳浓度、消解时间和温度都不统一,各项研究采取的参数都不相同。
5.2.2 芬顿试剂
H2O2(30%~35%)与Fe催化剂(0.05 mol/L)按1∶1混合的芬顿试剂是美国国家海洋和大气管理局(NOAA)建议的另一种有效的消解方法[62]。其在50 ℃的条件下加热1 h,不仅对植物组织有很好的消解效果(对藻类物质的去除率为100%),而且对动物组织消解率也较高(72.6%)[7]。
5.3 酶消解
酶已被用作另一种消解方法,经常用在生物体的消解上,以去除部分有机物及减少部分生物组织。酶消解的危险性较小(如可以在没有通风柜的情况下使用)[63],与化学消解比较,其对微塑料的损害较小,经酶处理的聚合物既不会溶解也不发生降解。但是酶消解的效率会随着样品中有机物的种类而变化;每种酶都有最佳的温度和pH值,需找到最佳反应条件;酶消解需要较长反应时间且成本较高。
5.4 其他消解方法
其他方法包括:微波,可以辅助酸消解,比一般热酸消解效率高[64],但可能会对微塑料造成损伤;超声波,与其他方法联用可提高消解效率(如与NaOH联用可将效率提高7.2%)[65];次氯酸钠(NaClO),在消化鱼胃内容物时是有效方法,不影响聚合物形态和拉曼光谱,但有可能引起微塑料变色[65]。
在以上列出的消解方案中,采用何种温度、浓度和反应时间才能达到最高的消解效率还需不断探究,高温可缩短完全消解有机物所需的时间,但可能会加大对聚合物的损害。Munno等[66]指出60 ℃以上的温度可能会导致样品中微塑料的破坏。如何平衡消解效率和对聚合物、微塑料等的破坏这2个因素,制定一种高效的消解方案,不仅可大规模使用而且不破坏聚合物,是一个值得思考的问题。
6 质量保证和控制措施
在对微塑料进行监测时,应在整个过程中采取严格的质量保证和质量控制措施(QA/QC),以提高数据质量至关重要[63]。
在现场采样中,获得具有代表性的样品对于准确评估研究区域的微塑料丰度显得尤为关键。这需要合适的采样工具,设计和实施精准的采样策略[67],还可通过重复采样来提高监测数据的可靠性。为避免样品在环境中交叉污染,采样工具在使用前或使用后都应用采样点处的水润洗3遍,在每个样品采集完后都应立即装入容器密封保存,并在采样结束后立即运回实验室进行后续处理。
在实验室工作期间,背景污染(如空气中的纤维)会对环境样本的定量结果造成偏差[68],应采取措施检查和减少背景污染。例如在真空条件下,通过滤纸对工作场所的空气进行一定时间的过滤,以检测潜在的空气污染;保持一个干净的实验环境以避免外界污染,最好能在通风柜中进行实验;实验人员使用乳胶手套和棉质实验服[11-13],实验设备使用钢或玻璃设备,塑料设备更换为非塑料材料或尽量避免接触塑料设备;减少通风和样品暴露时间,样品未使用时用铝箔覆盖表面以防止其与空气接触[18];用去离子水仔细清洗设备和容器。
在消解步骤中,大量研究已经证明一些消化剂在高浓度或高温条件下可能损坏或完全溶解某些种类的聚合物,从而导致对结果的低估。因此,在使用药品进行样品消解之前,有必要进行一些测试来确定实验使用的药品对塑料的潜在影响。
7 结论与展望
目前微塑料研究的主要问题之一是使用的采样和预处理方法不一致,研究缺乏一致性,阻碍了对现有及今后数据进行大规模的比较。
(1)采样方面,拖网法因涵盖区域广、采样体积大、节省人力等诸多优点而被广泛使用在水体采样,但现有研究采取的网孔大小、拖网速度和拖网时间不同,降低了数据的可比性。此外,有研究比较了不同采样方式采集的微塑料平均丰度,结果显示拖网所采集样品的丰度明显低于泵式和取水器,但泵式和取水器取样也有其难以避免的固有缺点。未来研究人员需思考如何开发出一种标准化的取样方法,既简单又能有较高的代表性和重现性,以调查更大范围内微塑料的赋存状况。沉积物采样没有因为采样工具的不同而造成丰度上的明显差异,但在描述微塑料丰度时应标注好干重或湿重以免描述不清造成歧义。
(2)分离方面,不同提取方式的提取效率不同,如何优化提取方式、提高微塑料提取效率值得研究者思考。NaCl因廉价、无污染等优势成为了目前使用最多的分离溶液,但其密度较低,对高密度聚合物的提取效果较差。其他密度大的盐溶液又因为价格昂贵或者易造成污染而无法大量使用,因此建议使用双密度分离法,先用NaCl将轻质塑料提取出,再用密度大的盐溶液(如ZnCl2、NaI)提取剩余的重质塑料,使用后的盐溶液应重复利用以节约成本和减少污染。除现有分离技术外,未来研究人员还应着力于开发出其他高效而简单的提取方式。
(3)消解方面,目前已使用的消解剂对聚合物都有着不同程度的影响,消解过程中所采用的反应温度与时间也都不一致。酶的影响程度最低,但因其消解速率慢、成本高的缺点而无法大规模运用。未来应创新高效的消解方案,既可以大规模使用,又不对有机物造成损害。
(4)在过滤或过筛时,不同研究采用的筛孔、滤孔尺寸都不一致,建议结合微塑料分类标准确定一个统一的孔径大小。目前文献对微塑料的分类有巨大的差异,其中使用最多的是将微塑料分为5类:0.5~1 mm、1~2 mm、2~3 mm、3~4 mm和4~5 mm。建议今后能确定微塑料分类的统一标准,以提升微塑料分析过程的标准化及分析结果的可比性。

