症状性非急性期大脑中动脉闭塞血管内再通治疗研究进展
黄锐 赖贤良 熊元元 程祖珏
症状性非急性期大脑中动脉闭塞(symptomatic non-acute middle cerebral artery occlusion,SNMCAO)是指经积极内科治疗仍然有症状波动或恶化的大脑中动脉粥样硬化性闭塞,经血管影像学检查无前向血流信号(TIMI分级为0)且闭塞时间超过24 h[1]。目前对于SNMCAO最新的治疗方法是血管内再通治疗,通常采用单纯球囊扩张术(percutaneous transluminal angioplasty,PTA)或经皮球囊支架置入术(percutaneous transluminal angioplasty and stenting,PTAS)。但对于SNMCAO影像学评估,患者选择及血管内治疗术式没有一个统一的标准,对血管内治疗SNMCAO预后情况也缺乏长期效果的肯定。本文就对SNMCAO血管内再通治疗最新进展作一综述。
1 SNMCAO影像学评估
传统的SNMCAO影像学评估包括经颅多普勒超声(transcranial doppler,TCD)、经颅彩色多普勒超声(transcranial colorcoded duplex ultrasonography,TCCD)、CT 灌注成像(computed tomography perfusion,CTP)、磁共振灌注成像(perfusion weighted imaging,PWI)、数字减影血管造影技术(digital subtraction angiography,DSA)等。通过这些检查可评估大脑中动脉(middle cerebral artery,MCA)管径大小和脑组织血流灌注情况,反映脑血管解剖上的改变,动态显示脑循环由动脉至静脉的变化过程[2-4]。相比较CTP、PWI等评估脑灌注的手段,动脉自旋标记(arterial spin labeling,ASL)是一种比较新的检测方式,利用动脉水中磁标记质子作为内源性示踪剂,然后通过减去标记和控制信号得到灌注图,是一种无创、可重复评估脑灌注的方法[5]。ASL联合血管壁高分辨率磁共振(high-resolution vessel wall magnetic resonance imaging,HR-MRI)还可以对 SNMCAO 的血管管径、血管内膜炎症情况、管壁特点、管壁厚度、斑块特征、血管壁结构及血管周围附近侧支循环等进行评估[6-9],同时根据血管壁的差异及灌注的特征可有效的鉴别烟雾病[10]。但TIAN等[11]研究认为与CTP相比,ASL倾向于高估严重慢性大脑中动脉(middle cerebral artery,MCA)狭窄患者的灌注缺陷。磁敏感加权成像(susceptibility-weighted imaging,SWI)可通过检测铁的变化,量化铁的含量来诊断责任血管供血区域是否有微出血及出血倾向[12-13]。
目前 GAO等[14]通过 DSA提出 SNMCAO新分型(图1):I型,MCA M1段主干闭塞,闭塞长度≤10 mm,在 M1远端或分叉处可见远侧侧枝逆行充盈;II型,MCA M1段主干闭塞,闭塞长度>10 mm,M1远端分叉处可见远侧侧枝逆行充盈;III型,MCA M1段主干闭塞,M2段可见远端侧支逆行充盈,但M1远端及分叉未见。
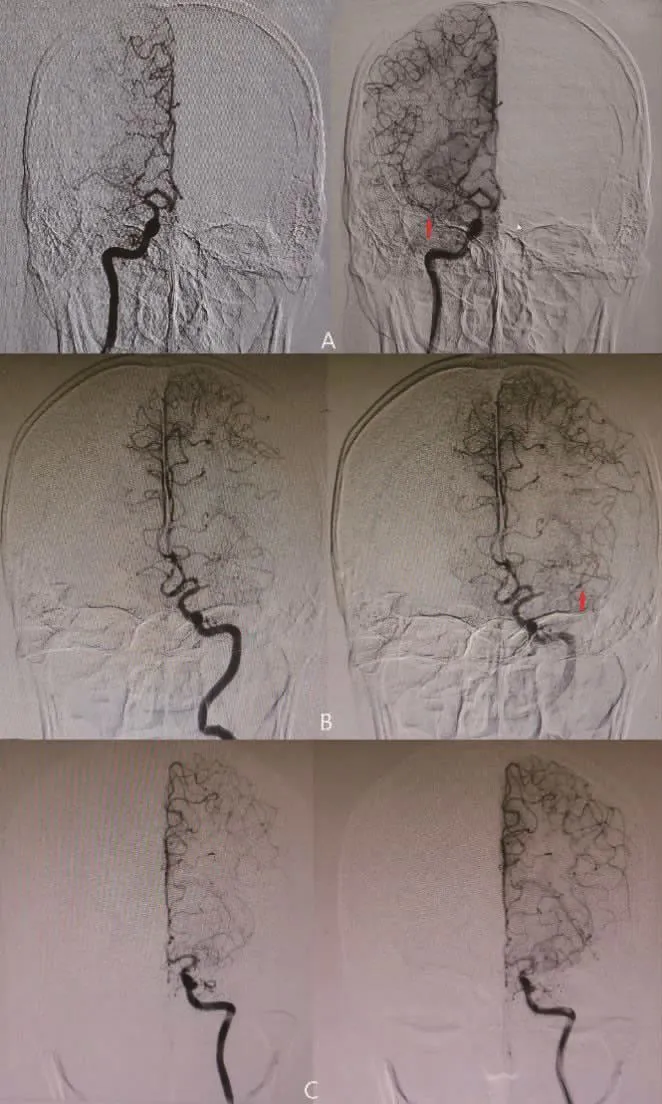
图1 SNMCAO的血管造影示意图 A.I型,MCA M1段主干闭塞,闭塞长度≤10 mm,在M1远端或分叉处可见远侧侧支逆行充盈;B.II型,MCA M1段主干闭塞,闭塞长度>10 mm,M1远端分叉处可见远侧侧支逆行充盈;C.III型,MCA M1段主干闭塞,M2段可见远端侧支逆行充盈,但M1远端及分叉未见。M1远端分叉的可定义为在血管造影图像上通过远端侧支逆行观察MCA上至少两个主要分支[14](红色箭头表示M1远端分叉)。
通过多种影像学评估联合SNMCAO分型可很好地选择患者进行血管内治疗。
2 SNMCAO血管内治疗病例选择
2.1 适应证及禁忌证目前多数学者[14-17]认为血管内治疗SNMCAO手术适应证:①尽管进行积极地治疗,患者病情仍然恶化;②脑梗死面积不超过供血动脉面积的1/5;③低灌注区大,梗死面积与CTP、ASL、DSA不匹配度>50%;④被阻塞的MCA直径估计超过2 mm,长度小于15 mm;⑤未见明显微出血灶及出血倾向。手术禁忌证除一般手术禁忌证还包括:①已知对阿司匹林、氯吡格雷、肝素、造影剂过敏;②非动脉粥样硬化性闭塞,如烟雾病或血管炎等;③侧支循环发育良好,动脉自旋标记检测MCA区域灌注充足。
2.2 根据SNMCAO新分型筛选在GAO等[14]研究中I型病变血管再通率最高(95.5%),围手术期并发症发生率较低(4.5%)。II型再通成功率83.3%和围手术期并发症11.1%。III型病变,显示再通率(60%)低,围手术期并发症发生率(40%)高。I型是对于仍有血流动力学障碍及药物治疗效果较差患者最适合开通类型。II型开通比I型更困难,闭塞段较长(>10 mm),但由于不累及M1远端分叉,闭塞段仍局限于M1段主干。对于药物难治性II型病变患者,需要综合考虑血管内治疗作为替代治疗的风险和效益。III型由于累及M1远端分叉,以及闭塞长度、分支间夹角和分支直径的不确定性,这些病例血管内再通的手术风险显著增加,应谨慎进行血管内再通手术。
3 SNMCAO血管内治疗的技术处理
3.1 术前准备①患者均接受100 mg/d阿司匹林和75 mg/d氯吡格雷,至少口服5 d以上,不足5 d患者在再通治疗前给予300 mg负荷剂量的阿司匹林和氯吡格雷。完善血栓弹力图指导抗血小板的治疗,手术前必须控制好血压、血糖、胆固醇和其他与动脉硬化相关的危险因素[14-15];②术前2h可使用尼莫地平预防术中脑血管痉挛[16]。
3.2 血管内治疗方法对于开通SNMCAO手术方式是选择PTAS还是选择PTA,目前没有相关性的研究。在理论上,PTAS比PTA具有更大的优势,可以防止早期弹性后缩、负性重塑和急性夹层,但CHIMOWITZ等[18]发现,接受PTAS联合药物治疗的颅内严重动脉粥样硬化患者卒中复发率和死亡率明显高于单纯接受单纯药物治疗的患者。PADALIA等[19]认为PTAS可用于在颅内动脉闭塞时血流动力学不稳定或多次调整药物治疗失败的患者。CHEN K等[17]认为在脑梗死体积小、低灌注面积大的情况下,即使脑梗死发病时间较长,再通仍是可行的。当在小动脉分支附近的狭窄血管上进行血管成形术时,应谨慎决定是否使用支架置入术,以免被压碎的斑块堵塞穿支动脉[20]。
IARED等[21]对锁骨下动脉狭窄治疗的研究认为目前还没有足够的证据来确定支架治疗比单纯血管成形术更有效。LEVY等[22]对基底动脉狭窄的研究认为直接放置支架可能会导致动脉粥样硬化碎片移位或破裂导致穿支动脉闭塞造成医源性神经功能缺损和脑桥梗死的影像学表现。对于复杂的、高度症状性的病变,可先行单纯球囊扩张,1个月后随访再行支架置入术可以提供最大的成功率,同时最小化神经系统疾病的风险。DERDEYN等[23]认为减少血管内治疗的术中及术后风险可单纯行PTA而不是PTAS,或者使用HR-MRI来制定治疗计划或选择患者,使支架置入后发生穿支动脉卒中的风险可以降低,但对于有证据表明在穿支血管段附近存在不稳定或破裂斑块的患者,积极的危险因素管理可能比机械干预更有效。对于是否考虑支架置入可根据血管开通后观察半小时判断血管是否回弹,如果达到重度狭窄(70%~99%)甚至再次闭塞,可以考虑支架置入。
3.3 血管内治疗技术要点目前多数学者[14-17,24-25]认为SNMCAO血管内治疗成功技术要点:①微导丝能否顺利通过闭塞段,需判断闭塞血管的性质、闭塞长度、角度和闭塞时间。闭塞节段长度越长,角度越弯曲,微导丝探查时血管穿孔和剥离的可能性越大。血管闭塞时间越长,闭塞段钙化、纤维化越严重,再通过程越困难;②术中动作轻柔,避免使用粗暴手法,遇到难以通过的迂曲或闭塞需及时终止手术,避免严重并发症的发生;③微导丝微导管小心通过闭塞段并造影观察远端管腔形态,确认位于血管真腔内;④当梗塞段出现夹层的情况需置入支架。
3.4 术后处理①所有患者治疗后立即行头颅CT检查,排除颅内出血。对于再通成功的患者,如果排除颅内出血,则静脉输注 0.15 μg/(kg·min)替罗非班 24~36 h,以预防急性血栓或血栓栓塞[16]。②服用双联抗血小板药物(阿司匹林100 mg/d;氯吡格雷 75 mg/d),未置入支架者服用 3个月,置入支架者服用6个月,然后根据随访情况继续终生服用两种抗血小板药物中的一种。同时给患者他汀类药物治疗[16]。③严格控制患者血压,预防高灌注综合征(hyperperfusion syndrome,HPS),将血压控制在术前血压的80%或控制在 100~120 mmHg/60~80 mmHg[15-16]。④术后 3~7 d常规行头部MRI检查,以发现远端栓塞或出血改变。⑤对患者进行控制其他危险因素(血压、高脂血症、血糖等)的教育。
4 血管内治疗SNMCAO效果评价
4.1 成功率和复发率10项研究共涉及115例SNMCAO患者(表 1),这些患者接受了 PTA 或 PTAS[14-17,24-29],闭塞至再通时间跨度为 4 d到168 d,其中 98例(85%)患者成功实现了血管再通,7例(7/95)患者3~12月随访中出现卒中复发或死亡,与中国颅内动脉粥样硬化(CHINESE INTRACRANIAL ATHEROSCLEROSIS,CICAS)研究中颅内动脉闭塞卒中的复发率(7%)相当[30]。

表1 国内外相关研究的病例特征
4.2 并发症的处理非急性期大脑中动脉闭塞血管内治疗因技术难度大,并发症发生率较高。常见并发症包括血管穿孔,蛛网膜下腔出血,高灌注综合征,穿支梗塞等[31]。血管穿孔及蛛网膜下腔出血:术中可发现造影剂渗出,可在MCA近端充盈球囊暂时堵住破口,起到止血的作用,必要时可予以覆膜支架或弹簧圈栓塞进行治疗[32]。高灌注综合征:主要以预防为主,血管开通过后,必须严格控制血压,为基础血压水平的80%或控制在100~120 mmHg/60~80 mmHg,必要时镇静、脱水等治疗[15,33]。穿支梗塞:术中可根据造影情况判断梗塞分支,微导管内注射低剂量(0.25~1 mg)替罗非班[34]。血管夹层形成:微导丝通过闭塞段时容易导致血管夹层形成,微导管造影确定在真腔内后,根据术中情况可置入支架以消除夹层[35]。血管再通失败见于闭塞节段较长(>10 mm),闭塞时间较长(>90 d),闭塞段累计M1段分叉及M2段,路径迂曲或成角等[14-16]。
5 结语
从已有的研究结果看,血管内再通治疗SNMCAO技术上是可行的,相对安全的,并且可以改善患者的缺血症状。然而目前对SNMCAO的治疗仍缺乏高水平的多中心前瞻性随机对照研究作为临床证据。相信随着介入材料、技术更新及进步,血管内再通治疗可能成为SNMCAO患者改善神经功能,提高生活、生存质量的一个新选择。

