小蓬竹根际土壤微生物及内生真菌多样性分析
陈 梦,陈敬忠,刘济明,*,武梦瑶,颜 强,李 鹏,黄路婷,肖雪峰
1 贵州大学林学院, 贵阳 550025
2 贵州省社会工业研究所, 贵阳 550025
3 贵州省山地资源研究所, 贵阳 550025
自然界中,植物常常与特定微生物(细菌、真菌、放线菌等)生活在一起,形成一个紧密的植物-微生物复合群落[1]。植物-微生物复合群落对于双方的生存和繁衍都具有重要意义,很多丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)、内生真菌(Endophytic fungi)、细菌(Bacteria)对植物生长发育有着不可忽视的作用[2-4],能够促进植物对土壤中氮、磷和水分利用等方式来促进植物的生长[5],同时植物体又能够为这些微生物提供寄宿场所和生长所需的能源[6- 7]。而根际作为自然界各种化学营养物质进入植物根部参与植物生长过程中物质循环的枢纽,承载着土壤、植物根系与微生物之间的相互作用[8- 9],因此对植物根际土壤微生物(细菌、真菌、放线菌)和植物内生真菌多样性进行研究,有助于揭示植物对环境的适应性和植物与微生物的相互关系[10]。
根际土壤微生物(Rhizospheriv soil microbe)在植物根部微生态系统中扮演着重要的角色,既要参与和驱动生态系统中植物体必须的营养元素与物质循环,还要促进土壤中有机质的分解、植物根系对养分的吸收转化和植物的生长发育,进而维持生态系统的健康。根际土壤微生物在特定的生境中会产生特定的“根际效应”来提高植物对外界不利环境的适应性,且在根部进行营养选择和富集,从而提高根际微生物多样性,增强植物在特定环境中的适应性[11],这种作用对植物在高盐、干旱缺水等极端条件下生长良好有重要作用[12]。植物内生真菌是指以植物体某一组织为宿主,对植物生长发育和健康有显著影响,通过帮助植物抵抗病虫害提高抗逆性的一类微生物[13]。研究表明,不同种类的内生真菌由于对养分的需求不同,其生活方式与生存环境也有所不同,所以尽管在同一植株不同部位间内生菌多样性也存在较大的差异,这种差异称之为内生真菌的“组织专一性”[14]。
小蓬竹AmpelocalamusluodianensisT. P. Yi & R. S. Wang系禾本科Poaceae竹亚科悬竹属(Ampelocalamus)植物[15],仅分布于贵州省罗甸、平塘、紫云和长顺等喀斯特山地,是典型的喀斯特物种,常成片生长于海拔600—1000 m的石灰岩裸露石山[16]。虽然小蓬竹分布区域十分狭窄,立地条件较差,但在其主要分布区均生长良好[17-19]。部分研究表明植物根际土壤微生物(细菌、真菌、放线菌)和内生真菌能够增强宿主植物抗逆性和对土壤肥力利用,进而改善其宿主植物生存状况[20- 21]。小蓬竹在土壤条件较差的喀斯特山地依旧能生长良好,是否与其微生物群落功能具有密切联系,是一个值得探索的问题。结合可培养微生物的优点,本文对小蓬竹根际土壤微生物(细菌、真菌、放线菌)和不同器官(根、茎、叶)内生真菌可培养部分多样性进行研究,有助于了解微生物-植物群落紧密的内在关系,同时在一定程度上可揭示小蓬竹对喀斯特特殊生境的适应性机理,同时纯化分离得到的菌株也可为后期寻找小蓬竹相关耐性功能微生物奠定良好的基础。
1 材料与方法
1.1 研究区概况
采样点位于贵州省罗甸县董架乡打鸟槽,经纬度为106°45′17″E、25°30′39″N,属于典型南亚热带季风气候。日照时数约1300—1500 h,年降水量约1000—1400 mm,海拔757 m。土壤为石灰土(pH 7.68),主要土壤酶活性分别为:过氧化氢酶 (8.74±0.01) g/min、蔗糖酶 (2.64±0.03) g/d、脲酶0.04 mg (NH3-N)/g/d(实测值)。
1.2 实验材料
于采样点(罗甸县董架乡)沿等高线按一定距离设置5个样方(5 m ×5 m),每个样方随机选择10株母竹,将竹丛整丛挖出,采集健康植株根、茎、叶3部分样品(茎部分混合上中下3个部位),使用抖落法采集附着于根系2 mm根际土壤。将各样方采集的10株植株分别按根、茎、叶均匀混合,置于4 ℃冰盒低温保存及时带回实验室处理。所需培养基为:25%双抗PDA培养基、PDA培养基、马丁氏-孟加拉红培养基、牛肉膏蛋白胨培养基、改良高氏1号培养基(所有培养基均购买自上海博微生物科技有限公司)[22]。
1.3 微生物的分离培养
1.3.1根、茎、叶内生真菌的分离
将根、茎、叶用无菌水将表面附着的土壤洗净,用无菌刀切割成4 mm×4 mm大小的组织块。在无菌操作台内将组织块于75% 酒精浸泡1 min后无菌水冲洗3次,随后用2.5% 次氯酸钠溶液消毒1 min后再放入75% 酒精浸泡30 s,使用去离子无菌水冲洗5次后无菌滤纸擦干。将组织块两端削后接种在25% 双抗PDA培养基,在优化后的每个平板上的6个琼脂块各接1个组织块,每个处理10个重复,然后置于26 ℃ 的生化培养箱内恒温培养(采用组织印迹法、漂洗液涂布法及空白对照法检测操作环境和组织表面是否消毒干净,保证分离到的为“内生菌”)[22- 24]。随时观察组织切口是否有菌丝长出,待菌丝长出后及时转接至PDA培养基,纯化2—3次后获得单一菌株[20-21]。
1.3.2土壤真菌、细菌、放线菌的分离
使用稀释平板涂抹法,取10 g新鲜土样转入90 mL无菌水中,在摇床上振荡30 min充分混匀(200.0 rpm,25 ℃)。使用移液枪吸取混匀后的土样溶液1 mL,转入装有9 mL无菌水的试管中,获得浓度为10-2的稀释土样。(1)真菌:使用孟加拉红培养基(加100 U/mL青霉素和庆大霉素160 U/mL抑制细菌生长),置于生化培养箱28 ℃培养5 d,每日观察菌落生长情况,一旦发现菌丝长出立即挑取单菌落边缘菌丝接种至新的PDA培养基,重复2—3次直至获得单一菌株。(2)细菌:使用牛肉膏蛋白胨培养基,置于生化培养箱37 ℃培养2—7 d,待菌落长出后立即挑取形态、颜色、质地等不同的单菌落划线于新的平板培养直至获得纯菌株。(3)放线菌:使用改良高氏1号培养基,置于生化培养箱28 ℃培养7 d;纯化方法同真菌,所有处理在纯化2—3次后获得单一菌株[25- 26]。
1.4 菌种鉴定
使用Ezup柱式(离心柱型,50 PREPS)真菌和细菌基因组DNA抽提试剂盒(生物工程(上海)股份有限公司)提取DNA,使用DNA纯化试剂盒Kit Ver.2.0 (TaKaRa)进行纯化,用1% 琼脂糖凝胶(其中含有0.5 mg/L 溴化乙锭)电泳检测DNA的质量。PCR扩增引物和程序如下:
(1)真菌:通用引物。序列为:ITS1-F(5′-CTTGGTCATTTAGAGGAAGTAA- 3′),ITS4-R(5′-TCCTCCGCTTA TTGATATGC- 3′)[27]。

表1 真菌扩增体系(50 μL)
(2)细菌、放线菌:通用引物。Bact-F(5′-AGAGTTTGATCCTGGCTCAG- 3′),Bact-R(5′-CTACGGCTACCTT GTTALGA- 3′)[28]。

表2 细菌、放线菌扩增体系(50 μL)
扩增产物由英潍捷基(上海)贸易有限公司(Invitrogen) 采用ABI 3730xl测序,最后登陆NCBI GenBank通过BLAST比对测序结果,下载最相近的菌株序列(相似性大于97%),结合分子生物学证据鉴定菌株种类[25- 26]。
1.5 数据处理
(1)真菌、细菌、放线菌多样性:利用Shannon-Wiener 多样性指数(H)、均匀度指数(E)、Simpson指数(D)评价小蓬竹微生物多样性,计算公式如下[29]:
H=∑(PilnPi) (Pi为第i种菌株数占全部菌株数的百分比)
D=1-∑(Pi)2(Pi为第i种菌株数占全部菌株数的百分比)
E=H/ln(S) (H为Shannon-Wiener指数,S为物种总数目)

(2)系统发育树的构建:利用Clustal X 2. 0软件对下载的菌株序列进行匹配排列,用MEGA 6(邻接法)和Figtree软件进行系统发育树的构建与美化[29]。
(3)采用Origin 2018 对真菌、细菌、放线菌进行层次聚类分析和绘图工作。
2 结果与分析
2.1 根际土壤微生物及不同器官内生真菌的组成
从小蓬竹根际土壤和根茎叶分离得到具有明显形态差异的菌株200株,组成情况如下(图1):(1)土壤真菌与内生真菌菌株共139株,通过rDNA-ITS 序列比对归属27属54种。根部分离得到的63个内生真菌菌株可归到17个属,优势属为漆斑菌属Myrothecium(12.70%)、镰刀菌属Fusarium(12.70%)、稻镰状瓶霉属Harpophora(11.11%)。茎分离得到的14个内生真菌菌株可归到8个属,优势属依次为弯孢聚壳属Eutypella(14.29%)、肉座菌属Hypcrea(14.29%)、拟茎点霉属mitosporic(14.29%)、脉孢菌属Neurospora(14.29%)、刺盘孢属mitosporic(14.29%)、半壳霉属Rhytismataceae(14.29%)。叶分离得到的28个内生真菌菌株可归到9个属,优势属节菱孢霉属Arthrinium(28.57%)、炭角菌属Xylaria(21.42%)、毛壳菌属Chaetomium(10.71%)。根际土分离得到的34个内生真菌菌株可归到12个属,优势属依次为青霉菌属Penicillium(20.59%)、曲霉属Aspergillus(17.64%)、木霉属Trichoderma(14.40%)、踝节菌属Talaromyce(11.76%)、漆斑菌属Myrothecium(11.76%);(2)从根际土壤中分离得到41株细菌菌株可归到7个属,其中优势属为芽孢杆菌属Bacillus(70.73%);(3)从根际土壤中分离得到的20株放线菌菌株全部归属于链霉菌属Streptomyces。

图1 小蓬竹根际土壤微生物及不同器官内生真菌相对多度
2.2 根际土壤微生物及不同器官内生真菌的系统发育关系分析
(1)真菌(图2):小蓬竹根、茎、叶、根际土壤总共分离得到139个真菌菌株均属于子囊菌门。其中Trichodermavelutinum(EF596953.1)与Trichodermaspirale(KM011996.1)、Fusariumsp.WF150(HQ130706.1)和Fusariumredolens(EF495234.1)、Fusariumsp. LMG201(KJ598872.1)和Fusariumsp.C_1_BESC_294z(KC007281.1)、Hypocreanigricans(JN943369)和Hypocrearufa1(KC01245.1)、Fusariumsp. LMG20(KJ598872)和Fusariumsp. WF150(HQ130706)的支持率均达到100%,说明上述类群亲缘关系较近。其余各个类群间支持率从4%到99%不等,亲缘关系依次从远到近。在分类水平上来看,粪壳菌纲Sordariomycetes处于绝对优势纲,占菌株总数的 76.08%,其余占比分别为散囊菌纲Eurotiomycetes 5.18%,座囊菌纲Dothideomycetes 3.62%、丝孢菌纲Hyphomycetes 2.17%、锤舌菌纲Leotiomycetes 1.4%、Agaricomycetes伞菌纲 0.74%;(2)细菌(图3):从根际土壤中分离得到40细菌菌株分别归属于厚壁菌门Firmicutes(29株)、变形菌门Proteobacteria(11株)、拟杆菌门Bacteroidetes(1株)。其中变形菌门中的Pseudomonasmonteilii和Pseudomonassp. JSPB3,Lysobactersp. R7- 567和Lysobactersp. BBCT65支持率菌达到了100%,说明上述两者间亲缘关系较近。其余支持率从21%—99%不等;(3)放线菌(图4):从根际土壤中分离得到的20株菌株均属于链霉菌属Streptomyces,分属于15个种。支持率从7%—99%不等。

图2 小蓬竹不同部位真菌系统发育树

图3 小蓬竹细菌系统发育树
2.3 根际土壤微生物及不同器官内生真菌多样性分析
由图3可知,真菌多样性指数中:Shannon-Wiener 多样性指数H依次为根2.652>根际土2.18>茎2.045>叶1.989,Simpson指数D依次为根0.919>根际土0.932>茎0.867>叶0.834,均匀度指数E依次为根际土0.89>茎0.775>根0.640>叶0.597。从多样性的排序可以看出在Shannon-Wiener多样性指数H与Simpson指数D中最高的为根,最低的为叶,而在均匀度指数E中最高的为根际土,最低的为叶。从几个多样性指数的计算结果来看,根际土壤真菌的多样性总体要高于不同器官(根茎叶)内生真菌的多样性;根际土细菌多样中:H指数为1.0679,Simpson指数D为0.5217,均匀度指数0.5488;根际土放线菌多样中:H指数为2.63,Simpson指数D为0.08,均匀度指数0.9865。
2.4 根际土壤微生物及不同器官内生真菌群落相似性比较
通过对小蓬竹根际土壤微生物和各个器官内生真菌的种类构成进行层次聚类(距离采用欧式距离)分析后发现(图6),根际土与不同器官的真菌组成首先单独聚为一支,其中茎与叶先聚为一类,其后茎、叶与根聚为一类,最后根、茎、叶再与根际土聚为一类。从聚类结果可知,根、茎、叶真菌群落相似性较高,而根、茎、叶与根际土壤相似性较低。同时也反映出不同器官内生真菌的组成具有较高的相似性,而与根际土壤紧密接触的根部内生真菌与根际土壤真菌具有一定相似性;根际土细菌和放线菌聚类距离与所有真菌相等,完整的将真菌、细菌、放线菌聚为3支。
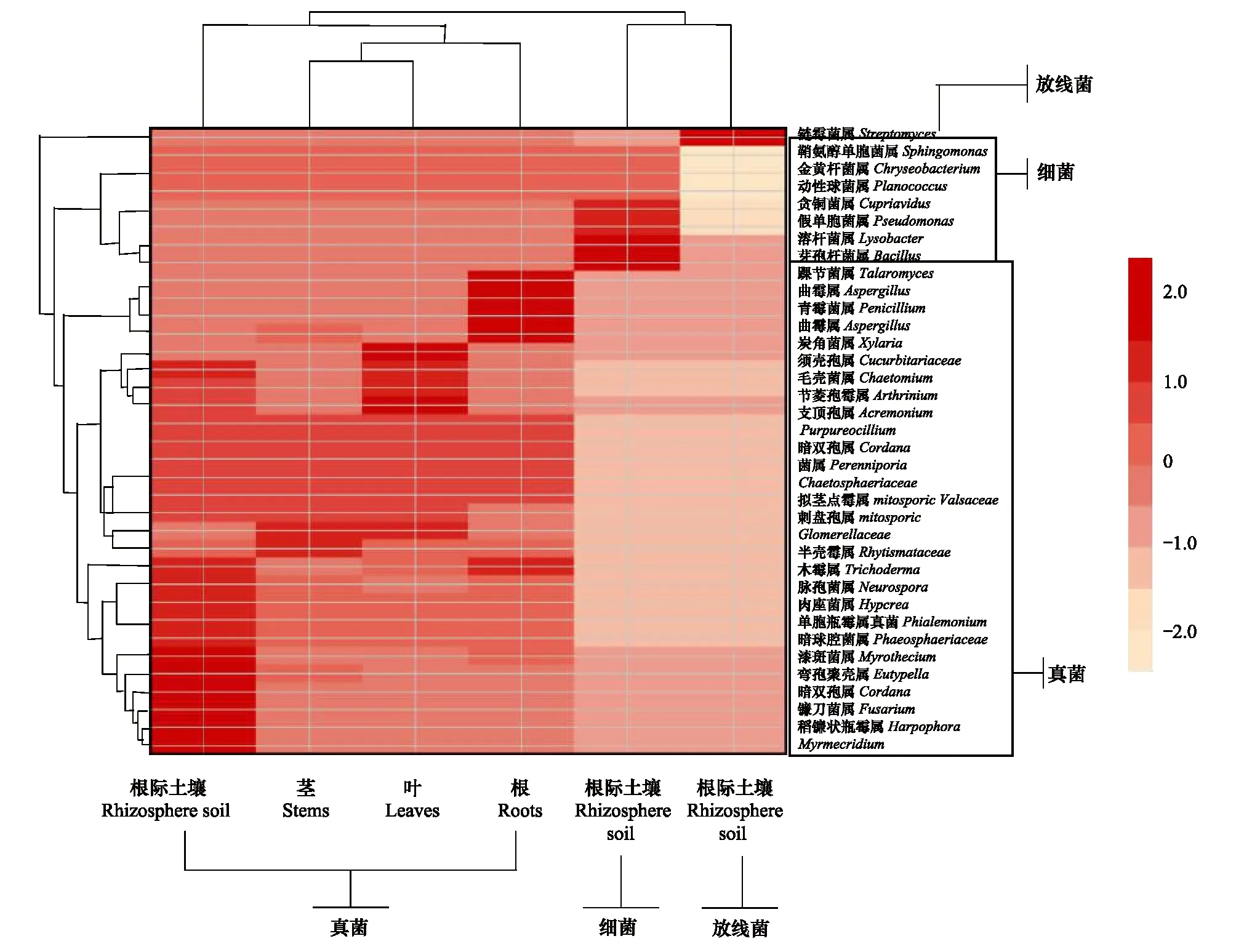
图6 小蓬竹根际土壤微生物与各个器官内生聚类分析结果
3 讨论
物种多样性指数是衡量物种数量的重要指标,通常在群落中物种越丰富,分布比例越均匀则物种群落的多样性指数越高[30]。从小蓬竹根际土壤及不同器官微生物物种多样性指数(图2—图4)来看:根和根际土的真菌多样性指数最高,物种丰富度从下(根,根际土)到上(茎、叶)呈现出逐步降低的趋势,这在刺槐Robiniapseudoacacia、重楼Parispolyphyllavar.chinensis等植物中也观察到类似的现象[31- 32]。根际土壤细菌和放线菌物种多样性相对较低,相关研究者认为可能是真菌群落受到土壤中N、P、K等元素影响造成[33]。小蓬竹根际土壤与根部内生真菌多样性较高原因可能是由于在根与土壤接触界面具有较多凋落物残体(凋落的叶、枝条、死根)以及根际分泌物能够为根际和根部真菌分解利用提供充足碳源和可利用元素,进而促进其丰富度的提高[30]。

图4 小蓬竹放线菌系统发育树
从根际土和植株不同部位微生物组成来看,真菌类群中的脉孢菌属Neurospora、木霉属Trichoderma在根际土、根、茎、叶内均有分布,其中木霉属被认为是具有重寄生(fungal parasite)功能的生防菌[31],对许多植物病原菌都具有一定的拮抗作用[9,34],这对小蓬竹抵抗喀斯特地区不良环境具有重要意义;同时在小蓬竹根际土和根存在节菱孢霉属Arthrinium和漆斑菌属Myrothecium两个共有属,并且在根际土壤与根中均分离得到菌种Myrotheciumverrucaria。土壤微生物类群中,普遍存在着一类与植物共同进化并建立良好的共生关系促进植物生长发育的细菌群落(PEGR),诸如假单胞菌属(Pseudomonassp.)、芽孢杆菌属(Bacillussp.)等[35],这类细菌不仅可以诱导植物体自身产生抗生素抵御生物胁迫,而且还会通过产生激素和酶等信号分子,增强植株系统耐受性,同时促进植物对土壤中矿质营养元素的吸收,进而促进植物的生长[36-37]。小蓬竹根际土壤微生物与内生菌丰富的多样性为其塑造了多样的植物功能性状,为其在喀斯特地区生长良好提供了必要的条件。

图5 小蓬竹根际土壤微生物及不同器官内生真菌多样性指数
根际及内生菌能够促进植物营养元素的摄取[7],同时对植物次生代谢产物积累与产生具有重要影响[38-39],反之植物根系分泌产物又影响根际及内生菌的生长繁殖[2],根际土壤真菌及植物内生真菌的这些特性可以有效促进喀斯特地区植物在贫瘠土壤条件下对肥力资源的利用[38-41];刘雯雯等[34]发现在喀斯特灌木演替阶段,土壤真菌的优势属为木霉属、青霉属等,而作为竹灌的小蓬竹在根际土壤真菌优势属组成与上述结果具有较大的相似性。同样小蓬竹内生真菌中的青霉属Penicillium镰刀菌属Fusarium等菌属在植物耐受喀斯特地区钙胁迫和抵御病原菌侵染方面具有重要作用[40-43]。根际土壤细菌类群中的芽孢杆菌属Bacillus、贪铜菌属Cupriavidus被证实能够促进植株对土壤中K元素的利用,这对于喀斯特小蓬竹适应喀斯特地区贫瘠的环境具有重要意义[44-45]。相关学者对于喀斯特地区放线菌的研究也发现主要以链霉菌属Streptomyces为主[46-48]。上述菌属的存在可位揭示小蓬竹对喀斯特地区环境适应性奠定基础,但具体机制机理尚需进一步对分离的相应菌种进行相关功能试验。
4 结论
研究表明,从喀斯特地区特有植物小蓬竹根际土壤及根、茎、叶共分离得到139株真菌菌株,归属于27属,其中根际土壤34株为12属,青霉菌属Penicillium为优势属;根部63株为17属,漆斑菌属Myrothecium、镰刀菌属Fusarium为优势属;茎部14株为8个属,弯孢聚壳属Eutypella、肉座菌属Hypcrea、拟茎点霉属Mitosporic、脉孢菌属Neurospora、刺盘孢属mitosporic、半壳霉属Rhytismataceae为优势属;叶部28株划分为9属,节菱孢霉属Arthrinium为优势属。根际土壤分离得到细菌菌株41株,归属7属,芽孢杆菌属Bacillus为优势属。放线菌菌株20株,均为链霉菌属Streptomyces。
根际土壤真菌Shannon-Wiener 指数H为2.18,根、茎、叶内生真菌分别为2.652、2.045、1.989;Simpson指数D为:根际土壤真菌0.932,根0.919、茎0.867、叶0.834;均匀度指数E为:根际土壤真菌0.89,根0.640,茎0.775,叶0.597。根际土细菌Shannon-Wiener指数为1.0679,Simpson指数为0.5217,均匀度指数为0.5488。根际土放线菌Shannon-Wiener指数为2.63,Simpson指数为0.08,均匀度指数为0.9865。综合三个多样性指数表明小蓬竹根际土壤真菌多样性较内生真菌多样性高。

