卵巢上皮性癌中VEGF、CD4+、CD8+及COX⁃2表达与TIDC相关性
吴明燕 康雪芳 林月丽 林也容 张兰 黄丽玲 陈慧
作者单位:中国人民解放军联勤保障部队第九○九医院妇产科,福建,漳州363000
卵巢上皮性癌约占女性恶性肿瘤的3%~4%,具有高死亡率、高发病率的特点[1]。肿瘤细胞的快速生长与转移是导致患者预后不良的主要危险因素,目前已有研究证实,肿瘤快速生长与转移及免疫抑制有关[2]。T 淋巴细胞介导的细胞免疫在机体排斥肿瘤细胞时起主要作用,但肿瘤抗原只有经抗原递呈细胞的抗原递呈后才能被T 淋巴细胞识别。当今免疫学研究认为,机体处于免疫激活或免疫抑制依赖于抗原呈递细胞(Antigen presenting cell,APC)的抗原递呈功能[3]。人体内功能最强的专职APC 为树突状细胞(Dendritic cell,DC)。肿瘤组织局部浸润的DC 称为肿瘤浸润性DC(Tumor invasive DC,TIDC),其能真实反映组织局部的免疫状态[4]。组织中环氧合酶⁃2(Cyclooxygenase⁃2,COX⁃2)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)等因子均与TIDC 的分化、成熟有关[5]。本研究将通过分析卵巢上皮性癌中VEGF、CD4+、CD8+及COX⁃2 表达与TIDC 的关系,探讨卵巢上皮性癌局部免疫功能抑制的可能机制。
1 资料与方法
1.1 一般资料
选取本院2016年12月至2020年1月收治的110 例卵巢上皮性癌患者作为研究组。纳入指标:①均符合卵巢上皮性癌的诊断标准[6];②自愿参与本次研究,且签署知情同意书者;③临床资料无缺失或丢失;④未进行化疗、放疗等治疗者。排除标准:①心脏、肝肾功能不全;②神经功能障碍者;③合并其他恶性疾病;④哺乳期妇女或妊娠期孕妇。平均年龄为(51.98±10.74)岁;临床分期:Ⅰ期30 例,Ⅱ期33 例,Ⅲ期30 例,Ⅳ期17 例;病理类型:浆液性癌81 例,黏液性癌29 例;伴有腹水者41 例;病理分级G139 例,G237 例,G334 例。另同期选取进行健康体检的70 例女性体检者作为对照组,平均年龄为(50.87±9.36)岁。两组一般资料比较差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会批准通过。
1.2 方法
1.2.1 主要试剂
一抗均为浓缩型,鼠抗人S⁃100 单克隆抗体,购自美国Neomarkers 公司。鼠抗人VEGF、COX⁃2 单克隆抗体,购自美国Santa Cruz 公司。链酶菌抗生物素蛋白⁃过氧化物酶连接(SP)免疫组化超敏试剂盒、胰蛋白酶及二氨基联苯氨酶底物显色试剂盒,购自福州迈新生物技术开发有限公司。
1.2.2 检测方法
首先进行标本准备:组织切片后脱蜡、水化。然后根据S⁃P 免疫组化染色法对S⁃100、VEGF 及COX⁃2 进行检测,检测过程严格按照说明进行。一抗阴性对照使用PBS(磷酸盐缓冲液)进行代替。
1.2.3 结果判断[7]
根据S⁃100、VEGF 及COX⁃2 阳性细胞百分比、染色强度判定。分为:0 分、1 分、2 分、3 分、4 分。染色强度判定:0 分:无色,1 分:淡黄色,2 分:棕黄色,3 分:棕褐色。总积分:上述2 项评分的乘积。阳性:总积分>4 分。
1.2.4 T 淋巴细胞检测
空腹抽取所有受检者3 mL 静脉血,3 500 r/min离心15 min,分离血清,取上清液,置于-80℃低温保存待检。采用贝克曼流式细胞仪检测患者外周血T 淋巴细胞亚群(CD4+、CD8+)。
1.2.5 TIDC 确认标准[8]
TIDC 确认标准:细胞形态完整,细胞核与细胞形态不规则,细胞质可见明显凸起;S⁃100 蛋白染色阳性。TIDC 计数:由两名或以上病理科医师进行阅片。低倍镜下任选染色背景清晰处,然后在高倍镜下任选5 个视野计数TIDC 总数,并计算其平均值,为TIDC 数密度。
1.3 观察指标
①比较两组S⁃100 TIDC 及VEGF、COX⁃2、CD4+、CD8+表达情况。②分析卵巢上皮性癌病理特征与TIDC 数密度及VEGF、COX⁃2、CD4+、CD8+的关系。③分析VEGF、COX⁃2、CD4+、CD8+与TIDC 的相关性。
1.4 统计学方法
采用SPSS 22.0 软件进行统计分析,计量资料以()表示,采用t检验;计数资料以n(%)表示,采用χ2检验;采用Pearson 法对各参数进行相关性分析;以P<0.05 为差异有统计学意义。
2 结果
2.1 两组S⁃100 及VEGF、COX⁃2、CD4+、CD8+表达情况比较
研究组S⁃100 及VEGF、COX⁃2 阳性表达率和CD4+、CD8+水平均显著高于对照组,差异均有统计学意义(P<0.05)。见表1、图1。
表1 两组S⁃100 及VEGF、COX⁃2、CD4+、CD8+表达情况[n(%),(±s)]Table 1 Expression of S⁃100 and VEGF,COX⁃2,CD4+、CD8+in two groups[n(%),(±s)]

表1 两组S⁃100 及VEGF、COX⁃2、CD4+、CD8+表达情况[n(%),(±s)]Table 1 Expression of S⁃100 and VEGF,COX⁃2,CD4+、CD8+in two groups[n(%),(±s)]
组别n S⁃100阳性阴性VEGF阳性阴性COX⁃2阳性阴性CD4+CD8+对照组研究组t/χ2值P 值70 110 44(62.86)91(82.73)9.008 0.003 26(37.14)19(17.27)3(4.29)78(70.81)76.718<0.001 67(95.71)32(29.09)4(5.71)83(75.45)83.316<0.001 66(94.29)27(24.55)10.71±6.02 18.77±9.56 6.300<0.001 10.94±6.28 38.95±15.75 14.168<0.001
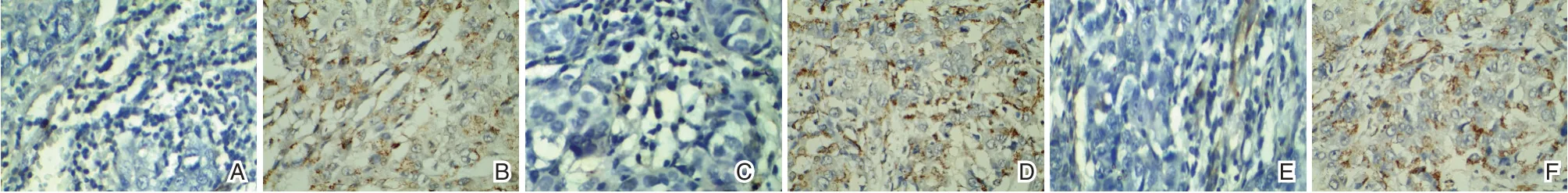
图1 免疫组化染色图(SP,×400)Figure 1 immunohistochemical staining(SP,×400)
2.2 卵巢上皮性癌病理特征与TIDC 数密度及VEGF、COX⁃2、CD4+、CD8+的关系
临床分期Ⅲ~Ⅳ期、有腹水者TIDC 数密度明显高于Ⅰ~Ⅱ期、无腹水者,差异有统计学意义(P<0.05)。临床分期Ⅲ~Ⅳ期、病理分级G3者VEGF、COX⁃2 阳性表达率与Ⅰ~Ⅱ期、G1⁃G2级者,差异有统计学意义(P<0.05)。浆液性癌患者CD4+水平显著高于黏液性癌患者,差异有统计学意义(P<0.05)。临床分期Ⅲ~Ⅳ期、有腹水及病理分级G3者CD8+水平明显高于Ⅰ~Ⅱ期、无腹水及病理分级G1⁃G2级者,差异有统计学意义(P<0.05)。见表2。
表2 卵巢上皮性癌病理特征与TIDC 数密度及VEGF、COX⁃2、CD4+、CD8+的关系[(±s),n(%)]Table 2 The relationship between the pathological characteristics of epithelial ovarian cancer and the number density of TIDC,VEGF,COX⁃2,CD4+,CD8+[(±s),n(%)]

表2 卵巢上皮性癌病理特征与TIDC 数密度及VEGF、COX⁃2、CD4+、CD8+的关系[(±s),n(%)]Table 2 The relationship between the pathological characteristics of epithelial ovarian cancer and the number density of TIDC,VEGF,COX⁃2,CD4+,CD8+[(±s),n(%)]
病理特征年龄n t值P值χ2值P值χ2值P值t值TIDC数密度9.17±2.07 9.71±2.28 8.45±1.56 8.62±1.74 9.74±1.07 9.35±1.48 10.19±2.74 8.04±1.77 7.56±1.26 10.84±3.04 8.15±1.47 8.06±1.14 P值t值VEGF阳性47(72.30)31(68.89)35(74.47)43(68.25)58(71.60)20(68.97)31(49.21)47(100.00)28(68.29)50(72.46)44(57.89)34(100.00)P值0.4510.653 1.2870.201 COX⁃2阳性49(75.38)34(75.56)37(78.72)46(73.02)60(74.07)23(79.31)38(60.32)45(95.74)30(73.17)53(76.81)51(67.11)32(94.12)3.3290.068 0.4730.491 CD4+14.27±9.77 15.21±4.86 13.56±8.54 12.89±7.98 18.03±8.21 14.98±10.56 17.25±12.37 16.54±11.05 15.97±9.54 14.65±8.06 17.68±12.94 16.99±11.87肿瘤直径<45岁≥45岁<10 cm≥10 cm浆液性黏液性Ⅰ~ⅡⅢ~Ⅳ0.5300.598 0.5530.673 0.0010.984 0.5960.553 0.5040.478 0.2390.812组织学类型1.5150.133 0.0720.788 0.3160.574 0.4230.115 0.1970.845临床分期4.6950.001 33.6670.001 18.2420.001 0.6730.756 2.3410.021腹水6.5720.001 0.4200.517 0.1840.668 1.5870.440 3.3950.001病理分级有无G1⁃G2 G3 65 45 47 63 81 29 63 47 41 69 76 34 0.3170.752 20.1890.001 9.2550.002 0.1150.792 CD8+27.90±9.65 28.78±10.65 33.56±18.56 32.74±17.26 34.56±19.56 33.74±18.47 26.87±9.45 31.54±18.05 33.17±20.56 20.77±17.21 26.87±15.56 35.56±18.55 2.5480.012
2.3 VEGF、COX⁃2、CD4+、CD8+与TIDC 的相关性分析
VEGF、COX⁃2、CD8+与TIDC 均呈负相关关系(r1=-0.654,r2=-0.584,r3=-0.524,P<0.05),CD4+与TIDC 无显著相关性(r=-0.112,P>0.05)。
3 讨论
肿瘤的发生、发展与机体免疫相关,近些年肿瘤免疫学的发展为临床诊治方面提供了新方向。树突细胞在肿瘤患者中可作为一种抗原呈递细胞,刺激细胞毒性T 细胞等的增殖,进而对肿瘤细胞进行杀伤[9⁃10]。由于体外分离培养TIDC 较困难,因而对TIDC 的研究受到方法学的限制。本研究中采用S⁃100 蛋白标记卵巢上皮性癌TIDC。大多数TIDC 体积大、树突较长,分布于肿瘤细胞之间,可通过内胞饮、吞噬等方式摄取卵巢癌抗原[11]。Camerin等[12]研究显示,分布在肿瘤外围间质的TIDC 因更靠近淋巴组织,可能处于抗原递呈阶段。本研究中,卵巢上皮性癌患者S⁃100 阳性表达率显著高于健康女性,与Roze 等[13]研究报道相符。推测其原因可能是在卵巢上皮性癌抗原的刺激下,循环中的一部分DC趋化到肿瘤微环境中,参与机体免疫应答。
VEGF 是重要的肿瘤血管生成通路,尤其是血管内皮生长因子受体2(Vascular endothelial growth factor receptor 2,VEGFR2),在血管发生和血管生成中起重要作用。COX⁃2 是一种诱导酶,组织损伤或者患有炎症的情况下,COX⁃2 表达会增强。COX⁃2 可明显促进VEGF、转化生长因子β1(Trans⁃forming growth factor⁃beta 1,TGF⁃1)等前血管形成因子的生成。VEGF 可通过骨髓造血前体细胞上的受体血管内皮生长因子受体1(Vascular endothelial growth factor receptor 1,VEGFR1)与VEGFR2 结合,抑制造血前体细胞转录因子核因子κB 的激活,阻滞DC 前体细胞向DC 分化,诱导DC 细胞凋亡,进而减少DC 数量。Adler 等[14]研究证实,胃癌组织中VEGF 表达与TIDC 密度呈负相关。基于上述文献结果,本研究推测卵巢上皮性癌中VEGF、COX⁃2表达可能与TIDC 存在相关性,结果证实,上述因子与TIDC 呈负相关。推测可能是卵巢癌组织中高水平VEGF、COX⁃2 抑制了TIDC 的分化。
在控制具有免疫原性肿瘤细胞生长过程中,T 细胞介导的免疫应答最为重要。T 细胞亚群主要包括CD8+、CD4+,前者可直接作为效应细胞特异性杀伤癌细胞,后者则主要分泌细胞因子调节肿瘤免疫。Mrch 等[15]研究发现,卵巢上皮性癌中,CD8+、CD4+表达与正常卵巢组织比较差异具有统计学意义,且在Ⅲ~Ⅳ期、G3中表达明显下降。本研究与上述报道一致,表明中晚期卵巢癌中T 细胞活性功能显著下降。进一步分析结果提示局部组织中CD8+的分布与数量可能受TIDC 的调节。
综上所述,卵巢上皮性癌组织中VEGF、COX⁃2、CD8+、CD4+均存在异常表达,且VEGF、COX⁃2、CD8+水平可影响卵巢上皮性癌中TIDC 的密度,可能影响宿主的抗肿瘤免疫能力与肿瘤的浸润转移。

