上皮性卵巢癌患者血清HMGA2、IL⁃22、FOLR1水平及与临床指标的相关性
陈睿琦 刘晓云
作者单位:遵义医科大学第三附属医院妇产科,贵州,遵义563000
卵巢癌为女性生殖系统的常见恶性肿瘤,早期卵巢癌无明显症状,多数患者确诊时已处于中晚期,5年生存率较低,尤其是已经发生转移的晚期卵巢癌患者5年生存率低于30%[1]。上皮性卵巢癌(epithelial ovarian cancer,EOC)为卵巢癌最常见的类型,寻找新的有效的生物标志物及治疗手段是改善EOC 患者生存率的重要方式。高迁移率族蛋白A2(high mobility group protein A2,HMGA2)是近年来发现的与恶性肿瘤发生、浸润和转移存在密切联系的染色质非组蛋白,其在多种间质性或上皮性恶性肿瘤组织中存在高表达[2]。白细胞介素⁃22(interleukin⁃22,IL⁃22)为T 辅助细胞22(T⁃helper cell 22,Th22)的效应细胞因子,在肿瘤免疫逃逸机制中存在关键作用,研究证实IL⁃22 可促进结肠癌、乳腺癌等恶性肿瘤细胞增殖[3⁃4]。叶酸受体1(folate receptor 1,FOLR1)蛋白为糖基化磷脂酰肌醇偶联糖蛋白,对于叶酸及其衍生物具有高度亲和力,其在正常组织中表达很低,但在特定上皮来源恶性肿瘤组织中呈高表达[5]。本研究对EOC 患者血清HMGA2、IL⁃22、FOLR1 水平及与临床病理特征和预后生存的相关性进行了探究,具体如下。
1 资料与方法
1.1 一般资料
选取本院2018年10月至2020年9月收治的60例EOC 患者作为EOC 组,其中,EOC 患者平均年龄(51.3±3.8)岁,FIGO 分期Ⅰ期10 例、Ⅱ期13 例、Ⅲ期28 例、Ⅳ期9 例;分化程度:低分化17 例,中分化22例,高分化21 例;组织分型:浆液性囊腺癌34 例,非浆液性囊腺癌26 例;淋巴结转移:有11 例,无49 例;腹水:有14 例,无46 例。选择60 例卵巢良性肿瘤患者作为良性组,其中内功内膜异位症患者28例,宫颈癌前病变21 例,盆腔炎性包块患者11 例,均术后证实卵巢无任何病变,平均年龄(51.7±3.8)岁。另选择同期健康体检者60 例作为健康组,平均年龄(51.5±4.4)岁,均自愿参与本研究,无卵巢疾病史,月经及内分泌功能正常。3 组研究对象年龄比较差异无统计学意义(P>0.05)。所有患者知情同意,本实验经医院伦理委员会同意批准。
纳入标准:①均符合卵巢肿瘤的相关诊断标准[6],并经术后组织病理学检查确诊;②EOC 患者未接受放射治疗、化学治疗等;③均为首发病例。排除标准:①预计生存期低于3 个月者;②合并其他恶性肿瘤者;③合并重要脏器功能障碍、系统疾病者;④无法配合完成研究者。
1.2 方法
EOC 患者及良性肿瘤患者入院次日清晨抽取5 mL 空腹静脉血,健康体检者入院当日清晨抽取5 mL 空腹静脉血,3 000 r/min 离心15 min 收取上清,-80℃保存待测。采用酶联免疫吸附试验检测血清HMGA2、IL⁃22、FOLR1 水平,HMGA2、FOLR1试剂盒购自武汉博士德生物工程有限公司,IL⁃22试剂盒购自美国R&D 公司,680 全自动酶标仪购自美国Bio⁃Rad 公司。严格依照仪器及试剂盒说明书进行各项操作。所有患者均符合EOC 手术相关指征,依照文献[6]标准进行治疗,术后随访6 个月~2年,统计复发情况,所有患者均采用门诊复诊的形式进行随访,所有患者均配合完成随访,复发患者根据患者实际情况给予对症治疗。
1.3 统计学分析
采用SPSS 19.0 软件进行数据统计分析。计数资料以n(%)表示,计量资料以()表示,两组间比较采用t检验,多组间比较采用单因素方差分析。受试者工作特征曲线(Receiver operating curve,ROC)及曲线下面积(Area under the curve,AUC)评估HMGA2、IL⁃22、FOLR1 对于EOC 的诊断价值;Cox 回归模型分析HMGA2、IL⁃22、FOLR1是否为影响EOC 患者生存率的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清HMGA2、IL⁃22、FOLR1 水平比较
血清HMGA2、IL⁃22、FOLR1 水平比较结果:EOC 组>良性组>健康组,差异有统计学意义(P<0.05)。见表1。
表1 各组血清HMGA2、IL⁃22、FOLR1 水平比较(±s)Table 1 Comparison of serum HMGA2,IL⁃22 and FOLR1 levels in each group(±s)

表1 各组血清HMGA2、IL⁃22、FOLR1 水平比较(±s)Table 1 Comparison of serum HMGA2,IL⁃22 and FOLR1 levels in each group(±s)
组别健康组良性组EOC 组F 值P 值n 60 60 60 HMGA2(mg/L)22.5±5.7 58.7±6.9 253.7±58.3 29.257 0.000 IL⁃22(pg/mL)17.2±2.8 26.1±2.9 39.2±5.3 26.927 0.000 FOLR1(pg/mL)59.2±6.6 128.6±24.3 562.8±77.1 48.247 0.000
2.2 EOC 患者血清HMGA2、IL⁃22、FOLR1 与临床病理特征的相关性分析
不同FIGO 分期、组织分化程度、病理类型、有无淋巴结转移、腹水EOC 患者血清HMGA2、FOLR1、IL⁃22 水平比较,差异有统计学意义(P<0.05)。不同年龄血清HMGA2、IL⁃22、FOLR1 水平比较差异无统计学意义(P>0.05)。见表2。
表2 EOC 患者血清HMGA2、IL⁃22、FOLR1 与临床病理特征的相关性分析(±s)Table 2 Correlation analysis of serum HMGA2,IL⁃22,FOLR1 and clinicopathological characteristics in EOC patients(±s)
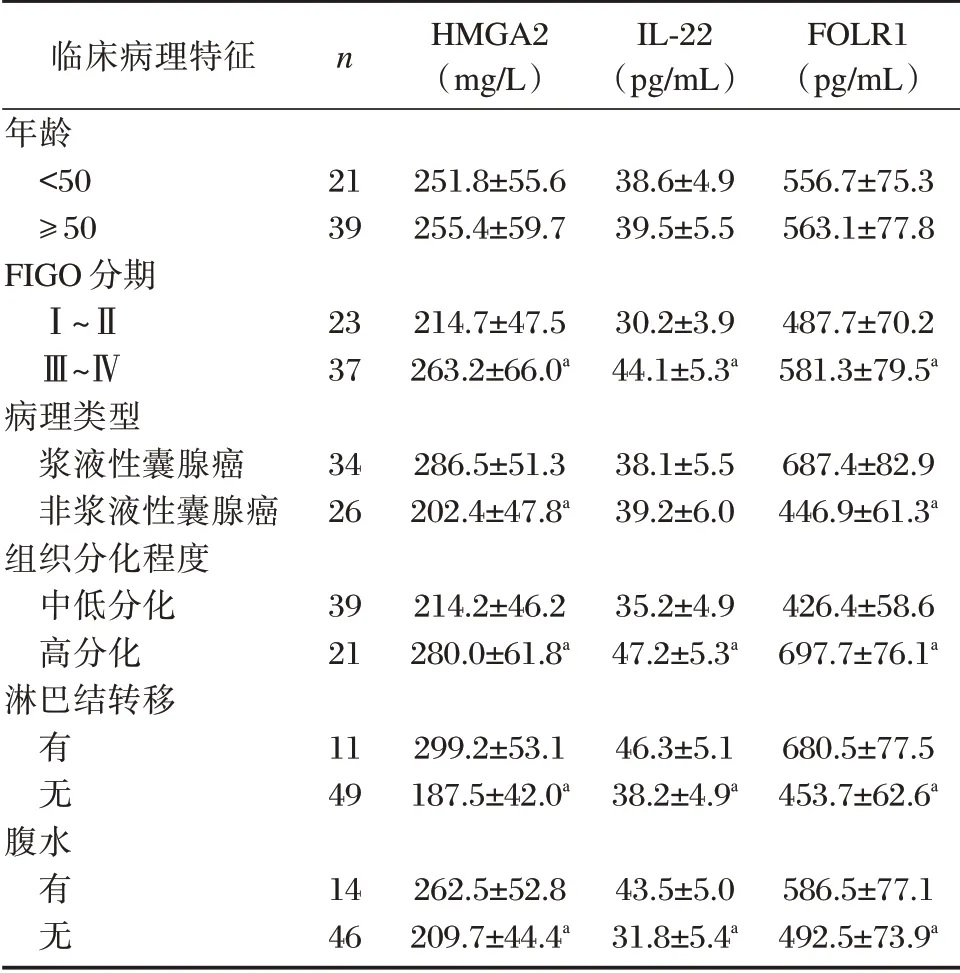
表2 EOC 患者血清HMGA2、IL⁃22、FOLR1 与临床病理特征的相关性分析(±s)Table 2 Correlation analysis of serum HMGA2,IL⁃22,FOLR1 and clinicopathological characteristics in EOC patients(±s)
注:同意临床病理特征内比较,aP<0.05。
临床病理特征年龄<50≥50 FIGO 分期Ⅰ~ⅡⅢ~Ⅳ病理类型浆液性囊腺癌非浆液性囊腺癌组织分化程度中低分化高分化淋巴结转移n HMGA2(mg/L)IL⁃22(pg/mL)FOLR1(pg/mL)21 39 251.8±55.6 255.4±59.7 38.6±4.9 39.5±5.5 556.7±75.3 563.1±77.8 23 37 214.7±47.5 263.2±66.0a 30.2±3.9 44.1±5.3a 487.7±70.2 581.3±79.5a 34 26 286.5±51.3 202.4±47.8a 38.1±5.5 39.2±6.0 687.4±82.9 446.9±61.3a 39 21 214.2±46.2 280.0±61.8a 35.2±4.9 47.2±5.3a 426.4±58.6 697.7±76.1a有无11 49 299.2±53.1 187.5±42.0a 46.3±5.1 38.2±4.9a 680.5±77.5 453.7±62.6a腹水有无14 46 262.5±52.8 209.7±44.4a 43.5±5.0 31.8±5.4a 586.5±77.1 492.5±73.9a
2.3 血清HMGA2、IL⁃22、FOLR1 诊断EOC 的ROC 曲线
血清HMGA2、IL⁃22、FOLR1联合诊断比单独诊断具有更好的灵敏度、特异度及准确度。见表3、图1。
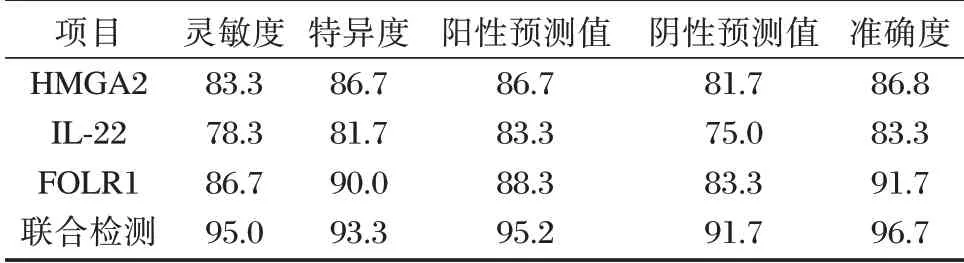
表3 血清HMGA2、IL⁃22、FOLR1诊断EOC的临床价值(%)Table 3 The clinical value of serum HMGA2,IL⁃22,FOLR1 in the diagnosis of EOC(%)

图1 HMGA2、IL⁃22、FOLR1 诊断EOC 的ROC 曲线Figure 1 ROC curve of HMGA2,IL⁃22,FOLR1 in the diagnosis of EOC
2.4 是否复发EOC 患者血清HMGA2、IL⁃22、FOLR1 水平比较
随访期间6 例出现复发,复发率为10.0%。复发组EOC 患者血清HMGA2、IL⁃22、FOLR1 水平明显高于未复发组,差异有统计学意义(P<0.05)。见表4。
表4 不同临床结局EOC 患者血清HMGA2、IL⁃22、FOLR1水平比较(±s)Table 4 Comparison of serum HMGA2,IL⁃22 and FOLR1 levels in EOC pa tients with different clinical outcomes(±s)
组别未复发组复发组t 值P 值n 54 6 HMGA2(mg/L)227.4±53.1 292.6±61.5 2.812 0.007 IL⁃22(pg/mL)37.5±4.7 55.3±5.9 8.590 0.000 FOLR1(pg/mL)546.9±77.8 1057.3±91.6 14.997 0.000
2.5 影响EOC 患者生存率的Cox 回归分析
Cox 单因素回归分析显示,FIGO 分期、组织分化程度、有淋巴结转移、HMGA2、IL⁃22、FOLR1 异常升高是影响EOC 患者复发的危险因素;Cox 多因素回归分析FIGO 分期、有淋巴结转移、HMGA2、IL⁃22、FOLR1 异常升高是导致EOC 患者复发的危险因素。见表5。

表5 影响EOC 患者复发的Cox 回归分析Table 5 Cox regression analysis affecting the recurrence of EOC patients
3 讨论
卵巢癌为恶性肿瘤,其与良性肿瘤相比,肿瘤细胞增殖旺盛,DNA 合成剧增。由于上皮性卵巢癌患者早期无特异性临床症状,多数确诊已处于中晚期,延误了最佳治疗时机,因此寻找高效的诊断方法为临床上关注的重点内容。
HMGA2 是高迁移率蛋白超家族的成员之一,其功能复杂,为胚胎发育早期高表达的蛋白,其在分化成熟的细胞中呈低表达,但在恶性增殖的肿瘤细胞中出现高表达,与肿瘤细胞恶性增殖分化存在密切关系。有研究指出[7],卵巢癌组织中HMGA2 表达为阳性,可作为卵巢癌诊断的潜在肿瘤标志物。本研究结果提示HMGA2 与EOC 的发生发展有关。近年来研究发现[8],HMGA2 表达水平与恶性肿瘤发生、发展、侵袭、转移及预后存在密切关系,高表达HMGA2 患者往往肿瘤恶性程度更高、侵袭能力更强、进展更快、容易发生转移和预后较差,这与本研究的结果相一致。研究认为[9],CD4+T 细胞类型及其相关效应细胞因子参与了多种恶性肿瘤的发生发展。IL⁃22 为Th22 细胞的效应因子,其为IL⁃10 家族新成员,与IL⁃10 一样参与了肿瘤免疫逃逸过程,二者在肿瘤、自身免疫性疾病、感染等发生发展过程中发挥不同程度的作用,IL⁃22 在肿瘤疾病中更具特异性。研究证实[10⁃11],在结肠癌、胃癌患者中IL⁃22 显著上调,并在晚期患者中明显高于早期患者。本研究结果提示,血清IL⁃22 在EOC 患者中存在异常高表达,并参与了EOC 肿瘤的病因学过程。研究认为[12],IL⁃22 可通过活化致癌转录因子STAT3 诱导肿瘤发生和转移,这可能是其在EOC 中发挥作用的主要机制。叶酸受体α 为FOLR1 基因编码并通过糖基磷脂酰肌醇偶联于细胞膜表面的单链糖蛋白,FOLR1 在多种恶性肿瘤细胞的侧膜和底膜上高表达[13]。本研究中,EOC 患者血清FOLR1 水平明显升高,其与HMGA2 均与EOC 患者临床病理特征存在相关性。本研究ROC 分析结果提示,血清HMGA2、IL⁃22、FOLR1 联合检测在EOC 诊断中具有较好的临床价值,可作为EOC 诊断的潜在分子标志物。
本研究中,分析6 例复发EOC 患者,其血清HMGA2、IL⁃22、FOLR1水平明显更高。提示,HMGA2、IL⁃22、FOLR1 异常升高与EOC 患者不良预后相关。Cox 回归分析结果显示,HMGA2、IL⁃22、FOLR1 异常升高是导致EOC 患者生存率降低的危险因素。研究指出,HMGA2 水平越高,卵巢癌患者预后越差[14];赵航发现[15],IL⁃22 与卵巢癌患者预后相关,其在正常人群中低表达,在卵巢癌患者中呈现高表达;梁振等报道显示[16],FOLR1 与卵巢癌患者预后生存较差有关。因此,血清HMGA2、IL⁃22、FOLR1 水平在一定程度上反映了EOC 患者预后情况。
综上所述,血清HMGA2、IL⁃22、FOLR1 水平异常升高与EOC 发生发展、临床生物学行为及预后存在密切联系,可作为EOC 诊断的有效指标。

