增强生物工程化的前交叉韧带基质的表面特性用于即时干细胞治疗
Xiaohua Yu , Paulos Y. Mengsteab , Ganesh Narayanan , Lakshmi S. Nair ,d,e, Cato T. Laurencin ,d,e,f,g,*
a Connecticut Convergence Institute for Translation in Regenerative Engineering, University of Connecticut Health, Farmington, CT 06030, USA
b Raymond and Beverly Sackler Center for Biological, Physical and Engineering Sciences, University of Connecticut Health, Farmington, CT 06030, USA
c Department of Orthopedic Surgery, University of Connecticut Health, Farmington, CT 06030, USA
d Department of Biomedical Engineering, University of Connecticut, Storrs, CT 06269, USA
e Department of Materials Science and Engineering, University of Connecticut, Storrs, CT 06269, USA
f Department of Chemical and Biomolecular Engineering, University of Connecticut, Storrs, CT 06269, USA
g Department of Reconstructive Sciences, University of Connecticut Health, Farmington, CT 06030, USA
1. 引言
前交叉韧带(ACL)是人体膝关节最常见的易损韧带。由于血管形成能力有限,韧带损伤后愈合速度缓慢且效果较差,因此需要进行手术干预。每年在美国进行的ACL重建手术超过2.5 × 105次,医疗系统每年的成本约为180亿美元[1]。目前治疗方法包括使用患者自己的髌骨或半腱肌肌腱(自体移植物)或同种异体移植物[2-4]。与使用自体移植物相关的局限性包括有限的可获得性和潜在的供体部位的发病率。同种异体移植物可能会传播疾病,并有可能引起对宿主不利的免疫原性反应。基于碳纤维、聚对苯二甲酸乙二酯(Leeds-Keio韧带)、聚丙烯(Kennedy韧带增强器)和聚四氟乙烯(Gore-Tex®)合成的不可降解替代品效果有限,并存在应力遮挡、疲劳、蠕变和磨损的碎片,最终会导致骨关节炎和滑膜炎[5-11]。这些合成的替代物作为义肢,并不是用来再生天然ACL组织的。因此,迫切需要开发一种替代治疗策略,促使韧带组织再生。我们初步进行的体外和小动物研究已经证明了开发生物工程化的和可生物降解的三维(3D)支架以支持韧带再生的可行性 [12,13]。
我们首先研究了不同的合成高分子纤维对开发3D构建体的适用性[14]。在研究各种不同的可生物降解的和生物相容性合成聚合物中,选择左旋聚乳酸(PLLA)纤维是由于其结构的完整性和长期的优异机械性能,以及美国食品和药品管理局(FDA)对聚合物临床应用的许可[15]。支架的3D结构在细胞向内生长和组织再生中起着至关重要的作用,并且需要具有与天然ACL类似的可控孔径、集成孔和机械性能[16]。因此,我们开发了一种具有层次结构的编织支架,该结构类似于天然ACL,由PLLA超细纤维组成,以束状排列并缠绕在支架的整个厚度方向上。层次结构由三个区域编织而成:股骨骨道附着位点、关节内区域和胫骨骨道附着位点[17]。改变纤维的取向以引起孔径的变化,促进韧带和骨长入以及这些不同区域中的血管形成。根据骨和软组织长入的最佳孔径的研究表明,骨附着区域的孔径大约为150 μm,而关节内区域的孔径为200~250 μm [18]。另外,编织过程形成了一个连续的相互连接的孔隙结构,增加了细胞附着的可用表面积,通过允许组织在整个基质中长入,可以增强再生反应[16]。我们的体外研究通过显示该结构支持细胞黏附、生长和基质沉积的能力,支持了这一假设[19]。从生物力学的角度来看,骨附着部位相对较小的孔径或较高的编织角度可能会显著改善骨道中的定着能力并提供耐磨性。此外,独特的编织工艺使纤维可以在整个编织厚度上进行编织,增大了编织的韧性和强度,以防止断裂[14]。该设计概念在兔模型中得到初步验证,该研究证实了植入3D支架的可行性以及该结构支持组织长入的能力[12]。通过为期12周的植入研究,我们还证明了将支架与原代ACL细胞相结合产生的效果比不植入细胞的高分子替代物好[12]。因此,细胞接种对生物工程化的ACL替代物的愈合反应和长期性能可以产生有益影响。
再生工程的进展使人们深刻认识到天然细胞外基质(ECM)的表面特性(如表面能、形态和ECM成分)对细胞行为和组织形成的重要性[20]。例如,材料表面能对细胞黏附的影响在文献中已有详细记载:高疏水性(水接触角约为100°或更大)被认为不利于细胞黏附,而高亲水性表面则不利于蛋白质的吸附[21]。Hanson等[22]证明使用氧等离子体处理可以增强间充质干细胞(MSC)在PLLA支架上的黏附。众所周知,特定的ECM亚单元与整合蛋白和其他细胞表面受体相互作用,导致特定的细胞反应,如黏附、增殖和分化[23]。将ECM组件涂覆在支架表面会产生生物指令,从而对细胞反应和组织修复产生有益的影响。该方法的优点如下:①这些蛋白质/糖蛋白易于从天然原料中提取,价格低廉;②采用各种温和的涂覆/沉积方法可以很容易地在支架表面涂覆ECM成分;③通过调节材料表面的化学成分可以有效地调节ECM成分的保留和释放。研究已发现包括I型胶原蛋白和纤连蛋白在内的几种ECM成分在韧带的发育和再生中具有生物活性[24-29]。例如,纤连蛋白的存在增强了支架上的细胞增殖和组织生长[14,18,30,31]。另外,纤连蛋白作为体内发现的最丰富的细胞外糖蛋白之一,在韧带愈合和软组织保护中也发挥着作用[32-34]。
先前的体外研究集中于探究支持韧带再生的最合适的细胞。通过检测生长于3D编织支架上不同类型的细胞,包括跟腱、髌骨肌腱、内侧副韧带和ACL,对细胞中的I型胶原蛋白、III型胶原蛋白和纤连蛋白——细胞分化和基质产生的所有标志物进行表达[19]。与其他细胞相比,三种标志物在ACL细胞中表达水平较高,说明该支架更利于支持ACL细胞功能。将兔的ACL细胞接种到PLLA基质上,以进一步表征细胞反应(如细胞黏附和增殖)。细胞在早期呈球形结构并缓慢地扩张,表明细胞黏附的表面性能欠佳。后续研究将细胞黏附纤连蛋白分子吸收到3D编织物中的PLLA纤维的表面以增强细胞附着力[14]。细胞增殖检测实验和扫描电子显微镜(SEM)图像证实,向支架中添加纤连蛋白可促进细胞生长。Western blot分析显示,与不含纤连蛋白的支架相比,接种于含有纤连蛋白的支架上的细胞产生的I型胶原蛋白表达量增加。因此,利用细胞黏附分子改性生物材料表面是一种很有前途的方法,该方法可以提高细胞黏附效率,有助于细胞增殖以及在3D编织基质上长期生成基质。此外,近来关于在再生工程中使用自体干细胞的证据已经确立了其在发展临床增强韧带重建策略方面的重要性。
近年来,即时诊疗干细胞疗法已成为再生工程领域的重点。即时诊疗干细胞疗法是指从患者体内提取组织,进行处理以产生更高比例的干细胞,然后将干细胞注射回患者体内的过程。骨髓来源的单核细胞(BMMNC)是一种很有吸引力的细胞,因为它们易于与自体细胞分离,具有很高的自我复制能力以及向间充质和非间充质组织分化的能力[35-38]。BM-MNC与可再生工程化支架的结合已被证明是多种组织系统再生的一种临床实用方法[39-45]。例如,研究证明浸泡在骨髓穿刺液中的Healos(I型胶原蛋白/羟基磷灰石基质)可产生与后外侧腰椎融合物中自体髂骨相似的再生能力[45]。因此,ACL再生工程增强合成韧带再生的方法将BMMNC与生物工程化的和可生物降解的3D编织基质结合起来。
这项研究的目的是调节预先建立的3D PLLA生物工程化ACL基质的表面性质,以增强其支持细胞黏附和生长的能力。为此,对PLLA编织的超细纤维基质进行空气等离子体处理,并通过物理吸附法涂敷纤连蛋白,以增强表面润湿性并增加细胞黏附表位。根据孵育时间和纤连蛋白浓度研究纤连蛋白的吸附效率。对于细胞黏附,研究三种不同的空气等离子体处理时间和纤连蛋白浓度。利用临床相关的细胞来源,即兔骨髓来源的间充质干细胞(R-BMMSC)评估这些表面改性对细胞黏附和生长的影响。若经空气等离子体和纤连蛋白吸附处理的PLLA编织的超细纤维基质可以促进R-BMMSC的黏附和增殖,则该表面改性法会成为韧带重建的一种强化的临床策略。
2. 材料和方法
2.1. 材料
PLLA丝线(分子量为120 000 Da;固有黏度为1.2~1.6;每30根长丝为120 Denier),购自Biomedical Structures LLC(美国)。人血浆中的纤连蛋白[目录号(cat#)33016015,GibcoTM,Thermo Fisher Scientific Inc.,美国],分子量为440 000 Da,购自Life Technologies Corporation(美国)。每个药瓶包含1 × 106个细胞的R-BMMSC(cat# RBXMX-01001),购自Cyagen Biosciences Inc.(美国)。CellTiter-Blue®购自Promega Corporation(美国)。Alexa Fluor 488试剂盒的蛋白质缀合染料购自Life Technologies Corporation(美国)。Dulbecco的最低必需孵育基(DMEM; cat# 11995)、青霉素-链霉素(cat# 15070-063)、胎牛血清(cat# 16000-044)、磷酸盐缓冲液(PBS; cat# 10010)和0.05%的胰蛋白酶-乙二胺四乙酸(EDTA; cat# 25300-054)购自Life Technologies Corporation(美国)。
2.2. PLLA编织的超细纤维基质的制备
采用编织技术制备PLLA编织的超细纤维基质。在该技术中,将20条丝线绑扎成丝束。然后将三个丝束分别绑在铰链销上。3D编织基质是通过手动交替的方式使丝线依此移动而制成的。编织完成后,将单个基质(10 mm × 3 mm)切开,并使用电动枪打结其末端。在包含70%乙醇的锥形管(15 mL)中孵育基质,以对其进行灭菌处理,然后在生物安全柜(NuAire,美国)中进行空气干燥。最后将基质的两面都暴露于紫外线(UV,波长为254 nm)30 min,以完成灭菌过程。
2.3. 空气等离子体处理
在Harrick等离子清洁器中,将PLLA编织的超细纤维基质以大约0.2 Torr(1 Torr = 133.322 Pa)的气压和中等功率进行空气等离子体处理,改变曝光时间(分别为5 min、10 min和15 min)。使用配备高速相机的光学接触角(OCA)测角仪(Future Digital Scientific Corp.,美国)进行水接触角(WCA)测量,观察表面处理对亲水性的影响。在WCA测量时,将每根丝线彼此相邻放置以制成扁平样品。然后从丝束上切下1 cm × 5 cm的样品,放置在样品台中,并用双面碳带固定。去离子水以1.5 μL·s-1的速度从50 μL注射器中通过金属针(0.18 mm)。接触后,仪器会自动捕获带有WCA的图像。
2.4. PLLA编织的超细纤维基质上的纤连蛋白吸附
通过纤连蛋白吸附研究纤连蛋白浓度和孵育时间对纤连蛋白覆盖PLLA编织的超细纤维基质的影响。将Alexa Fluor 488染料与纤连蛋白结合以评估纤连蛋白在基质上的分布。按照制造商的说明进行Alexa Fluor 488-纤连蛋白结合。综上所述,将纤连蛋白原液(1 mg·mL-1)加热至室温,并在淡黄色小瓶中与染料混合。蛋白染料通过制造商定制的液相色谱柱洗脱。使用UV分光光度计将洗脱的蛋白质-染料缀合物均匀化和定量化。然后根据Beer-Lambert定律,使用以下公式计算标记的纤连蛋白的摩尔浓度(M):
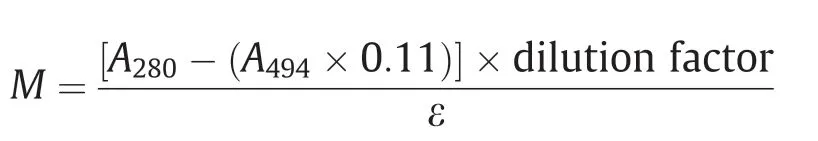
式中,A280和A494分别是染料在280 nm和494 nm处的吸收;ε是 摩 尔衰减 系数(ε= 677 800 L·mol-1·cm-1)。稀 释系数为1,校正系数为0.11,利用校正系数计算染料在280 nm处的吸收。用标记的纤连蛋白原液制备一系列溶液(10 μg·mL-1、25 μg·mL-1和50 μg·mL-1),并将含有纤连蛋白溶液(10 μg·mL-1、25 μg·mL-1和50 μg·mL-1)的基质放在药瓶(2 mL)中孵育。在不同时间段内(30 min、60 min和120 min)进行孵育,并在25 ℃下持续搅拌。然后在PBS中将基质洗涤三次以除去松散结合的纤连蛋白。通过间接测定在酶标仪(synergy™ HT,BioTek Instruments, Inc.,美国)孵育前后溶液中的纤连蛋白浓度可知结合的纤连蛋白含量。
2.5. 细胞孵育
在 装 有DMEM的T-75烧 瓶 中 孵 育R-BMMSC,DMEM中添加了MSC合格的10%胎牛血清,每毫升100单位(1个单位代表0.6 μg青霉素钠的比活度,U·mL-1)青霉素和50 μg·mL-1链霉素。将在37 ℃的孵育箱中的细胞置于95%的湿空气和5%的二氧化碳(CO2)环境下孵育。每两天更换一次孵育基,每四天传代一次。为了将细胞接种到基质上,以每个基质接种1 × 105个细胞的接种密度将基质放置在单细胞24孔组织孵育板中,并传递4~6代。本文就R-BMMSC对PLLA编织的超细纤维基质、PLLA编织的超细纤维基质+纤连蛋白、PLLA编织的超细纤维基质+空气等离子体处理,以及空气等离子体处理和纤连蛋白吸附的基质的响应进行了研究。细胞孵育长达21 d,每隔一天更换孵育基。
2.6. 细胞黏附与增殖
通过不同的孵育时间、空气等离子体处理和纤连蛋白吸附,研究R-BMMSC在PLLA编织的超细纤维基质上的黏附和生长。使用激光共聚焦显微镜和SEM监测细胞黏附。收集样品并用PBS洗涤以去除非黏附细胞,并确定每个时间点(2 h、8 h和24 h)的细胞黏附力。根据制造商的说明,分别使用丝状肌动蛋白(F-actin)和碘化丙啶对黏附的细胞进行细胞骨架蛋白和细胞核染色。染色过程如下:将细胞用PBS彻底漂洗,并在4%的福尔马林中固定20 min。接下来,用0.1%的TritonX-100(在PBS中)将细胞透性化5 min,用PBS进一步洗涤后,添加50 μL F-actin染色[异硫氰酸荧光素(FITC)-共轭鬼笔毒肽(conjugated phalloidin)]溶液。最后,用碘化丙啶将细胞核染色并孵育20 min,然后去除染色溶液,并利用安装在Axiovert 200 M上的Zeiss(德国)激光共聚焦显微镜510 Meta对细胞成像。
另外,通过SEM观察在PLLA编织的超细纤维基质上的细胞形态。为了进行SEM测量,细胞被放在2.5%戊二醛缓冲液中固定1 h,然后使用具有浓度梯度系列的乙醇溶液将固定细胞脱水(在4 ℃下使用30%、50%和70%的乙醇进行梯度脱水,每次20 min;在室温下使用90%、95%和100%的乙醇进行梯度脱水,每次20 min;最后将细胞置于100%乙醇中脱水过夜)。在5 kV的加速电压下使用JSM 6335F(日本电子株式会社)和能量色散X射线光谱仪组件(英国牛津大学)进行SEM实验。在进行SEM实验之前,将样品(直径约0.5 cm)切割并通过双面碳带放置在金属柱上,然后使用Polaron E5100镀膜装置镀金约45 s,以产生10 nm的镀膜。
根据说明书,使用CellTiter-Blue细胞活力测定法(Promega Corporation,美国)检测R-BMMSC在PLLA编织的超细纤维基质上的增殖能力。用PBS彻底清洗细胞,并与10%染料溶液混合放于孵育基中孵育2 h,然后将100 μL的混合物转移到96孔板中,并使用SynergyTMHT微孔板读数器(BioTek Instruments, Inc.,美国)在530 nm/590 nm的激发/发射波长下进行荧光检测。基于具有已知细胞数的标准曲线估计基质上的细胞数。
2.7. 统计分析
使用GraphPad Prism 7.00分析细胞黏附和增殖数据。每个时间点均采用Tukeys post hoc的单因素方差分析。所有数据以平均值±标准偏差展示。p< 0.05为显著性差异。细胞黏附动力学研究中的n= 3。所有其他研究均为n= 4。
3. 结果与讨论
3.1. 纤连蛋白吸附性能的优化
图1为实验分组示意图以及PLLA编织的超细纤维基质的代表性SEM图像。将PLLA编织的超细纤维基质分别用纤连蛋白、空气等离子体处理或空气等离子体、纤连蛋白吸附处理。首先,通过改变纤连蛋白溶液的浓度和孵育时间来评估纤连蛋白在PLLA编织的超细纤维基质上的吸附能力。通过使用荧光标记的纤连蛋白可观察到,纤连蛋白在PLLA编织的超细纤维基质上的吸附能力与使用的纤连蛋白的浓度相关[图2(a)~(d)]。接下来,我们试图确定孵育时间对纤连蛋白吸附能力的影响。结果表明,在25 μg·mL-1的纤连蛋白溶液中孵育120 min会显著增强纤连蛋白在PLLA编织的超细纤维基质上的吸附能力[图2(e)],并显著提高纤连蛋白的吸附效率 [图2(f)]。纤连蛋白的吸附在2 h后开始达到平稳状态,孵育30 min、60 min、120 min后,吸附能力呈非线性趋势。大多数研究表明,孵育时间依赖于所用的纤连蛋白浓度和底物类型,而最佳孵育时间可长达4 h [46,47]。研究发现,纤连蛋白的结合大约在120 min的时间点趋于平稳[图2(e)],这与PLLA薄膜在60 min之前表现出快速的纤连蛋白吸附,以及直至60 min后吸附趋于平稳是一致的[48]。另外,PLLA编织的超细纤维基质的较高表面积可能导致纤连蛋白的结合达到饱和状态的时间增加。
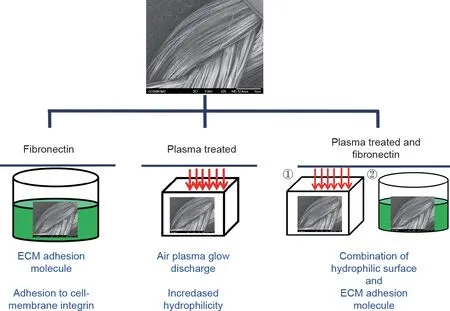
图1. 表面改性技术示意图。上方图片为PLLA编织的仿生基质的代表性SEM图像;左下方图片为在不同浓度的纤连蛋白溶液中孵育PLLA仿生基质;下方中间图片显示的是暴露于空气辉光放电等离子体;右下方图片为将PLLA仿生基质暴露于空气辉光放电等离子体,然后在纤连接蛋白溶液中孵育。
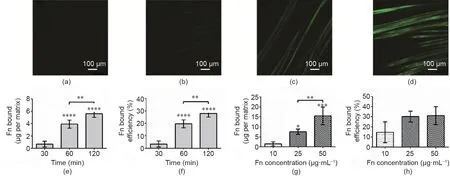
图2. 表面处理对纤连蛋白吸附和PLLA编织的超细纤维基质表面性能的影响。(a)~(d)Fn-Alexa Fluor 488在无纤连蛋白(a)、0.1 μg·mL-1纤连蛋白(b)、1 μg·mL-1纤连蛋白(c)和10 μg·mL-1纤连蛋白(d)的PBS溶液中孵育120 min后在仿生支架上的吸附;(e)纤连蛋白结合(PBS溶液中含25 μg·mL-1)在PLLA编织的超细纤维基质上随时间的变化;(f)如(e)中所述的纤连蛋白结合的效率;(g)以不同浓度孵育120 min后纤连蛋白吸附的变化;(h)如(g)中所述的纤连蛋白结合的效率。*:p < 0.05,**:p < 0.01,***:p < 0.001。
图2(g)表明纤连蛋白的浓度与纤连蛋白对PLLA编织的超细纤维基质的吸附有直接关系。与浓度分别为10 μg·mL-1和25 μg·mL-1的纤连蛋白相比,将基质放在浓度为50 μg·mL-1的纤连蛋白中孵育120 min后,纤连蛋白的吸附会显著增加。但是,对于在50 μg·mL-1溶液中孵育的PLLA编织的超细纤维基质,其纤连蛋白吸附效率与在25 μg·mL-1溶液中孵育的基质的纤连蛋白吸附效率无显著差异[图2(h)]。由于含有纤连蛋白的溶液(25 μg·mL-1和50 μg·mL-1)之间的纤连蛋白结合效率在统计学上相似,因此选择用25 μg·mL-1处理的基质开展进一步的实验。基于该工艺潜在的商业化价值,纤连蛋白吸附效率的重要性不言而喻,因为在这一过程中,效率的提高可以降低加工成本。
我们的研究表明,纤连蛋白的最大吸附量为50 μg·mL-1,结合效率为25 μg·mL-1,生物材料表面的纤连蛋白密度饱和值为10 ~25 μg·mL-1[图2(h)]。纤连蛋白结合效率的平稳状态表现为纤连蛋白单层的饱和,随着纤连蛋白浓度的增加,纤连蛋白的吸附被进一步阻止。这一发现与之前对其他高分子纤连蛋白的观察结果一致[31]。除了蛋白质浓度外,孵育时间在预先确定纤连蛋白吸附率方面也有重要作用。
3.2. 表面改性对R-BMMSC黏附的影响
通过附着在PLLA编织的超细纤维基质上的细胞数量来量化表面改性对R-BMMSC黏附的影响。另外,使用免疫荧光检测法和SEM观察黏附的细胞形态。纤连蛋白的吸附可在24 h的时间点促进细胞黏附,并且在10 μg·mL-1和25 μg·mL-1纤连蛋白溶液中孵育的PLLA编织的超细纤维基质上显示的细胞数量显著增加[图3(a)]。随后进行细胞黏附实验,以了解细胞黏附动力学。在纤连蛋白涂层浓度为25 μg·mL-1的条件下,表征24 h(0.5 h、2 h、4 h、8 h和24 h的时间点)的细胞黏附性。从细胞接种后0.5 h开始,基质上纤连蛋白涂层的存在就显著提高了细胞黏附[图3(b),p≤ 0.0001],并且随着孵育时间的增加,这种趋势继续存在。因为ACL重建手术通常需要1~2 h,在细胞仅接种0.5 h后,细胞黏附性的增加就具有临床意义。
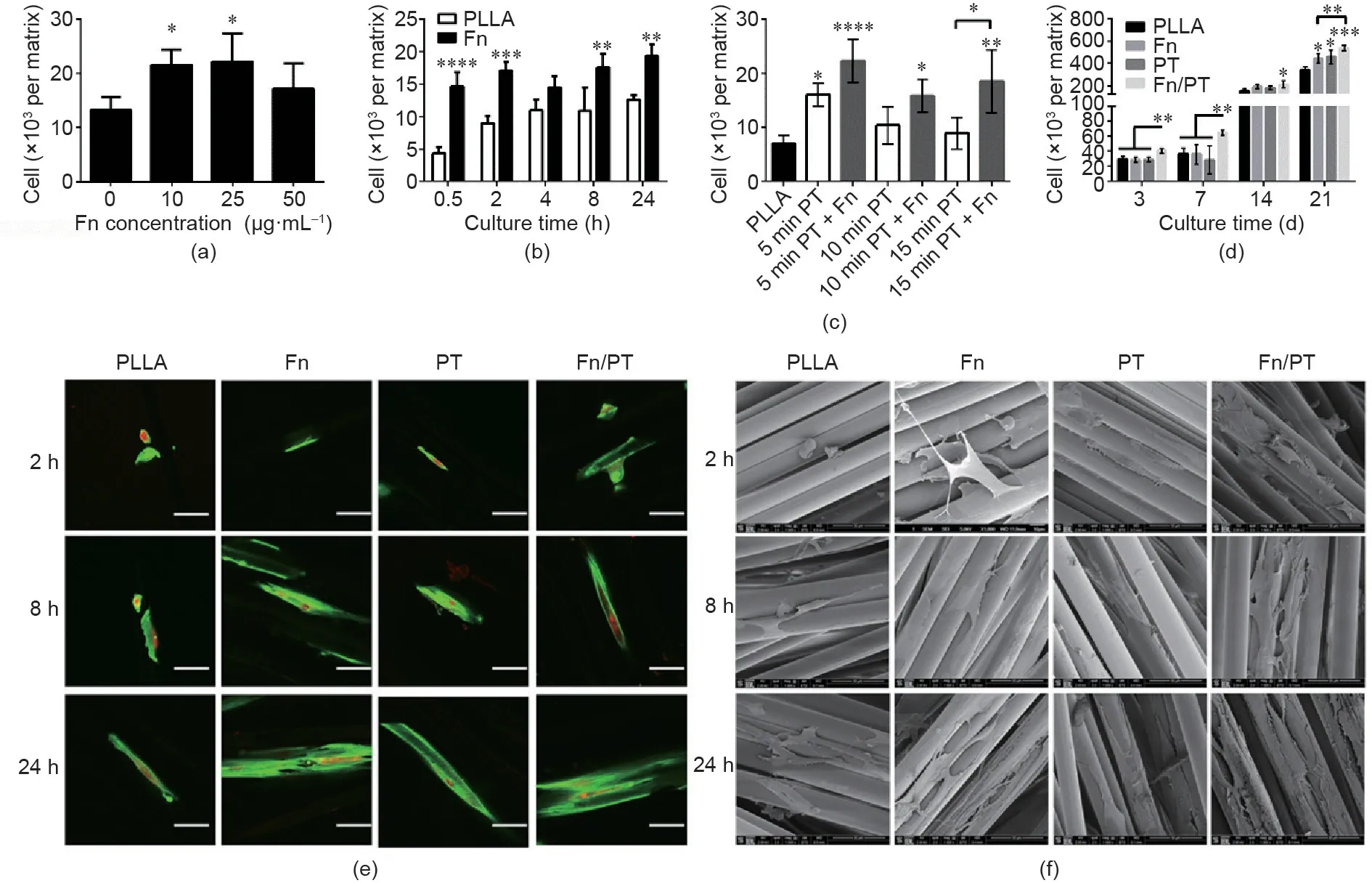
图3. 表面改性对R-BMMSC黏附性的影响。(a)在细胞接种24 h后,R-BMMSC的黏附性随纤连蛋白涂层浓度变化的情况;(b)R-BMMSC在未处理的PLLA ACL基质和含纤连蛋白的PLLA ACL基质上的黏附动力学;(c)等离子体处理和纤连蛋白添加引起的R-BMMSC黏附;(d)优化的表面改性实验组的细胞长期存活率评估[纤连蛋白:在20 μg·mL-1纤连蛋白溶液中孵育;空气等离子体处理(PT):暴露于空气辉光放电等离子体5 min;纤连蛋白/PT:暴露于空气辉光放电等离子体后在纤连蛋白溶液中孵育];(e、f)R-BMMSC黏附性与时间和表面改性的关系:免疫染色(e)和SEM(f)。所有误差条代表标准差。*:p < 0.05,**:p < 0.01,***:p < 0.001,****:p < 0.0001。
研究发现,对PLLA编织的超细纤维基质进行空气等离子体处理可以降低WCA(见附录A中的图S1),并增强R-BMMSC的附着力。等离子体处理的PLLA编织的超细纤维基质在细胞接种24 h后显示出更高的细胞黏附性,并且在空气等离子体处理的基质中添加纤连蛋白可进一步增强R-BMMSC的黏附性[图3(c)]。但是,空气等离子体处理时间超过5 min后,细胞黏附性有下降的趋势。空气等离子体处理一般通过增加亲水性来促进细胞黏附,并且亲水性可以通过增加表面粗糙度[49]或添加官能团(如羰基)来提高[50]。然而,亲水性过强的表面可能会对细胞黏附产生负面影响。WCA在60°和80°之间对于细胞黏附是最佳的,但会因生物材料而异[50]。本研究发现PLLA的WCA为79°,经空气等离子体处理5 min后,降低到49°,并在10 min时进一步降低到44°,这证明了细胞黏附降低的潜在原因。鉴于这些结果,选择空气等离子体处理5 min,以进行后续的长期增殖实验。
图3(e)显示了接种在PLLA编织的超细纤维基质、PLLA编织的超细纤维基质+纤连蛋白、PLLA编织的超细纤维基质+空气等离子体处理、空气等离子体处理和纤连蛋白吸附基质上的细胞形态。2 h后,R-BMMSC在未处理的PLLA编织的超细纤维基质上呈现球形细胞形态。相比之下,在同一时间点,表面改性组中的细胞具有细长的表面形态。在8 h和24 h时,PLLA编织的超细纤维基质上的R-BMMSC倾向于形成细长的细胞形态。然而,在这个时间点,无论是用空气等离子体处理还是用纤连蛋白涂覆的基质联合空气等离子体处理,R-BMMSC都表现出更长的梭形形态和更大的表面积。SEM图像进一步证实了这些观察结果[图3(f)],该图像显示了在2 h的时间点,PLLA编织的超细纤维基质上附着的细胞较少。这一现象在随后的时间点继续存在,即PLLA编织的超细纤维基质上的黏附细胞较少,而空气等离子体处理基质或空气等离子体处理和纤连蛋白吸附基质上的黏附细胞较多。已有类似的关于人骨髓干细胞的细胞黏附动力学结果被报道:Deligianni等[51]表明,接种在羟基磷灰石基质上的人骨髓干细胞在接种后2 h呈圆形,在18 h后开始伸长。也有报道,将纤连蛋白涂覆在载玻片上可使成纤维细胞黏附的时间从316.7 min显著减少到18.92 min,并且在接种后5 h可显著增加细胞延伸的次数[52]。综上所述,这些研究结果表明,纤连蛋白吸附和空气等离子体处理PLLA编织的超细纤维基质是增强细胞黏附性的有效途径。
3.3. R-BMMSC长期存活和ECM沉积
图3(d)显示了R-BMMSC在PLLA编织的超细纤维基质、PLLA编织的超细纤维基质+纤连蛋白、PLLA编织的超细纤维基质+空气等离子体处理、空气等离子体处理+纤连蛋白吸附基质上的细胞长期生长。在第3天和第7天,经空气等离子体处理和纤连蛋白吸附的基质与对照组和其他表面改性组相比,细胞明显增多。这种差异的一个可能的原因是PLLA的表面化学性质。Keselowsky等[53]证明表面化学调节纤连蛋白构象并导致不同的细胞黏附。在第14天,与未改性的PLLA编织的超细纤维基质相比,经等离子体处理和纤连蛋白吸附的基质上的R-BMMSC数量显著增加,但是在经空气等离子体处理或纤连蛋白吸附的组之间没有显著差异。最终,在第21天,空气等离子体处理和纤连蛋白吸附的协同效果均优于未处理的基质和纤连蛋白吸附的基质,但空气等离子体处理基质与空气等离子体处理和纤连蛋白吸附基质之间没有差异。总的来说,对生长到21 d的细胞的评估证明表面改性不具有细胞毒性。
R-BMMSC在各种基质上的分布可以通过SEM和免疫染色法进行可视化,以进一步揭示基质表面改性后的细胞相容性。在孵育21 d后,观察到表面改性组的细胞覆盖率比未改性的PLLA编织的超细纤维基质的更均匀(图4,上部的图)。代表性的细胞核和细胞骨架免疫染色图证实了表面改性组的细胞覆盖率提高,显示了更多的细胞数量和细胞覆盖(图4,下部的图)。
我们还观察到PLLA编织的超细纤维基质中的超细纤维有助于各向异性的细胞排列。研究表明,亚微米排列的纤维具有各向异性的细胞排列,而直径15~20 μm的PLLA超细纤维也可以做到这一点[54,55]。如图5(a)、(b)所示,沿着纤维生长的R-BMMSC,在孵育21 d后,细胞形态呈拉长趋势。此外,我们发现经空气等离子体处理和纤连蛋白吸附改性的PLLA编织的超细纤维基质与对齐排列的R-BMMSC融合[图5(d)、(e)]。此外,空气等离子体处理和纤连蛋白吸附基质的协同效应导致在第21天时纳米纤维ECM沉积[图5(f)]。纳米纤维ECM沉积表明,表面协同处理可以很好地刺激新的组织基质以对齐排列的方式形成,这将有助于提高植入的PLLA编织的超细纤维基质的机械强度。随着基质在体内降解,ACL的机械载荷将转移到沉积的ECM。因此,随着时间的推移,高度对齐排列的ECM对于最大化移植物的抗张强度很重要。
由本研究可知,通过空气等离子体处理和纤连蛋白改性PLLA编织的超细纤维基质的表面,在细胞接种后30 min内可以显著增强细胞黏附性。此外,R-BMMSC的形态在改性表面上可较早地伸长。对于PLLA编织的超细纤维基质,早期的细胞黏附和伸展对于在骨科应用过程中潜在应用即时诊疗干细胞疗法非常重要。骨髓穿刺浓缩液在ACL重建中的应用近来受到关注[56]。因此,在手术过程中增强细胞黏附性将有利于在植入过程中促进细胞在基质上的保留。尽管本文没有进行相关研究,但是已知细胞伸展与细胞黏附强度有关[57],并且足够的细胞黏附强度对于承受植入过程中施加在基质上的力是必需的。未来会进行PLLA编织的超细纤维基质在表面改性后对细胞黏附强度影响的相关研究,并进一步研究体内反应。
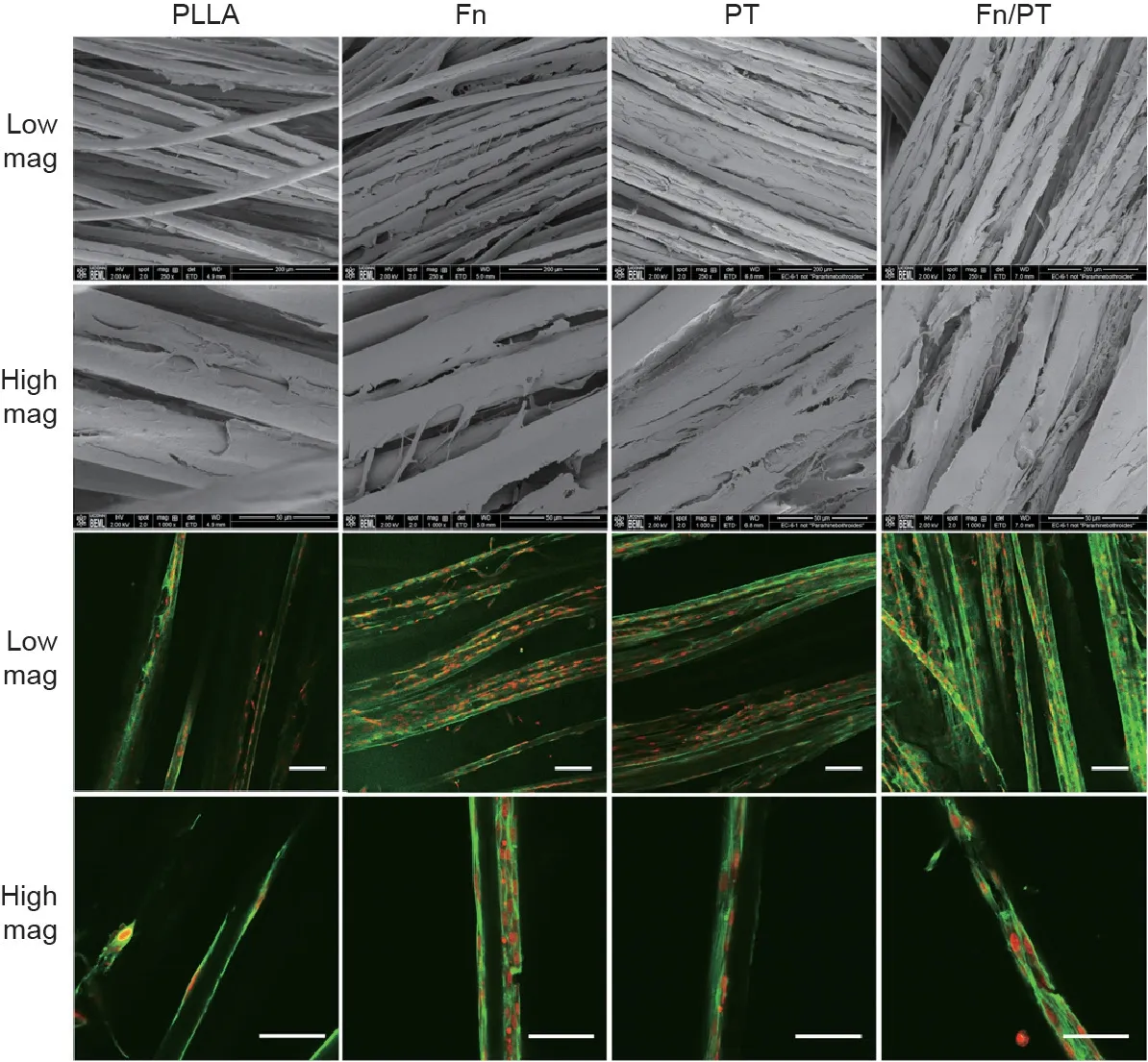
图4. 在不同处理条件下各种基质的R-BMMSC生长和分布。生长在基质上的R-BMMSC的SEM显微照片(上部的图)显示,在第21天,与PLLA对照组相比,纤连蛋白、PT和纤连蛋白/PT组的细胞分布更均匀;生长在基质上的R-BMMSC的免疫染色(下部的图):绿色表示肌动蛋白,红色表示细胞核(低倍率比例尺:1∶100 μm;高倍率比例尺:1∶50 μm)。
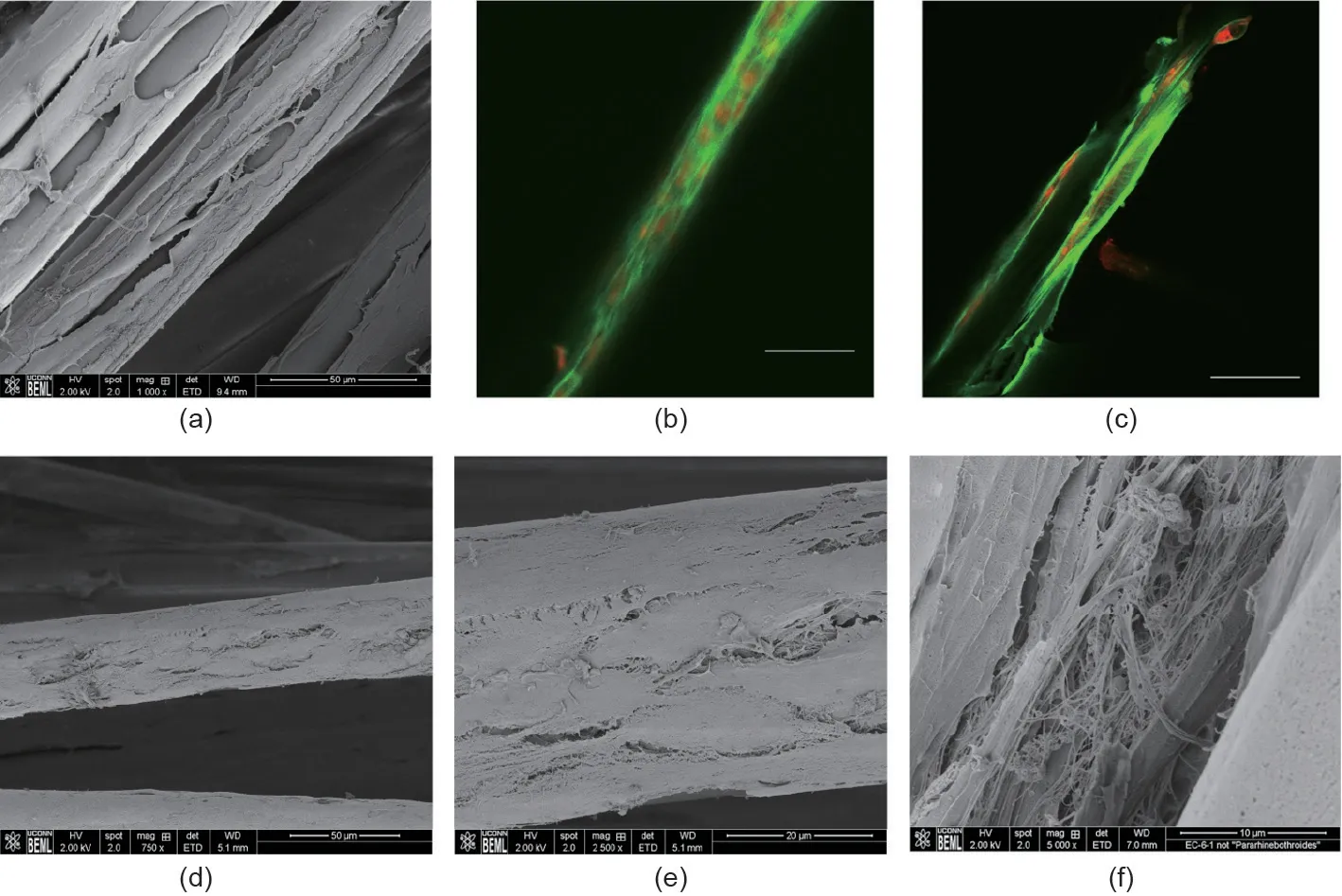
图5. 在第21天,在纤连蛋白/PT处理的基质上,R-BMMSC排列和ECM沉积。(a)纤连蛋白/PT基质上的R-BMMSC拉长;(b)、(c)R-BMMSC细胞骨架在纤连蛋白/PT上的免疫染色;(d)、(e)孵育21 d后,覆盖R-BMMSC的PLLA超细纤维(在纤连蛋白/PT组)的SEM显微图像; (f)R-BMMSC在PLLA超细纤维上沉积的纳米纤维ECM。
4. 结论
目前,PLLA编织的超细纤维基质可作为ACL重建的自体移植和同种异体移植的可行替代方法。PLLA编织的超细纤维基质的优势在于,在患者与患者之间的组织差异性存在的情况下,它提供了一致的材料性能。利用空气等离子体处理和纤连蛋白吸附,对PLLA编织的超细纤维基质进行表面改性后,可显著增强细胞在基质上的黏附和生长。PLLA编织的超细纤维基质增强了细胞黏附性能,可在基质植入前产生更大的细胞黏附,这对于诸如骨髓穿刺浓缩液的应用等即时诊疗具有吸引力。因表面改性的PLLA编织的超细纤维基质而增强的细胞黏附性和增殖能力可能会导致体内ACL的再生能力的增强。
Acknowledgements
This research was supported by funding from the Raymond and Beverly Sackler Center for Biomedical, Biological, Physical and Engineering Sciences (NIH R01AR063698, NIH R01AR063698-02S1, and NIH DP1 AR068147). The authors wish to disclose that Cato T. Laurencin and Lakshmi S. Nair have ownership and company interests in Biorez, Incorporated.
Authors’ contribution
Xiaohua Yu performed experiments, performed data analysis, and prepared figures. Paulos Y. Mengsteab performed experiments, performed data analysis, prepared figures, and wrote the manuscript. Ganesh Narayanan assisted in manuscript composition. Lakshmi S. Nair and Cato T. Laurencin oversaw experiments and assisted in manuscript composition.
Compliance with ethics guidelines
Dr. Cato T Laurencin has the following competing financial interests: Biorez, Globus, HOT, HOT Bone, Kuros Bioscience, NPD & Cobb (W Montague) NMA Health Institute. Dr. Lakshmi S Nair has the following competing financial interests: Biorez. Xiaohua Yu, Paulos Y. Mengsteab, Ganesh Narayanan, Lakshmi S. Nair, and Cato T. Laurencin have no other conflict of interest (non-financial) to disclose.
Appendix A. Supplementary data
Supplementary data to this article can be found online at https://doi.org/10.1016/j.eng.2020.02.010.

